XPO4基因对人肝癌细胞抑制作用的研究
2021-01-06王晓梅
吴 楠 刘 侃 王晓梅
1.深圳市南山区疾病预防控制中心疾病预防科,广东深圳 518054;2.深圳大学医学部肿瘤研究所,广东深圳 518000
肝癌是全球高发的肿瘤之一,恶性程度高,预后生存期短,致死率高[1]。抑癌基因失活是肝癌发生发展机制中重要的遗传学基础[2]。2008年科学家应用特异性高的RNAi 筛选方法[3],得到了12个新的抑癌基因,XPO4 就是其中一种。XPO4是细胞核转运因子家族成员,可调节Smad3[转化生长因子-β(TGF-β)信号传导中的组分]和Eif5a(两个密切相关的翻译起始因子)[4-6]。XPO4 在细胞中的去除会引起细胞癌变的概率增加[7-8]。有研究表明,肝癌中XPO4 的表达降低与肿瘤大小及病理分级相关,XPO4 的缺失提示预后差,且可以作为一个独立的危险因子[9-10],目前利用XPO4基因开展肿瘤治疗研究的报道较少。本研究构建表达XPO4基因的载体,研究XPO4基因对肿瘤细胞的抑制作用,现报道如下。
1 材料与方法
1.1 材料
真核表达质粒pcDNA3.1 购自Invitrogen公司;携XPO4基因质粒pCR4-TOPO-XPO4 购自Invitrogen公司;人肝癌细胞株SK-Hep1(XPO4基因完全缺失)由香港中文大学胡宝光博士惠赠;大肠埃希菌菌株DH5a 由深圳大学医学部肿瘤研究所保存。
1.2 方法
1.2.1 pcDNA3.1-XPO4 载体的构建 XPO4基因上游引物:5′-GGGGGTACCATGGTCAATAATGAACAA-3′;下游引物:5′-GGGGATATCTTATTTTACACAAAGGAG-3′。以pCR4-TOPO-XPO4 为模板,PCR 扩增XPO4基因。酶切pcDNA3.1 质粒和目的基因XPO4,16℃连接过夜(试剂盒购自Takara公司)。转化大肠埃希菌DH5a,无内毒素质粒提取(试剂盒购自OMEGA公司)。
1.2.2 细胞体外转染 将SK-Hep1 细胞接种至6 孔板,每孔2 mL,细胞密度为2×105个/mL,12 h后进行质粒转染,pcDNA3.1-XPO4 质粒转染SK-Hep1 细胞,按 照Lipofectamine3000 转染试剂(Invitrogen公司)的说明书进行。
1.2.3 蛋白表达检测 按照Western Blot 实验方法,主要试剂XPO4 一抗(Thermo公司);β-actin 一抗(北京博奥森公司);羊抗兔二抗(武汉博士德公司)。
1.2.4 XPO4基因体外抑瘤实验 以SK-Hep1 细胞接种于96 孔培养板中,每孔100 μL,细胞密度为2×104个/mL。12 h后进行质粒转染,采用CCK-8 检测细胞存活率。将SK-Hep1 细胞接种至6 孔板,每孔2 mL,细胞密度为2×105个/mL,12 h后进行质粒转染,采用Annexin V-FITC/PI 检测细胞凋亡。
1.3 统计学方法
采用SPSS 19.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用T检验,多组间比较采用单因素方差分析;计数资料用率表示,两组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 XPO4基因PCR 产物鉴定
用1%琼脂糖凝胶电泳检测XPO4 的PCR 产物,在3000~4000 bp 有一条带,大小与预期相符(图1)。
2.2 重组载体的酶切鉴定
用KpnⅠ和EcorⅤ双酶切pcDNA3.1-XPO4,对照质粒为pcDNA3.1,XPO4基因正确插入pcDNA3.1载体中(图2)。
2.3 pcDNA3.1-XPO4 转染后XPO4 蛋白表达
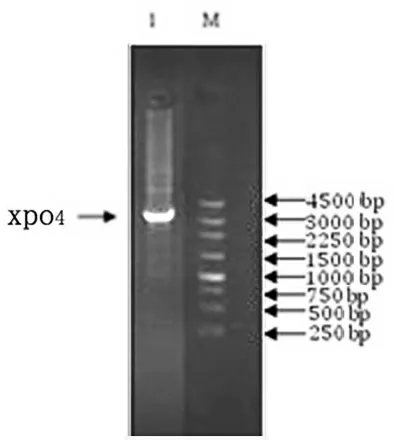
图1 XPO4 的PCR 扩增图
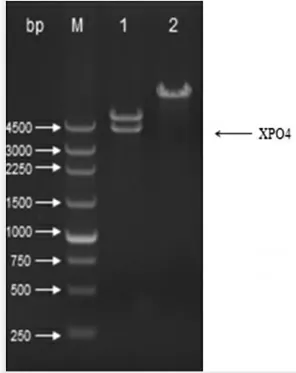
图2 pcDNA3.1-XPO4 质粒酶切图
在重组质粒pcDNA3.1-XPO4 转染组中,有XPO4蛋白表达,在SK-Hep1 细胞对照组和pcDNA3.1 空质粒转染组中,没有XPO4 蛋白表达(图3)。
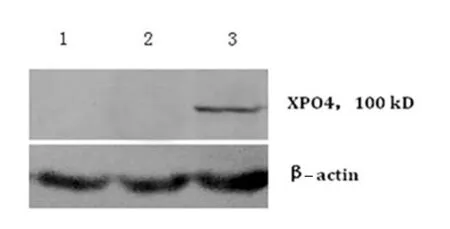
图3 Western BloT检测XPO4 蛋白表达
2.4 pcDNA3.1-XPO4 体外对肿瘤细胞增殖的抑制作用
重组质粒pcDNA3.1-XPO4 转染组的细胞存活率低于SK-Hep1 细胞对照组和pcDNA3.1 空质粒转染组,差异有统计学意义(P<0.001)。SK-Hep1 细胞对照组的细胞存活率与pcDNA3.1 空质粒转染组比较,差异无统计学意义(P>0.05)(图4)。2.5 pcDNA3.1-XPO4 体外对肿瘤细胞凋亡的作用
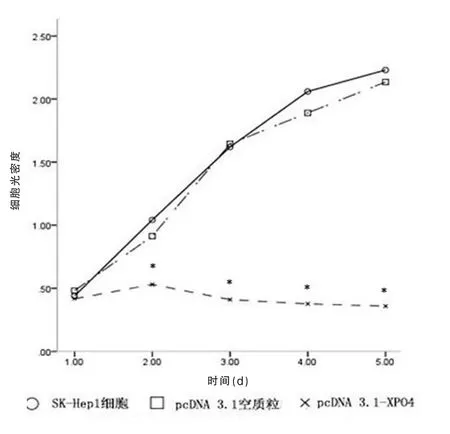
图4 CCK-8 检测SK-Hep1 细胞增殖
重组质粒pcDNA3.1-XPO4 转染组细胞的早期凋亡率[(13.89±1.62)%]高于SK-Hep1 细胞对照组[(5.14±1.13)%]和pcDNA3.1 空质粒转染组[(5.79±2.11)%],差异有统计学意义(P<0.001)。SK-Hep1 细胞对照组细胞的早期凋亡率与pcDNA3.1 空质粒转染组比较,差异无统计学意义(P>0.05)(图5)。
3 讨论

图5 Annexin V-FITC/PI 检测XPO4 表达对SK-Hep1 细胞凋亡的影响
肝癌发病机制复杂,常与相关基因的突变或积累有关。基因治疗已成为癌症治疗的重要研究领域,因此,寻找高效的抑癌基因是肿瘤治疗进一步发展的重要方向。近年来研究发现,真核细胞的细胞核与细胞质之间存在物质交换,细胞核向细胞质输出许多种类的大分子。出核转运通过核孔复合物(NPC)通道和选择性转运蛋白,同时也依赖核输出信号结合受体,如XPO4[4]。XPO4 也称为Exportin 4,可能是一种重要的抑癌基因。本研究探讨XPO4 在人肝癌细胞株SKHep1 中的表达对该肿瘤细胞生长增值的影响,结果显示,pcDNA3.1-XPO4 质粒转染至SK-Hep1 肝癌细胞中,XPO4 在SK-Hep1 中表达。表达的XPO4可以抑制SK-Hep1 细胞的生长增殖和诱导凋亡。XPO4 抑制肿瘤的机制可能是通过调节Eif5a 和Smad3 蛋白水平来进行[11]。细胞中XPO4 缺失,影响Smad3 出核,而Smad3 蛋白是TGF-β 的配体,细胞核Smad3 的增加,伴随TGF-β基因上调,这种影响很好地解释了当XPO4基因缺失导致TGF-β信号通路的紊乱,使细胞逃逸TGF-β 介导的生长抑制效应,导致多种肿瘤发生[5,12-13]。近年来的研究发现,Eif5a 在人癌细胞中总体上来说是过度表达的,肿瘤的恶性程度尤其是肿瘤的恶性增值能力、转移能力与肿瘤细胞内表达的Eif5a密切相关,如果细胞内缺乏XPO4 则有助于Eif5a 的出核,通过XPO4-Eif5a 这一信号通路刺激肿瘤细胞增殖[14-16]。
为了揭示XPO4 对肿瘤细胞的影响,本研究制备了携带表达XPO4基因的pcDNA3.1-XPO4 质粒载体,选择肝癌细胞SK-Hep1 进行实验。SK-Hep1 细胞系中缺失XPO4基因,通过转染SK-Hep1,引起XPO4在细胞中表达。CCK-8 检测细胞增殖显示,重组质粒pcDNA3.1-XPO4 转染组的细胞存活率低于SK-Hep1细胞对照组和pcDNA3.1 空质粒转染组,差异有统计学意义(P<0.001),提示XPO4基因表达能抑制肿瘤细胞生长。重组质粒pcDNA3.1-XPO4 转染组细胞的早期凋亡率高于SK-Hep1 细胞对照组和pcDNA3.1空质粒转染组,差异有统计学意义(P<0.001),提示XPO4基因表达对肿瘤细胞有杀伤作用。SK-Hep1 细胞对照组的细胞存活率和早期凋亡率和pcDNA3.1空质粒转染组比较,差异无统计学意义(P>0.05),提示XPO4基因可能参与并发挥重要的抑制肿瘤进程的作用。
Liang 等[10]通过对临床肝癌手术患者的病理检测,发现XPO4 在癌旁组织中的表达,高于肿瘤组织,且肿瘤越大表达量越低,提示XPO4可能参与肿瘤进程。Zender 等[11]将肝癌易感小鼠模型和RNAi 技术结合,在小鼠模型中将XPO4 沉默后可引起肿瘤,因此也进一步获得XPO4 作为抑癌基因的证据。
综上所述,肝癌细胞系SK-Hep1 模型不表达XPO4,而通过构建的重组质粒载体转染,可以在肝癌细胞成功表达XPO4基因,有效抑制肿瘤细胞的增殖和诱导凋亡。因此XPO4基因作为抑癌基因对肿瘤治疗具有极大的潜力,增强XPO4基因的表达可以为临床治疗肝癌提供参考依据。同时仍需深入研究肝癌的发生机制[17-18],更好地了解XPO4基因抑癌的原因,为疾病的诊断与治疗提供新的方向。
