锌掺杂氧化镍空心球的制备
2021-01-06彭子童姚军龙江学良
彭子童,姚军龙,姚 楚,江学良
(武汉工程大学材料科学与工程学院,湖北 武汉 430205)
随着科技的发展,超级电容器逐渐发展成为了介于传统超级电容器和电池之间的一种可以快速充放电,同时还具备与电池相同的储能机理、环境友好且无可替代的新型储能器件[1-3]。与传统电容器不同,超级电容器不仅能快速传输能量,有高的功率密度和能量密度,同时还具有寿命长和可回收性良好等特点[4-6]。作为新型储能器件,普通超级电容器的电极材料包括过渡金属氧化物、导电聚合物以及各种形式的碳材料等。其中,金属氧化物基于活性物质的氧化还原反应可以存储电荷,通常表现出比其他材料更高的比电容性能。最近的研究表明,由于过渡金属氧化物氧化镍具有较高比电容量、低成本和环境友好等特点,已经成为了一种有前途的超级电容器电极材料[7-8]。但是,NiO本身是一种电化学可逆性差、极化率低的p型半导体,由于其内部结构纠缠,NiO的载流子无法流动,从而导致电导率较低[9]。
为了克服NiO自身特性带来的限制,进行了许多相关研究。结果表明,中空多孔结构可提供丰富的三维介孔,增加活性物质与电解质的接触面积,拓宽离子扩散通道,促进电解质离子的快速扩散,提高电化学反应效率和NiO的电导率[10-12]。庞[13]使用草酸镍钴水合物作为前驱体,通过简单的沉淀法合成以及退火法获得了分层结构,表现出更丰富的介孔和较高的比表面积[14-16]。然而,沉淀法具有许多缺点,例如所制得的胶体状样品难以洗涤,产物易与杂质混合,且粒度难以控制。 Ahmed[17]以十六烷基三甲基溴化铵(CTAB)为表面活性剂,通过溶胶-凝胶法制备了一系列新型的介孔NiO/TiO2纳米粒子。与沉淀法不同,溶胶-凝胶法具有控制粒径均一、在较低温度下易于反应的优点。但是,通常用溶胶-凝胶法制备样品的原料价格昂贵、对健康有害、反应时间过长,且煅烧过程中气体和有机物的逸出容易导致孔隙塌陷。 Hao[18]以柠檬酸锌为模板,通过离子交换和化学蚀刻成功地制备了具有多孔结构的空心NiO微球。这种独特的中空多孔纳米结构提高了传质速率,缓解氧化镍空心球在循环过程中体积的急剧变化,有利于电化学性能的提高。但是,以模板法制备存在成本过高的问题[19]。因此,迫切需要开发一种新颖的制备NiO空心微球的有效方法。
以六水合硫酸镍(NiSO4·6H2O)为原料,聚乙烯吡咯烷酮(PVP)为表面活性剂,通过一步水热法成功合成了锌掺杂氧化镍空心球(Zn-NiOHS)。从材料设计的角度来看,导电性良好的过渡金属元素Zn被掺入NiO中,解决了充放电反应不完全的问题,可以降低电阻,提高放电效率,从而达到提高材料循环性能的效果。通过SEM、TEM对锌掺氧化镍空心球(Zn-NiOHS)的形貌结构进行了表征,并对其进行了电化学性能测试,研究了空心球的形貌和不同掺杂量对Zn-NiOHS电化学性能的影响。
1 实验部分
1.1 主要试剂和原料
主要试剂和原料包括葡萄糖(C6H12O6,国药集团化学试剂有限公司,AR)、甲醛溶液(国药集团化学试剂有限公司,AR)、六水合硫酸镍(Ni(SO4)2·6H2O,国药集团化学试剂有限公司,AR)、六水合硝酸锌(Zn(NO3)3·6H2O,国药集团化学试剂有限公司,AR)、环六亚甲基四胺(C6H12N4,国药集团化学试剂有限公司,AR)、聚乙烯吡咯烷酮(PVP,西陇化工股份有限公司,AR)和尿素(CO(NH2)2,西陇化工股份有限公司,AR)。
1.2 主要仪器和设备
主要仪器和设备包括D8 Advance 型X射线衍射仪(德国Bruker公司)、JSM-5510LV型扫描电子显微镜(日本JEOL公司)、JEM-2100型透射电子显微镜(日本JEOL公司)和上海辰华CH6700型电化学工作站。
1.3 锌掺杂氧化镍空心球的制备
将4 g葡萄糖和100 mL去离子水加入到250 mL的烧瓶中,磁力搅拌10 min,加入4 g甲醛溶液、2 mL已配好的0.1 mmol/L的硫酸镍溶液、3 g尿素以及3 g环六亚甲基四胺,常温磁力搅拌至固体完全溶解,缓慢加入PVP以及不同质量分数的Zn(NO3)3溶液(Zn:Ni=1%,2%,3%和4%),边加入,边搅拌,直至所有原料混合均匀。将混合溶液倒入带有聚四氟乙烯内衬的高温高压反应釜中,升温到180℃,反应6h。待反应结束后,自然冷却到常温,取出反应后的混合液,分别用无水乙醇和去离子水清洗3次,在80℃下,烘干6h后得到褐色物质,即为前躯体/C球复合微球。将得到的前躯体/C球复合微球放入马弗炉中,500℃煅烧2h后自然冷却,得到最终产物为Zn-NiOHS。
2 结果与讨论
2.1 X射线衍射分析
图1a所示为NiOHS、1%Zn-NiOHS、2%Zn-NiOHS和4%Zn-NiOHS的X射线衍射图。从图中可以看出,衍射峰的位置与标准衍射卡(JCPDS#47-1049)基本一致,衍射角2θ在37°,43°,63°,75°和79°处的衍射峰分别对应于(110),(200),(220),(311)和(222)晶面,无其他衍射峰出现,证明实验已经成功制备出立方相NiO。图1b是位于(200)晶面的衍射峰,从图中可以看出,掺杂使得位于(200)晶面上NiO衍射峰的半峰变宽,衍射峰向小角度偏移,导致样品的晶格常数增加。主要是因为Zn2+的半径(0.74 nm)与Ni2+的半径(0.72 nm)相似,Zn2+可以进入到NiO晶格内部替代Ni2+,导致发生晶格畸变和晶格膨胀,在晶体框架内或在NiO表面处形成Zn-O-Ni键,并且通过限制晶体之间的接触来抑制微晶的生长。

图1 不同样品的X射线衍射谱图
2.2 扫描电镜分析
图2是NiOHS和不同Zn含量的Zn-NiOHS的SEM图像。图2a为NiOHS的SEM图像,可以清楚地看到,NiOHS粒径大小均一,且分散性良好。图2b、图2c和图2d分别是1%,2%和4%Zn掺杂量的Zn-NiOHS,可以看出1%Zn-NiOHS的形态没有显著变化,与NiOHS同样具有均一的尺寸和良好的分散性(图2b);2%Zn-NiOHS的形状最规则,没有明显的团聚,并且粒径分布均匀,平均粒径约为2 μm左右(图2c)。随着锌掺杂量的增加,NiOHS逐渐开始团聚,当Zn的掺杂率达到4%时,Zn-NiOHS出现部分团聚,粒径变大,表面粗糙,说明过量的Zn掺杂会使得NiOHS分散性变差,容易出现团聚(图2d)。

图2 不同样品的扫描电镜图
2.3 透射电镜分析
图3是NiOHS和2%Zn-NiOHS的TEM图像。与NiOHS相比,2%Zn-NiOHS的粒径尺寸更大,表面更光滑。由图3b可以看出,球体内部为明显的中空结构,球体边缘颜色明暗对比强烈,且平均粒径大约为2 μm,壁厚约50 nm。证明所制备的2%Zn-NiOHS为独特的空心球结构。

图3 不同样品的透射电镜图
2.4 电化学测试分析
图4为不同样品分别在扫速为5mV/s、10 mV/s、15 mV/s、20 mV/s和30 mV/s下的循环伏安曲线。图4a是粉体NiO的循环伏安曲线,图4b是NiOHS的循环伏安曲线,图4c,4d和4e是不同Zn含量的Zn-NiOHS的循环伏安曲线,图4f是不同样品在不同扫速下的比电容量。通过图4a-e中循环伏安曲线可知,相关电极材料的比电容来自于NiO基电极材料快速可逆的氧化还原反应,从图中可以看出,位于0.45 V左右的氧化还原峰对应Ni2+→Ni3+的氧化反应,位于0.3 V左右的还原峰对应Ni3+→Ni2+的还原反应,在电压扫描方向快速转变时,电流具有很快的响应速度,说明电极材料拥有很好的可逆性和电容性。通过积分CV曲线计算样品的比容量,计算出不同样品在不同扫速下的比电容量(Cs),具体计算结果见图4f,在5 mV/s 扫速下,NiOHS的比电容量为294.32 F/g,随着Zn元素的掺杂,Zn-NiOHS的比电容开始提高,并且2%Zn-NiOHS的比电量最高达到357.08 F/g,但是,4%Zn-NiOHS的比电容量开始下降到256.68 F/g。可见,适量的Zn掺杂量可以提高样品的比容量,但是过多的Zn掺入反而会引起比容量的下降。当扫描速度较快时,只有少数电解质离子能够通过通道达到活性物质的内部,使得活性物质的氧化还原反应程度不高,比容量下降。

图4 不同样品在不同扫速下的循环伏安曲线
图5 为不同样品在低频区的交流阻抗谱图,可以明显看出,商业粉体NiO的斜率最小,随着Zn元素的掺杂,Zn-NiOHS的内阻相较NiOHS有所降低;Zn-NiOHS在高频区的直径都小于NiOHS,这表明了Zn的掺入可以促进电荷的转移;2%Zn-NiOHS在低频区的斜率达到最大,证明离子的扩散程度最佳,而过多的Zn掺入反而会阻碍NiOHS中电荷及离子的传递。

图5 不同试样的交流阻抗谱图
图6是2%Zn-NiOHS在不同电流密度下的放电曲线,根据GCD计算比电容量公式可得在0.5A/g的充放电流密度下,2%Zn-NiOHS比电容量最大,为255.28 F/g。此外,在电流密度为1 A/g时,2%Zn-NiOHS的比电容量为167.3 F/g。而在充放电电流的密度为2 A/g、3 A/g时,比电容量分别是97.44 F/g、54 F/g。以3 mol/L KOH溶液为电解质溶液,在1A/g电流密度下对2%Zn-NiOHS进行1 000次重复充放电性能测试。图7为2%Zn-NiOHS充放电循环次数-电容保持量曲线,曲线反应了2%Zn-NiOHS的循环寿命。从图中可知,2%Zn-NiOHS在第一次充放电时比电容就达到最大值,且随着循环次数的增加,比电容量逐渐减小。这是因为在充电和放电测试期间,样品上的应力增加使得电极材料本身的结构塌陷。当循环300次时达到稳定,保持在80%左右。这表明2%Zn-NiOHS循环1 000次后表现出良好的化学稳定性和一定的可逆性。

图6 2%Zn-NiOHS在不同电流密度下的恒流放电曲线
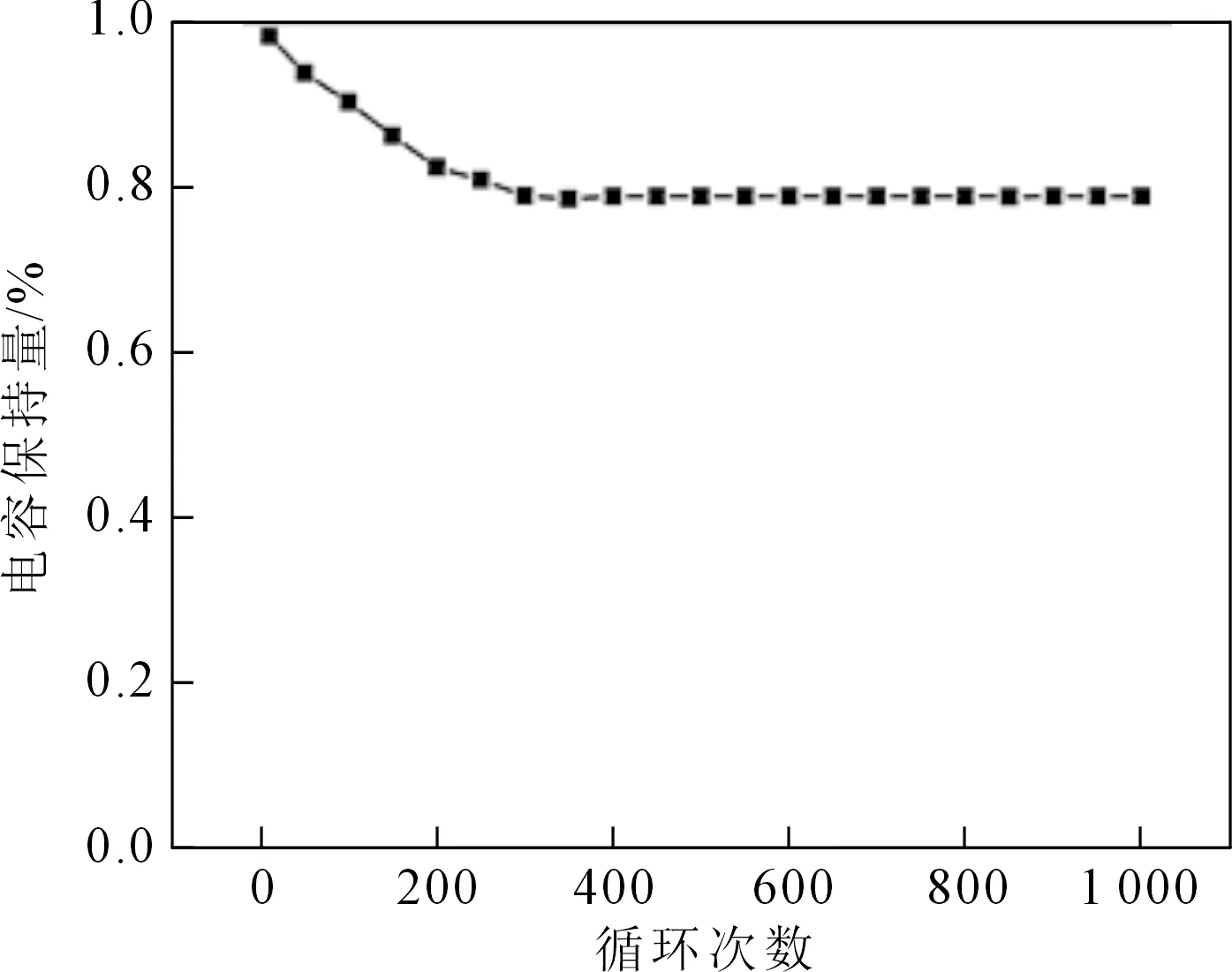
图7 在1A/g电流密度下的循环次数-电容保持量曲线
2.5 Zn掺杂氧化镍空心球的合成机理分析
图8为Zn-NiOHS的合成机理。以葡萄糖、硫酸镍为原料,硝酸锌作为掺杂锌源,在表面活性剂PVP的作用下,通过水热反应将阳离子(Ni2+和Zn2+)吸附到碳层表面,然后煅烧除去碳层,最终得到Zn-NiOHS。根据氢氧化物沉淀的理论,因为Zn(OH)2的溶度积常数(Ksp=3.47×10-17)小于Ni(OH)2的溶度积常数(Ksp=6.31×10-16),所以Zn(OH)2与Ni(OH)2相比,更容易生成,在水热反应过程中,碳层更容易被Zn(OH)2覆盖。此外,Zn2+半径(0.074nm)和Ni2+半径(0.072nm)相似,Zn2+可能会替换氧化镍晶格部分Ni2+,形成Ni-O-Zn键,引起晶格畸变,但不会改变氧化镍的最终晶型[20-21]。因此,适量的Zn掺杂使得锌离子在煅烧过程中更容易在碳层的表面附着,并且反应速度更快。然而,当掺杂量较小时,反应速度相对较慢,并且在煅烧过程中很可能发生结构崩塌。当掺杂量较大时,晶格畸变严重,容易引起表面粗糙。

图8 水热法合成Zn-NiOHS的合成机理
3 结语
本文以葡萄糖、硫酸镍为原料,硝酸锌作为掺杂锌源、PVP为表面活性剂,利用水热法制备出了粒径约为2 μm的氧化镍空心球。结果表明,当锌的掺杂量为2%时,所得空心球没有明显的团聚,且粒径分布均匀,掺杂和未掺杂的氧化镍空心球都是纯立方相。电化学性能测试结果表明,当扫速为5 mV/s时,2%Zn-NiOHS的比电容量达到最大,为357.08 F/g。根据计算可知,Zn掺杂氧化镍空心球的比电容量始终要高于未掺杂氧化镍空心球。当Zn的掺杂量达到2%时,在1A/g的电流密度下进行1 000次重复充放电性能测试,容量保持率可以维持约80%。
