BiOCl负载纳米Bi2MoO6的制备及光催化性能研究
2021-01-06胡豪单明清黄李璐邹晨涛杨水金
胡豪,单明清,黄李璐,邹晨涛,杨水金
(湖北师范大学化学化工学院, 污染物分析与资源化技术湖北省重点实验室, 湖北 黄石 435002)
0 引言
由于有机染料被大量的应用于各行业,废水中的污染物目前已是水质污染源之一.迄今为止,化学研究者们提出许多解决染料废水排放问题的办法[1-3],其中半导体光催化剂作为一种新型的绿色能源技术,能够将有机污染物分子完全分解为无机小分子,从而降解各种有机污染物,深受化学研究者们的青睐[4-7].光催化剂的活性和稳定性都是其能否真正应用于实际生产的关键[8-9].然而,紫外光仅占太阳能的4%,可见光占43%[10],因为这个限制,大多科研工作者无法充分利用丰富的太阳能这一宝贵资源.所以研究出在可见光下对有机染料具有高降解率的催化剂已是当前光催化研究领域中的热点方向之一.
近些年来,铋基材料因其高的可见光-光响应性而被大量研究,层状Bi2MoO6是一种利用可见光辐照的n型窄禁带半导体,是一种很好的光催化剂[11-12].Bi2MoO6特点是能够促进光诱导电子空穴对的分离,导致较高的光催化活性,Bi2MoO6的特性优良,可作为光催化剂,有关Bi2MoO6催化剂的研究方向也受到化学研究者们的青睐.有研究表明,Bi2MoO6对于降解和分解有机污染物,具有良好的活性[13].然而,由于光生电子与空穴的快速复合,单一Bi2MoO6的光催化效率仍然较低,基于Bi2MoO6的光催化剂在可见光区域以及电子和空穴的快速复合等方面仍面临着诸多挑战.因此,需要开发一种能够进一步提高Bi2MoO6光催化性能的方法,为提高催化剂的光催化活性,采用如下方法如形貌控制、稀土元素掺杂、Bi2MoO6与其他半导体耦合、与贵金属连接制备异质结构[14-18]等.
铋系氧卤化物BiOX (X=Cl, Br或I)因其在光催化剂、离子导电、铁电材料等方面的潜在应用,近年来受到了科学界的广泛关注[19].在这些铋系氧卤化物BiOX催化剂中,BiOCl是一种重要的铋系氧卤化物,具有良好的催化活性,性价比高、无毒,有优异独特的电学和光学性能,引起了人们对光催化降解有机物越来越多的兴趣.BiOCl是一种四边形的层状结构,由沿c-xis方向的Cl原子之间的非键相互作用堆积在一起的[Cl-Bi-O-Bi-Cl]片层组成[20-22].到目前为止,已经报道了几种制备不同形貌BiOCl的方法,如纳米板、纳米片、微球、花状层次结构等.据报道,光催化剂不仅能够提高吸收性,增加光吸收效率,还可以降低电子空穴对的重组机会,因此,它们可以转移到表面迅速降解有机分子.近年来,利用溶剂热法成功地合成了3D BiOCl分层结构,在这些研究中,乙二醇或甘油被用作溶剂和结构导向剂,合成的BiOCl颗粒的光催化性能比工业二氧化钛的更高.虽然不同形貌BiOCl已经被制备出来,但由于BiOCl物的带隙较大(3.19~3.60 eV),只能吸收紫外光,且纯BiOCl具有量子效率低、能量低的缺点[23-24].到目前为止,人们已经做了很多努力来克服上述缺点,其中选择合适的半导体来建立复合异质结被认为可以提高光催化活性的一种有前景的方法.
在本探究实验中,以Bi(NO3)3·5H2O、Na2MoO4·2H2O、SnCl2为原料,制备BiOCl负载Bi2MoO6复合物,通过XRD、SEM、BET及循环实验,对复合物的形貌、晶体尺寸、比表面积等进行研究,在可见光下照射污染物RhB,研究光催化降解的反应机理,并探究了不同BiOCl负载量的催化剂对光催化降解的影响.结果证明,BiOCl负载Bi2MoO6复合物的光催化降解活性相比于纯的Bi2MoO6有了很大的提高.由捕获实验的结果,提出BiOCl负载Bi2MoO6二元复合物可能存在的降解机理.经过多次循环实验后,证明BiOCl/Bi2MoO6复合物的稳定性好.
1 实验部分
1.1 实验试剂五水硝酸铋(Bi(NO3)3·5H2O),二水钼酸钠(Na2MoO4·2H2O),氯化亚锡(SnCl2·2H2O),无水乙醇(C2H5OH),乙二醇(C2H6O2),罗丹明B(C28H37ClN2O3),去离子水,所以试剂均为分析纯.
1.2 Bi2MoO6的制备A液:称Bi(NO3)3·5H2O 固体0.843 3 g加入到3 mL的C2H6O2中,搅拌10 min;B液:称Na2MoO4·2H2O固体0.210 5 g于5 mL C2H6O2中搅拌溶解.将A滴加到B液,继续搅20 min.把10 mL的C2H5OH滴加到A、B混合液中,搅拌30 min,移入25 mL反应釜,180 ℃反应12 h.洗涤后,在温度为80 ℃条件下烘干,制得催化剂Bi2MoO6[25-26].
1.3 复合物BiOCl/Bi2MoO6的制备称0.016 0 g SnCl2加入到18 mL C2H5OH和18 mL H2O的混合液中,搅拌10 min使SnCl2溶解,接着加入0.2 g 制备好的Bi2MoO6,继续搅拌1 h,溶液混合完全后100 ℃温度下反应12 h.缓慢冷却后,洗涤3次,在烘箱(条件设为80 ℃)下烘干,得到BiOCl/Bi2MoO6的复合物(命名为S1).改变加入的SnCl2量为0.032 0 g、0.0 480 g,其他步骤相同,得到的BiOCl负载Bi2MoO6的复合物命名为S2、S3.
1.4 光催化性能测试使用300 W氙灯 (CEL-HXF300) 并用滤光片过滤紫外光 (λ< 420 nm) 来模拟可见光光源.在同一条件下,将20 mg催化剂以及RhB溶液 (50 mL 10 mg/L) 同时加入至光反应器,暗光处理30 min,以建立RhB吸附-脱附平衡.取样后开灯,隔一定的光照时间 (10 min),取出约3 mL的上清液.在高速离心 (10 000 r/min,2 min) 后,使用722 s分光光度计在波长为554 nm下测试RhB的吸光度.
1.5 自由基捕获实验为了检测光催化反应中的活性物质,采用牺牲剂捕获不同的活性物质.其中,利用叔丁醇(TBA)来捕获羟基自由基(·OH),采用对苯醌(BQ)捕获超氧自由基(·O2-),通过EDTA-2Na可以用来捕获空穴(h+),并以不加任何捕获剂作为对比试验.
2 结果与讨论
2.1 SEM分析图1为纯Bi2MoO6和BiOCl/Bi2MoO6复合材料的SEM图.如图1a所示,纯Bi2MoO6的形貌是球状物,形貌较为均一、规则且分布均匀.从图1b可以观察到,BiOCl/Bi2MoO6复合物的形貌是球状物与棒状物,微球是Bi2MoO6的形貌,棒是BiOCl的形貌.从图1b中可以看出,微球与棒在界面处紧贴,形成具有界面相接的复合物.产生该形貌的原因是,SnCl2刻蚀Bi2MoO6的表面,从而使BiOCl在Bi2MoO6的表面开始生长,最后形成棒与球相接触的复合结构.

图1 样品Bi2MoO6 (a)和BiOCl/Bi2MoO6 (b)的SEM图
2.2 XRD分析图2为Bi2MoO6和S2的BiOCl负载Bi2MoO6复合物的X线粉末衍射图谱.从图2中可以看出,Bi2MoO6(JCPDS:21-0102)晶体平面的(111)、(131)、(200)、(151)、(062)、(133)和(262)的6个峰分别位于23.5°、28.3°、32.7°、36.1°、47.2°、55.5°、58.5°,没有发现任何杂质相存在的痕迹,表明所制备的样品纯度很高.从样品的图谱看出,BiOCl/Bi2MoO6催化剂的特征衍射峰无明显偏移,说明BiOCl的复合不会影响Bi2MoO6的晶型,并且在12.0°和25.8°处可以观测到BiOCl产生的两个特征峰,产生这种现象的原因是,SnCl2刻蚀了Bi2MoO6,一部分的Bi2MoO6被阴离子交换形成BiOCl,从而构建出BiOCl/Bi2MoO6复合物.
2.3 N2吸附-脱附等温曲线通过N2吸附-脱附等温曲线研究Bi2MoO6和BiOCl/Bi2MoO6复合物的比表面积.从表1中可以看出,Bi2MoO6比表面积为12.862 m2·g-1,BiOCl/Bi2MoO6复合物的比表面积为56.045 m2·g-1,BiOCl复合后的Bi2MoO6的比表面积明显要大于纯的Bi2MoO6,说明复合物一方面可以为反应提供更多的活性位点,另一方面由于复合物具有更大的比表面积,更小的孔径,在光照下,可以在复合物内部多次折射,增加光的利用率,提高光催化效率.

图2 样品的XRD图谱

图3 样品的N2吸附-脱附等温曲线

表1 Bi2MoO6和 BiOCl负载Bi2MoO6复合物的孔容和比表面积
2.4 光学性质分析通过紫外-可见漫反射光谱法研究催化剂的光学响应性质,可以对比Bi2MoO6与BiOCl/Bi2MoO6复合物的降解活性,从4(a)可看出,Bi2MoO6的吸收边缘在470 nm左右,不同BiOCl/Bi2MoO6的S1,S2和S3的吸光范围增大.从图4(b)中可以看出,BiOCl/Bi2MoO6复合物的带隙远小于纯的Bi2MoO6.
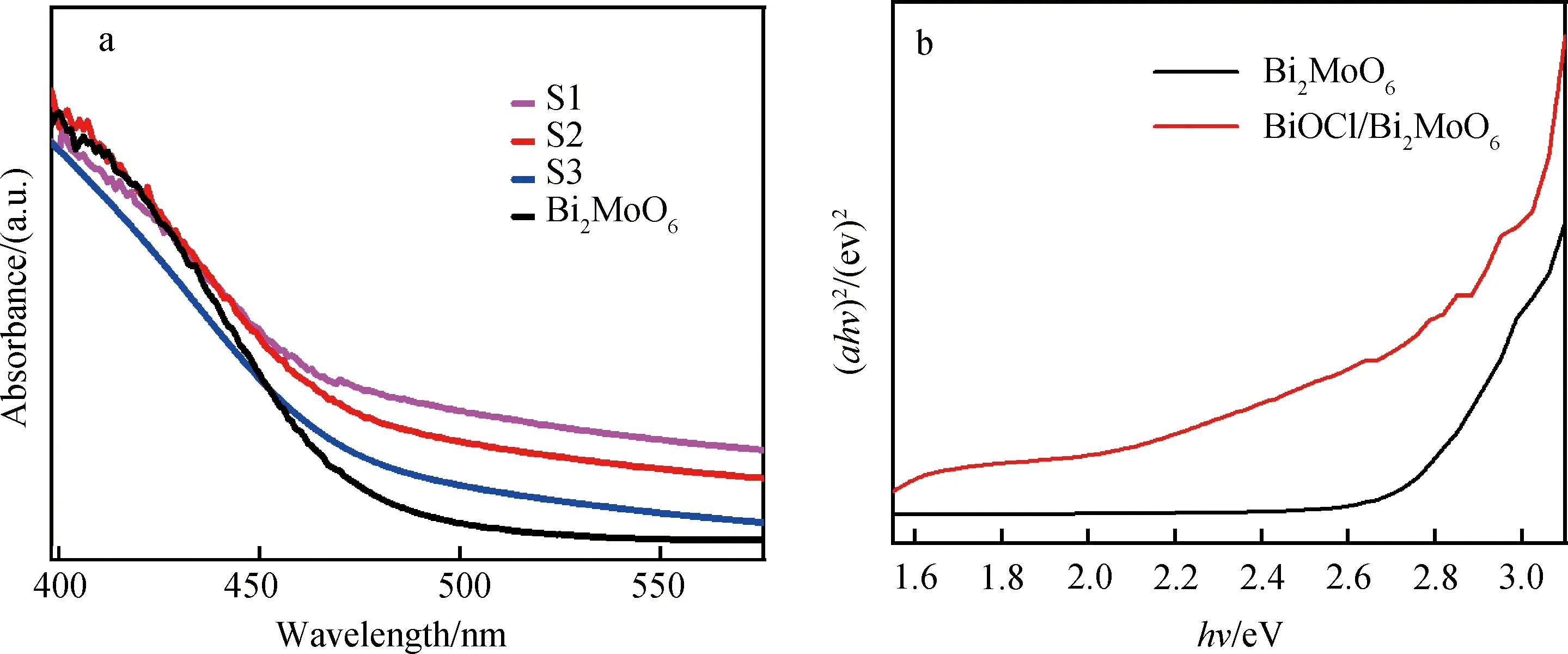
图4 样品的(a)紫外-可见漫反射谱图和(b)hν对应的(αhν)2曲线图
2.5 光催化性能
2.5.1 光催化降解RhB 通过可见光对污染物的降解来评估BiOCl/Bi2MoO6复合材料的光催化性能,首先选择化学稳定分子RhB作为代表性模型污染物.为了比较,在其他相同条件下,BiOCl、Bi2MoO6和S1、S2、S3的BiOCl负载Bi2MoO6复合物在可见光照射下降解RhB溶液.如图5所示,暗光处理30 min达到吸脱附平衡,当光照80 min后,纯物质BiOCl和Bi2MoO6的降解效率远远低于复合物S1,S2和S3的降解效率,其中复合物S2的降解效率最优,为88.1%,说明加入适量的BiOCl后催化剂的活性明显得到提高.
2.5.2 光催化剂的稳定性 光催化剂的稳定性也是衡量材料光催化性能的重要因素之一.在可见光的条件下,对BiOCl/Bi2MoO6催化剂进行降解RhB的循环实验,如图6所示.经过4次循环后,光催化活性损失较少,这表明BiOCl/Bi2MoO6复合材料在反应条件不变时,其活性不会因为重复使用而降低,具有良好的稳定性.

图5 样品的光催化降解RhB曲线

图6 样品BiOCl/Bi2MoO6的循环实验图
2.6 光催化机理的探究
2.6.1 自由基捕获实验 为了检测光催化反应中的活性物质,采用牺牲剂捕获不同的活性物质.利用TBA来捕获·OH,BQ可以捕获·O2-,而 EDTA-2Na 则可以用来捕获h+.如图7所示,在可见光下BiOCl /Bi2MoO6光催化降解RhB,同时加入了EDTA-2Na之后,光催化降解速率明显降低;加入BQ后,只对光催化降解速率产生微小的变化;而TBA的加入几乎不影响光催化的降解速率.通过以上实验可以看出,在BiOCl/Bi2MoO6复合物光催化降解中,h+是主要活性物种,它可以使表面吸附的有机污染物发生反应使其降解.
2.6.2 样品的荧光光谱 荧光光谱是研究半导体中光生电子空穴对分离效率的一项重要技术,发光强度越低,光生电子空穴对复合概率越小.图8为所制备样品的荧光光谱图,可以看出,Bi2MoO6的特征峰出现在542 nm左右,这可能是由能带跃迁的电子—空穴直接复合引起的.而BiOCl/Bi2MoO6复合物特征峰几乎消失,表明光生成的重组电荷载体受到很大抑制,有效的电荷分离可以提高载流子的寿命,提高界面电荷转移到吸附底物的效率,进而提高光催化活性.

图7 样品BiOCl/Bi2MoO6的自由基捕获实验图
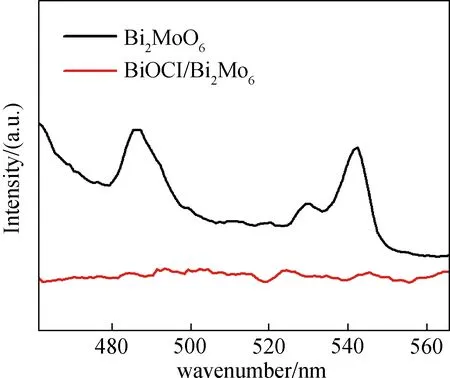
图8 Bi2MoO6和BiOCl/Bi2MoO6的荧光光谱
2.6.3 光催化降解机理图 在上述实验的基础上,提出一种BiOCl/Bi2MoO6复合物可能的光催化机理.根据文献报道BiOCl的VB和CB电势值分别为3.56和0.26 eV[27],而Bi2MoO6的VB和CB的电势分别为2.36和-0.35 eV[12].根据获得的带隙能量,仅Bi2MoO6在可见光能够被激发,电子从Bi2MoO6的VB跃迁到其CB上,h+留在VB上面,e-和h+容易快速重组,而负载了BiOCl之后,由于BiOCl的CB比Bi2MoO6的CB更正,所以e-会由Bi2MoO6的CB迁移到BiOCl的CB上面,有利于抑制e-和h+的复合. BiOCl的CB上面e-与溶液中的O2作用,生成·O2-,同时,Bi2MoO6的VB中残留的h+可以直接氧化有机化合物或与H2O作用生成·OH,从而整体达到降解污染物的作用.

图9 BiOCl/Bi2MoO6催化剂的光催化机理示意图
3 结论
在本研究中,采用溶剂热法按照不同的BiOCl负载量制备BiOCl/Bi2MoO6复合物.与纯的Bi2MoO6相比,BiOCl/Bi2MoO6复合物在光照条件下对罗丹明B(RhB)的降解中表现出更优异的光催化性能.其中,S2的BiOCl/Bi2MoO6复合物的催化效果是最好的.BiOCl/Bi2MoO6复合物增强的光催化活性一方面可能归因于BiOCl和Bi2MoO6在光生电子-空穴对的有效分离中的积极协同效应,另一方面由于复合材料具有更大的比表面积,从而产生更多活性位点.而且,超氧自由基(·O2-)和空穴(h+)导致有机污染物的有效和稳定的降解.在4次循环实验后,BiOCl/Bi2MoO6复合物的活性损失较小,具有较高活性,说明其稳定性好.因此,BiOCl/Bi2MoO6作为环境修复的高性能光催化剂具有巨大的潜力.
