钙蛋白酶抑制剂对雌激素诱导人乳腺癌细胞上皮-间质转化的影响*
2021-01-05金爱王宏键董宇华王旭东
金爱,王宏键,董宇华,王旭东
(贵州医科大学 基础医学院 生理学教研室,贵州 贵阳 550025)
乳腺癌(breast cancer)是发生在乳腺腺上皮组织的恶性肿瘤,也是女性最常见的激素依赖性恶性肿瘤,严重威胁着患者的身心健康[1-2]。上皮-间质转化(epithelial-mesenchymal transition,EMT)是一种生物学过程,可通过相应信号机制使上皮细胞转化为间质表型的细胞[3],EMT过程中的恶性肿瘤细胞往往可以获得迁移和侵袭能力[3],迁移和侵袭能力增强是乳腺癌转移的必要条件[4],亦提示有效抑制EMT可能是遏制乳腺癌转移的关键。17β-雌二醇(17β-estradiol,E2)是女性体内重要的性激素之一,正常生理状态下,E2能调节乳腺的生长发育;而在恶性肿瘤中,E2可参与诱导多种肿瘤细胞的增殖、黏附、迁移及侵袭等生物学行为[5-6];此外,E2还可诱导乳腺癌细胞发生EMT[7-8]。钙蛋白酶(calpain)是一类依赖于Ca2+激活的中性蛋白酶超家族,其成员通过对底物进行“有限”切割,从而调整底物活性、并调节细胞生物学行为,如增殖、侵袭、迁移、骨架重构等[9]。本课题组前期研究结果显示,E2可通过钙蛋白酶诱导乳腺癌MDA-MB-468细胞迁移[10]。然而,关于钙蛋白酶是否介导E2诱导的MCF-7和MDA-MB-231乳腺癌细胞EMT和迁移目前尚不明了。因此,本研究通过分子生物学实验深入探究钙蛋白酶在E2诱导乳腺癌细胞迁移过程中的作用以及对EMT标志物纤连蛋白(fibronectin,FN)和E-钙黏素(E-cadherin)蛋白表达的影响,为临床治疗乳腺癌提供实验依据。
1 材料与方法
1.1 材料
1.1.1实验细胞与主要试剂 人雌激素受体(estrogen receptor,ER)阴性的乳腺癌细胞系MDA-MB-231和ER阳性的乳腺癌细胞系MCF-7(中国科学院上海细胞库),改良Eagle培养基(dulbecco’s modification of Eagle's medium,DMEM)、RPMI-1640培养基、抗生素(penicillin and streptomycin,美国Hyclone 公司),胎牛血清(fetal calf serum,FBS;杭州四季青公司),E2和钙蛋白酶抑制剂(calpeptin,美国Sigma公司),蛋白酶抑制剂苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF;武汉博士德生物),抗FN多克隆抗体(美国Abcam公司),羊抗小鼠IgG-HRP和羊抗小兔IgG-HRP(美国Santa Cruz公司),抗E-cadherin多克隆抗体、抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体(南京Bioworld公司)及蛋白浓度测试试剂盒(上海碧云天公司)。
1.1.2主要仪器 恒温CO2培养箱(美国Thermo公司),SW-CJ-2FD超净工作台(中国苏州净化),台式超低温高速离心机(美国Beckman Couler公司),CKX41倒置显微镜(日本Olympus公司)及恒温培养震荡器(中国智城分析公司)。
1.2 方法
1.2.1细胞培养 MCF-7乳腺癌细胞培养于10%FBS、1%抗生素及89%RPMI-1640培养基中,MDA-MB-231乳腺癌细胞培养于10%FBS、1%抗生素及89%DMEM培养基中,所有细胞均培养于37 ℃、5%CO2及饱和湿度(95%)培养箱。细胞培养24 h至对数生长期,用于后续实验。
1.2.2划痕实验检测细胞迁移能力 取对数期生长的MCF-7和MDA-MB-231模型细胞分别铺于12孔板,全培养基培养细胞至90%~100%,换无血清培养基同步化24 h,20 μL的无菌枪头在12孔板皿底作十字划痕,PBS清洗;分别加DMSO(对照组)、50 nmol/L E2(E2组)及50 nmol/L E2联合10 μmol/L Calpeptin(E2+Calpeptin组)处理模型细胞,0、12、24 和48 h时标记区域进行拍照,记录细胞划痕区域宽度,计算细胞迁移率[细胞迁移率=(0 h划痕宽度-12 h或24 h或48 h划痕宽度)/ 0 h划痕宽度×100%][11]。
1.2.3蛋白印记实验检测模型细胞FN和E-cadherin表达变化 将对数期生长的MCF-7和MDA-MB-231乳腺癌模型细胞分别铺于6孔板中,次日更换无血清培养基同步化24 h,待细胞汇合度达70%,分别加DMSO(对照组)、50 nmol/L E2(E2组)及50 nmol/L E2联合10 μmol/L Calpeptin(E2+Calpeptin组)处理模型细胞,提取蛋白,配制含1 mmol/L蛋白酶抑制剂PMSF的RIPA细胞裂解液于冰盒中裂解20 min,4 ℃离心机12 000 r/min离心15 min,吸取上清液至标记好的EP管进行蛋白定量;10% SDS-PAGE凝胶电泳分离蛋白(30 μg/泳道),湿转法将分离的蛋白转印至硝酸纤维膜;5%牛血清白蛋白室温封闭1~2 h,TBST洗膜3次/10 min,然后加入抗FN多克隆抗体(1 ∶1 000)、抗E-cadherin多克隆抗体 (1 ∶1 000)室温孵育2 h;TBST洗膜3次/10 min,加入相应二抗(1 ∶4 000)室温孵育1 h,用凝胶成像仪进行成像拍照。
1.3 统计学分析

2 结果
2.1 细胞迁移
与对照组相比,E2组MCF-7乳腺癌细胞24 h和48 h迁移率均有明显增加,差异均有高度统计学意义(P<0.01);与对照组相比,E2组MDA-MB-231乳腺癌细胞24 h和48 h迁移均有明显增加,差异有统计学意义(P<0.01)。见图1。
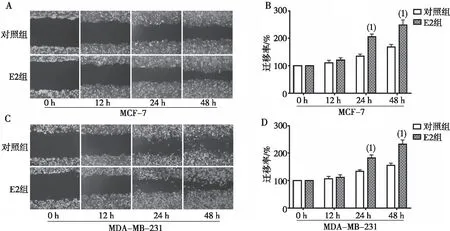
注:A、C为划痕实验结果(40×),B、D为细胞迁移率的条图;(1)与同时点对照组比较,P<0.01。图1 E2诱导MCF-7和MDA-MB-231人乳腺癌细胞的迁移能力Fig.1 Migration of MCF-7 and MDA-MB-231 breast cancer cells induced by E2
2.2 E2诱导的乳腺癌细胞E-cadherin和FN的表达
在MCF-7细胞中,与0 h相比,E2组细胞FN的表达在24 、48 和72 h均明显上调,E-cadherin的表达明显减少,差异有统计学意义(P<0.01),其中48 h效果最佳;在MDA-MB-231细胞中,与0 h相比,E2组细胞FN的表达在24、48和72 h均明显上调,E-cadherin的表达明显减少,差异有统计学意义(P<0.01),其中48 h效果最佳。见图2。

注:A、C为Western blot实验结果,B、D为相关蛋白定量表达的条图;(1)与0 h比较,P<0.01。图2 E2诱导MCF-7和MDA-MB-231人乳腺癌细胞的FN及E-cadherin蛋白表达Fig.2 Expression of FN and E-cadherin proteins in MCF7 and MDA-MB-231 human breast cancer cells induced by E2
2.3 Calpeptin抑制E2诱导的乳腺癌细胞迁移
与E2组相比,E2+Calpeptin组MCF-7细胞的24 h和48 h迁移率均降低,差异有统计学意义(P<0.05);与E2组相比,E2+Calpeptin组MDA-MB-231细胞的24 h迁移率降低,48 h迁移率降低,差异均有统计学意义(P<0.05或P<0.01)。见图3。

注:A、C为划痕实验染色结果(40×),B、D为细胞迁移率的条图;与同时点E2组比较,(1)P<0.05,(2)P<0.01。图3 Calpeptin抑制E2诱导MCF-7和MDA-MB-231人乳腺癌细胞的迁移能力Fig.3 Migration of MCF-7 and MDA-MB-231 breast cancer cells induced by calpeptin-inhibited E2
2.4 Calpeptin抑制E2诱导的模型细胞E-cad和FN的表达
在MCF-7细胞,与E2组相比,E2+Calpeptin组FN表达显著下调, E-cad表达显著上调,差异均有统计学意义(P<0.01);在MDA-MB-231细胞,与E2组相比,E2+Calpeptin组FN明显表达下调,E-cadherin表达明显上调,差异有统计学意义(P<0.01)。见图4。
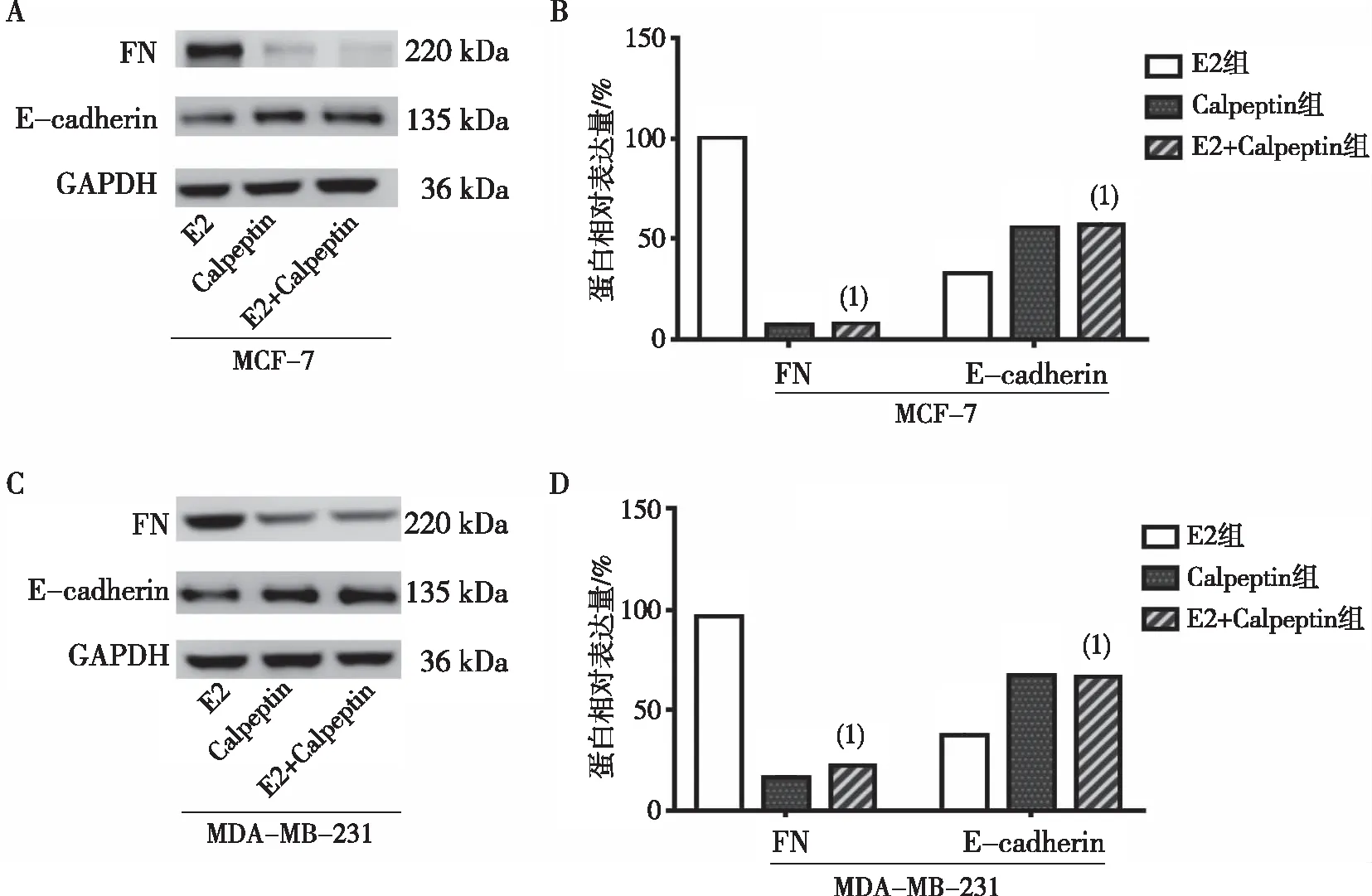
注:A、C为Western blot实验结果,B、D为相关蛋白定量表达的条图;(1)与E2组比较,P<0.01。图4 Calpeptin抑制E2诱导MCF-7和MDA-MB-231人乳腺癌细胞的FN和E-cadherin蛋白表达Fig.4 Expression of FN and E-cadherin in MCF-7 and MDA-MB-231 breast cancer cells induced by calpeptin-inhibited E2
3 讨论
本实验结果发现,与对照组相比,E2处理组MCF-7和MDA-MB-231乳腺癌细胞在24和48 h的迁移率均明显增加,细胞中FN蛋白在24、48和72 h表达均明显上调,而E-cadherin蛋白表达则明显下调;与E2组相比,E2+Calpeptin组MCF-7和MDA-MB-231乳腺癌细胞的迁移率明显下降,FN表达明显减少,E-cadherin表达明显增加。因此提示Calpain在E2介导的乳腺癌细胞迁移和EMT过程中发挥着重要的作用。
乳腺癌是常见的恶性肿瘤,是女性肿瘤相关性死亡的最常见原因,全球每年大约有138万的新发病例,每年约45.8万死于乳腺癌疾病[12]。尽管随着治疗水平的提高,乳腺癌的致死率每年逐渐下降,但致死率仍在15%以上[13]。乳腺癌严重危害女性的健康,因此乳腺癌的防治是当今研究者最迫切关注的问题。
乳腺癌是经典的激素依赖性的恶性肿瘤,许多研究已经证实E2调控乳腺癌的多种恶性行为如迁移、转移等[6]。E2可以通过上调多个原癌基因如多配寡糖1(syndecan 1)[14]、丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)[15]促进乳腺癌的进展。与之前研究一致,本研究以ER阳性的MCF-7乳腺癌和ER阴性的MDA-MB-231乳腺癌细胞为研究对象,发现E2能够显著促进MCF-7和MDA-MB-231细胞的迁移。乳腺癌患者死亡的主要原因可能与乳腺癌细胞的转移有关[16],转移是几乎所有乳腺癌死亡的主要原因,乳腺癌的继发性生长主要发生在淋巴结,骨骼,肝脏,肺和大脑中,而肿瘤细胞转移涉及细胞脱落、迁移、侵袭、黏附及血管生成等多个生物学过程[17];已有研究表明乳腺癌细胞EMT伴随迁移和侵袭活动增强[18];FN表达上调和E-cadherin的减少或丢失被认为是EMT的重要标志, 临床研究也显示,EMT标志物E-cadherin和波形蛋白与乳腺癌淋巴转移存在明显相关性[19-20]。这些研究均提示,EMT是引起乳腺癌迁移、侵袭及转移的重要因素。进一步通过Western blot实验发现,E2可以显著诱导MCF-7和MDA-MB-231乳腺癌细胞FN蛋白表达上调和E-cadherin蛋白的表达下调。
大量研究已经证实,钙中性蛋白酶calpain在乳腺癌的增殖、迁移和侵袭过程中扮演着重要的角色。本课题组前期工作表明,雌二醇E2激活 MCF-7乳腺癌细胞中钙蛋白酶calpain,持续地诱导细胞周期蛋白E(cyclin E)的表达增加,进而调控乳腺癌细胞的恶性增殖[21]。钙蛋白酶包括多种亚型分子,广泛表达的钙蛋白酶分为μ-钙蛋白酶(Calpain1)和m-钙蛋白酶(Calpain2),Calpeptin可抑制Calpain1和Calpain2[22]。同样,本课题组前期实验也发现,Calpeptin预处理可抑制E2诱导的MDA-MB-468乳腺癌细胞迁移[10]。为进一步探讨,钙蛋白酶Calpain是否调控E2介导的MCF-7和MDA-MB-231乳腺癌细胞的EMT和迁移过程,我们应用钙蛋白酶抑制剂Calpeptin预处理细胞。与前期实验结果一致,本研究发现Calpeptin预处理可抑制E2介导的MCF-7和MDA-MB-231乳腺癌细胞的迁移以及EMT过程。提示,E2可通过调控钙蛋白酶Calpain促进多种类型的乳腺细胞EMT和迁移。
综上所述,E2可能诱导ER阳性乳腺癌细胞MCF-7和ER阴性乳腺癌细胞MDA-MB-231 EMT和迁移,上述效应可能与Calpain的介导作用相关,提示钙蛋白酶Calpain是一个潜在的治疗靶点。
