磁性氧化石墨烯/聚丙烯胺盐酸盐微胶囊在染料吸附中的应用
2021-01-05赵芷芪李秋瑾孙月静巩继贤张健飞
赵芷芪,李秋瑾,孙月静,巩继贤,李 政,张健飞,3
(1. 天津工业大学 纺织科学与工程学院,天津 300387; 2. 天津工业大学 先进纺织复合材料教育部 重点实验室,天津 300387; 3. 山东省生态纺织协同创新中心,山东 青岛 266071)
纺织品的印染加工会产生大量的废水,随着人们环保意识的增强,如何高效地处理印染废水成为纺织行业亟待解决的问题[1]。氧化石墨烯(GO)具有良好的亲水性、分散性以及聚合物兼容性等特性,且其比表面积大,吸附能力强,已被广泛应用于各种复合材料的研究[2-3],逐渐成为纺织工程与材料领域中的研究热点[4]。氧化石墨烯表面含有大量的羧基、羟基等官能团,可对某些有机分子进行吸附,成为废水处理的一种理想材料。利用GO制成的复合材料可以作为有机污染物如亚甲基蓝(MB)、罗丹明B(RhB)等染料的光催化剂[5-7],同时还可以达到比较高的去除率。但传统的GO膜在水性介质中稳定性较低[8],当GO膜浸入水性介质中时,GO片层之间由于带有相同的负电而互相排斥会导致氧化石墨烯本身的结构发生损坏。虽然掺杂多价金属阳离子可提高GO膜在水中的稳定性,但在酸性和碱性溶液中依然不稳定[9]。通过界面聚合[10]、层层自组装(LBL)[11]等方法可制备结构可控的复合材料。其中LBL技术是利用带有相反电荷分子之间的静电相互作用力,实现不同材料的交叠组合,得到半透膜类物质[12-13]。采用LBL技术可制备中空结构微胶囊,具有高比表面积与体积比、高负载能力以及优良的化学稳定性,成为去除污染物的理想选择,可有效去除废水中的三氯乙烯、砷、重金属以及有机废物和染料等[14]。进一步在吸附载体材料中添加磁性粒子,可利用磁场效应,实现物质的有效分离。
本文利用共沉淀的方法制备Fe3O4-GO微粒,通过LBL技术将Fe3O4-GO与聚丙烯胺盐酸盐(PAH)交叠组装得到杂化磁性微胶囊(PAH/Fe3O4-GO)n,用于亚甲基蓝染液中染料的吸附与分离,从而实现印染废水的清洁与再利用。通过LBL方法,Fe3O4-GO分子与聚电解质PAH逐层组装良好,所得(PAH/Fe3O4-GO)2微胶囊结构稳定;其中空结构为染料吸附提供了有利空间,可实现对MB的高吸附量;负载MB的(PAH/Fe3O4-GO)2微胶囊可在磁场作用下与水溶液实现良好的分离;一定条件下,磁场富集所得(PAH/Fe3O4-GO)2杂化微胶囊亦可将所吸附的MB脱除,从而实现磁性杂化微胶囊载体的循环使用,为印染废水的处理与再利用提供了一种可持续发展方案。
1 实验部分
1.1 试剂与仪器
聚苯乙烯磺酸钠盐(PSS)和聚丙烯胺盐酸盐(PAH),阿法埃莎(天津)有限公司;四水合硝酸钙(Ca(NO3)2·4H2O)和氯化钠(NaCl),均为分析纯,天津市科密欧化学试剂有限公司;氧化石墨烯(GO),南京先锋纳米材料有限公司;盐酸(HCl)、氢氧化钠(NaOH)、四水合二氯化铁(FeCl2·4H2O)和六水合三氯化铁(FeCl3·6H2O),均为分析纯,天津市风船化学试剂科技有限公司;乙二胺四乙酸(EDTA),分析纯,北京普博欣生物科技有限责任公司。
VHX-1000型超景深三维显微镜,日本KEYENCE有限公司;Hitachi H7650型透射电子显微镜,日本HITACHI公司;Nicolet iS50型傅里叶红外光谱仪,美国Thermo Fisher Scientific科技有限公司;UV-1200型紫外-可见分光光度计,上海美谱达有限公司。
1.2 磁性氧化石墨烯(Fe3O4-GO)的制备
配制质量浓度为1 mg/mL的GO分散液,超声粉碎10~15 min,加入500 mg的氢氧化钠,将混合溶液在45 ℃条件下处理4 h。之后将混合物超声处理2次,每次30 min。将得到的溶液透析48 h以获得均匀的GO分散液。
利用共沉淀的方法,将1 mL的FeCl3·6H2O溶液(55 g/L)在氮气保护下加入到稀释的GO分散液(0.5 mg/mL)中,5 min后加入1 mL的FeCl2·4H2O溶液(32 g/L),使用NaOH调节pH值为9,反应2 h后得到Fe3O4-GO分散液。
1.3 碳酸钙模板微粒的制备
向100 mL浓度为0.025 mol/L的四水合硝酸钙溶液中加入0.2 g的PSS(相对分子质量为7万)。将等体积的0.025 mol/L的Na2CO3溶液在磁力搅拌条件下加入到混合溶液中,静置20~30 min,即可得到掺杂PSS的模板微粒。
1.4 磁性微胶囊的制备
利用层层自组装的方法,将带有相反电荷的Fe3O4-GO和PAH逐层组装到碳酸钙模板微粒的表面以制备磁性微胶囊。向10 mL质量浓度为1 mg/mL的PAH(含0.5 mol/L NaCl)溶液中加入掺杂PSS的模板微粒,水浴振荡20 min;去除清液并用蒸馏水洗涤3次,再取50 μL的Fe3O4-GO溶液稀释至10 mL,在数控超声波清洗器中加入到掺杂PSS的模板微粒溶液中,水浴振荡15 min,离心去除上清液并用蒸馏水洗涤3次,重复上述步骤可得所需层数的磁性微胶囊与模板的混合物。利用EDTA(0.1 mol/L,pH值为7.0)溶液将微胶囊与模板混合物中的碳酸钙模板微粒去除,可以得到空心的(PAH/Fe3O4-GO)n微胶囊。n代表组装层数,n=2,3。制备过程如图1所示。
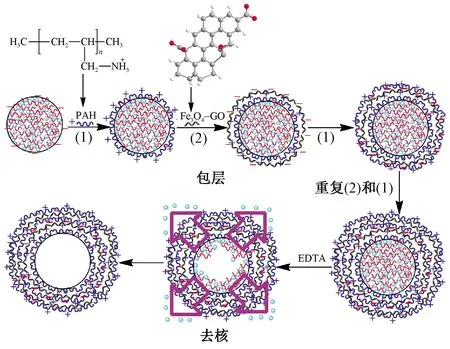
图1 采用LBL法制备杂化的磁性氧化石墨烯微胶囊Fig.1 Schematic illustration of LBL assembly of (PAH/Fe3O4-GO)n
1.5 磁性微胶囊的性能测试与表征
1.5.1 形貌观察与磁性分析
将制备好的Fe3O4-GO微粒混合溶液滴加到载玻片上,放入超景深三维显微镜下进行观察。将Fe3O4-GO微粒置于铜网上,烘干处理后采用透射电子显微镜观察形貌。
以水为介质,在中性溶液中将制备好的不同层数的磁性氧化石墨烯微胶囊放在超景深三维显微镜下进行观察,同时使用盐酸和氢氧化钠调节溶液的pH值为2~12。
为了研究微胶囊的磁性,将制备好的磁性微胶囊混合溶液放入离心管中,将磁铁放入一侧,观察磁性微胶囊在溶液中与水的分离情况。
1.5.2 化学结构表征
将干燥后的Fe3O4-GO微粒,(PAH/Fe3O4-GO)2和(PAH/Fe3O4-GO)3微胶囊分别和KBr混合均匀进行压片,在4 000~500 cm-1的扫描范围内,使用傅里叶红外光谱仪表征它们的化学结构。
1.6 磁性微胶囊对染料亚甲基蓝的吸附
将(PAH/Fe3O4-GO)2微胶囊在pH值为2~12的条件下放置于亚甲基蓝溶液(0.2,0.5,1.0,1.5,2.0,2.5,3.0 mg/mL)中,不同时间后在外磁场作用下对混合物进行磁性分离,探究不同条件下(PAH/Fe3O4-GO)2微胶囊对染料的吸附作用。利用式(1)和(2)可以得到(PAH/Fe3O4-GO)2微胶囊在不同条件下对于亚甲基蓝的吸附量以及对亚甲基蓝的去除率。
(1)
(2)
式中:Q为单位质量的吸附剂吸附亚甲基蓝染料的质量,mg/g;C0为加入与吸附剂混合溶液体积相同的水后染料溶液的初始质量浓度,mg/mL;V0为加入与吸附剂混合溶液体积相同的水后染料溶液的体积,mL;Ct为加入吸附剂后随着时间t的变化混合溶液的质量浓度,mg/mL;Vt为加入吸附剂后随着时间t的变化混合溶液的体积,mL;C为吸附剂的质量浓度,mg/mL;V为吸附剂的体积,mL;Re为吸附剂对亚甲基蓝染料的去除率,%。
采用醋酸和甲醇的混合溶液对吸附了亚甲基蓝的(PAH/Fe3O4-GO)2微胶囊的脱吸附作用进行探究。利用式(3)可以得到(PAH/Fe3O4-GO)2微胶囊对染料亚甲基蓝的脱附率。
(3)
式中:P为吸附剂对染料的脱附率,%;V2为混合溶液的体积,mL;C2为混合溶液中脱附染料的质量浓度,mg/mL。
2 结果与讨论
2.1 微粒和磁性微胶囊的形貌分析
图2示出Fe3O4-GO微粒的超景深三维显微镜和透射电子显微镜(TEM)照片。可以看出,在水溶液中Fe3O4-GO微粒分散比较均匀,基本无团聚。

图2 Fe3O4-GO的形貌照片Fig.2 Images of Fe3O4-GO.(a) Optical microscope image; (b) TEM image
以水为介质,在中性条件下,将制备好的不同层数的磁性氧化石墨烯微胶囊放在超景深三维显微镜下进行观察,如图3所示。虽然(PAH/Fe3O4-GO)n微胶囊的层数不同,但是其在水溶液中的存在状态相似,均呈现出良好的中空结构,尺寸均匀,粒径为5~10 μm,在pH=7、pH=2和12条件下均有良好的分散性。其独特的半透膜包裹的中空结构为染料分子负载提供了良好的空间。

图3 磁性氧化石墨烯微胶囊的超景深三维显微镜图像Fig.3 Optical microscope images of (PAH/Fe3O4-GO)n
图4示出磁性氧化石墨烯微胶囊在外磁场作用下与水的分离情况。由于微胶囊本身带有磁性而聚集到靠近外磁场的一侧,显示了磁性微胶囊良好的磁场聚集效应,为吸附染料后的分离提供了有利条件。

图4 磁性氧化石墨烯微胶囊在外磁场 作用下与水的分离Fig.4 Separation of (PAH/Fe3O4-GO)n microcapsules from solution by magnetic field
2.2 微粒和磁性微胶囊的化学结构分析

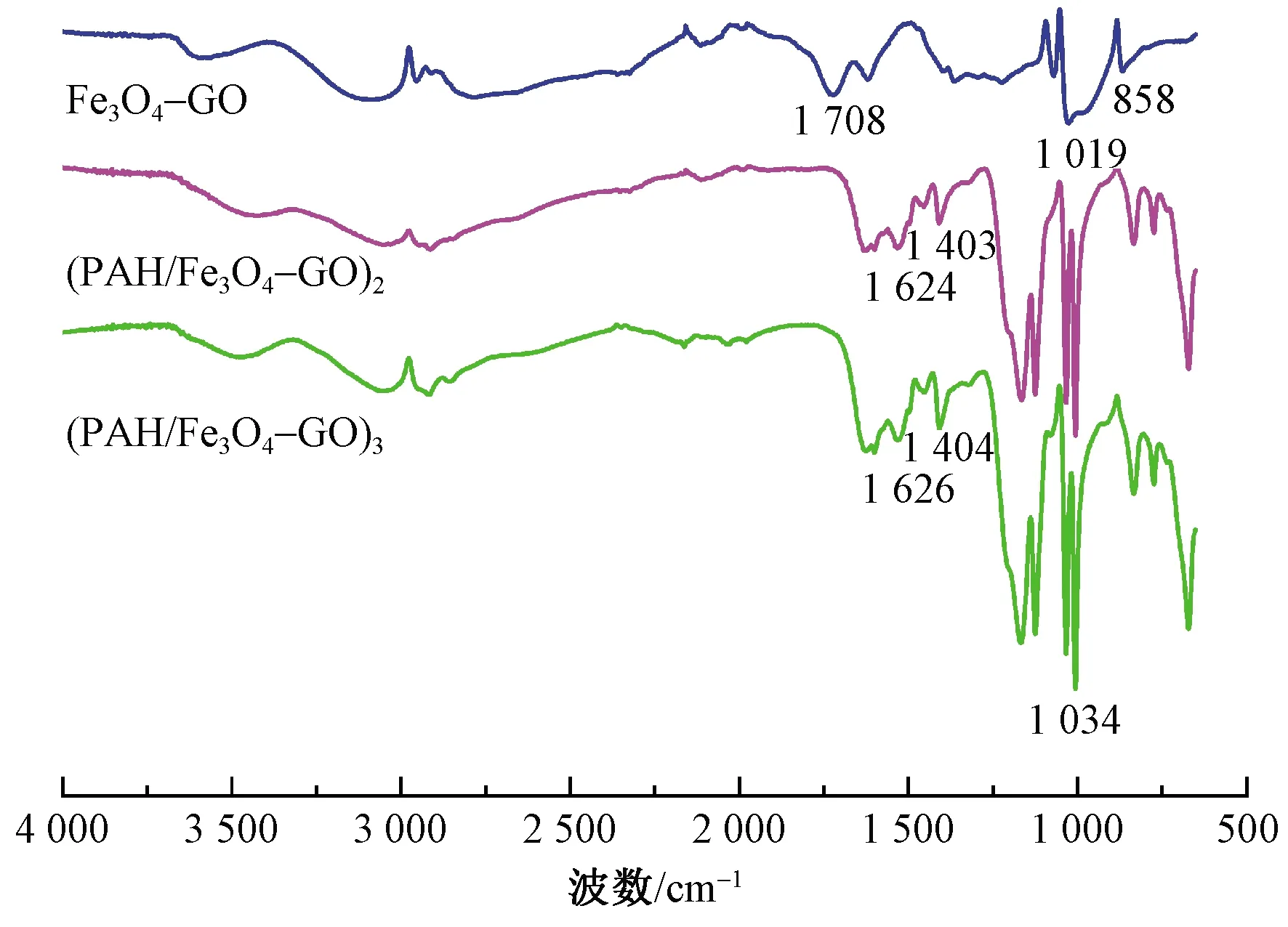
图5 Fe3O4-GO微粒和(PAH/Fe3O4-GO)n微胶囊的 红外光谱图Fig.5 Fourier transform infrared spectrum of Fe3O4-GO and (PAH/Fe3O4-GO)n
2.3 磁性微胶囊对亚甲基蓝的吸附行为
2.3.1 吸附剂用量对染料吸附的影响
将初始质量浓度为2.5 mg/mL的亚甲基蓝溶液在25 ℃条件下恒温振荡180 min,将不同质量的(PAH/Fe3O4-GO)2吸附剂与亚甲基蓝溶液混合,其吸附结果如图6所示。随着(PAH/Fe3O4-GO)2微胶囊质量的增加,(PAH/Fe3O4-GO)2微胶囊对亚甲基蓝染料的吸附位点会增加,对亚甲基蓝染料的吸附效果增强,去除率呈现上升趋势。如图6所示,随着吸附剂质量从3.2 mg增加到32 mg,亚甲基蓝的去除率呈上升趋势,这意味着,增加吸附剂的用量能有效增加亚甲基蓝染料分子的吸附量。
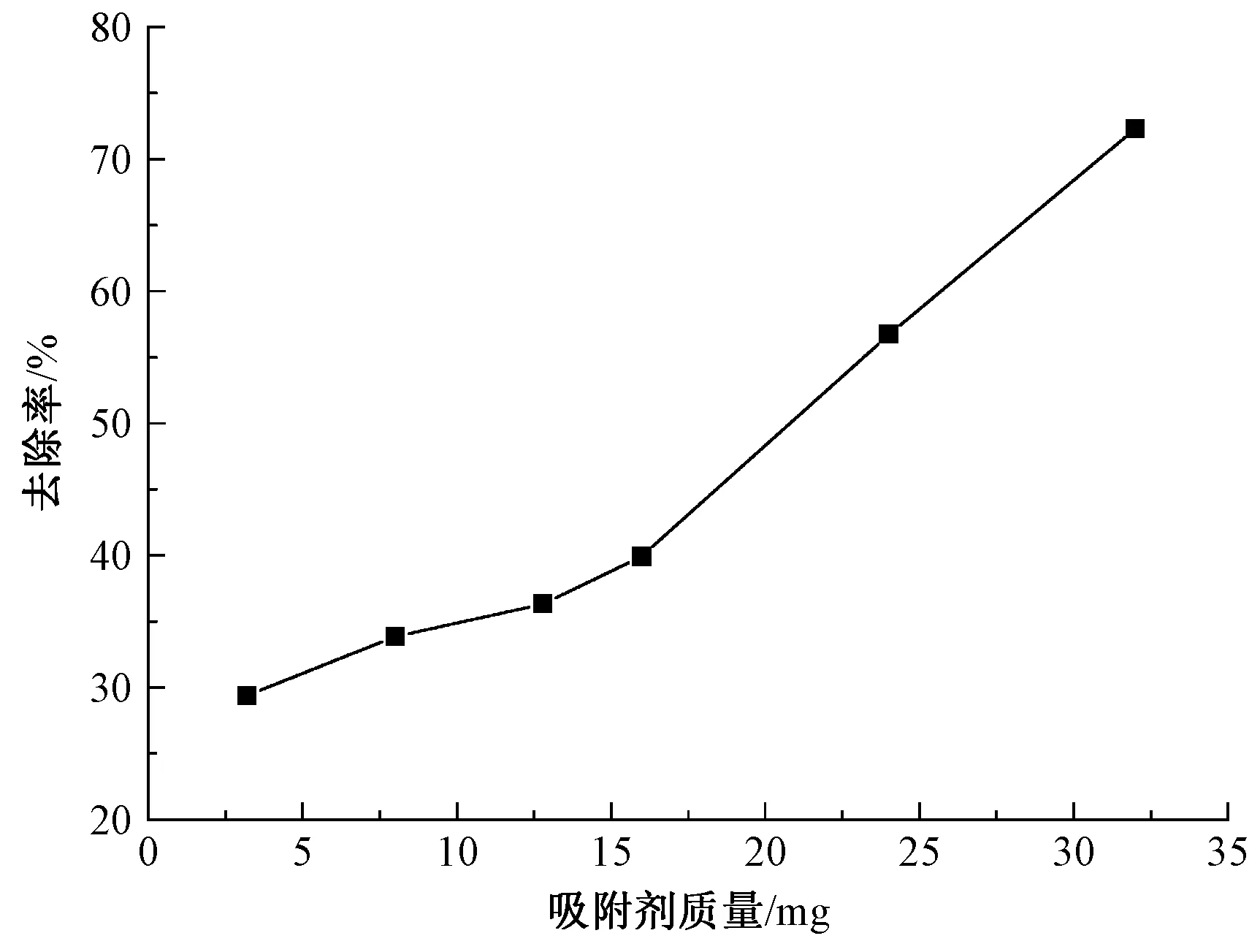
图6 吸附剂质量对吸附性能的影响Fig.6 Effect of adsorbent mass on adsorption capacity
2.3.2 染料质量浓度和吸附时间对吸附的影响
图7示出在不同初始质量浓度的亚甲基蓝染料溶液中(PAH/Fe3O4-GO)2微胶囊的吸附量随时间的变化。其中温度为25 ℃,pH值为7.0。实验结果表明:吸附量随着亚甲基蓝质量浓度的增加而增加,且从2 min到20 min迅速上升;当吸附时间大于20 min时,吸附量没有发生明显变化,可认为在20 min时(PAH/Fe3O4-GO)2微胶囊对亚甲基蓝染料的吸附达到平衡。GO的结构特性及微胶囊的中空结构为亚甲基蓝的吸附提供了足够的空间[17]。
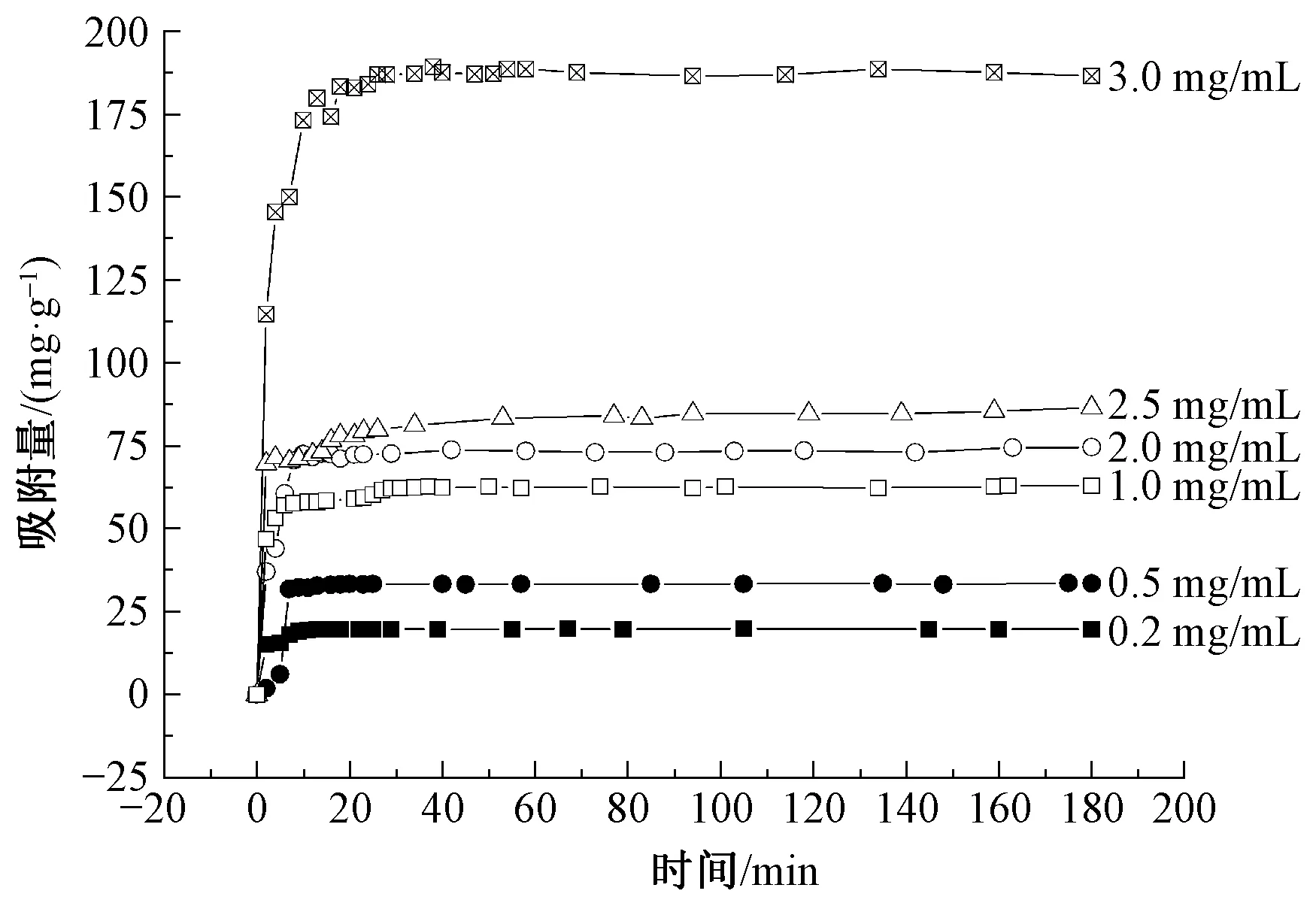
图7 不同初始染料质量浓度和时间条件下磁性微胶囊 对亚甲基蓝的吸附Fig.7 Adsorption of (PAH/Fe3O4-GO)2 to MB at different initial concentration and time
2.3.3 pH值对染料吸附的影响
采用HCI和NaOH调节染料溶液的pH值为2~12,染料质量浓度为2.5 mg/mL,吸附剂质量为16 mg,考察pH值对磁性微胶囊吸附亚甲基蓝染料的影响,结果如图8所示。(PAH/Fe3O4-GO)2微胶囊对亚甲基蓝的吸附量随着吸附溶液pH值的升高而呈现上升趋势,这是由于在偏碱性的混合溶液中,Fe3O4-GO表面的羧基和羟基等基团易被离子化,增加了(PAH/Fe3O4-GO)2对亚甲基蓝的吸附位点。在pH值为12时达到最大吸附量,吸附率可达到96.5%。
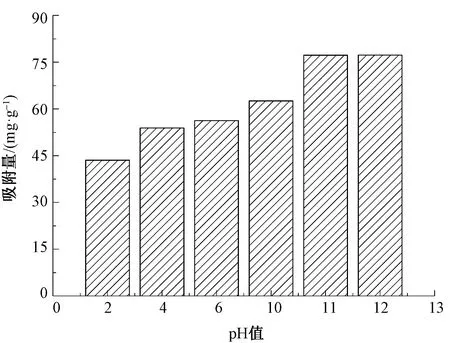
图8 pH值对(PAH/Fe3O4-GO)2微 胶囊吸附亚甲基蓝的影响Fig.8 Effect of pH value on (PAH/Fe3O4-GO)2 absorption to MB
2.4 吸附机制
2.4.1 吸附动力学
配制初始质量浓度为1.0、2.5 mg/mL的亚甲基蓝溶液,加入16 mg的(PAH/Fe3O4-GO)2微胶囊。一定时间后取10 μL的上清液测定吸光度,并利用不同时间测试出来的吸光度进行吸附量的计算,结果如图9所示。
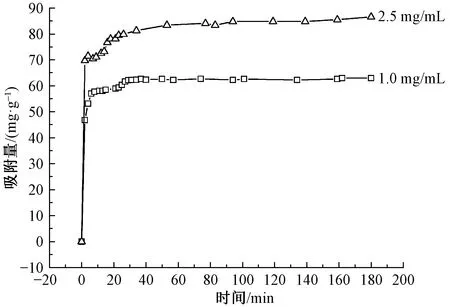
图9 (PAH/Fe3O4-GO)2微胶囊对不同质量 浓度亚甲基蓝溶液的吸附Fig.9 Adsorption of (PAH/Fe3O4-GO)2 microcapsules on different concentrations of MB
为了解(PAH/Fe3O4-GO)2微胶囊对亚甲基蓝染料分子的吸附机制,利用准一级动力学方程(见式(4))和准二级动力学方程(见式(5))分析(PAH/Fe3O4-GO)2微胶囊对亚甲基蓝的吸附动力学。这2种吸附动力学模型表示如下:
ln(Qe-Qt)=lnQe-k1t
(4)
(5)
式中:Qe为平衡时吸附剂(PAH/Fe3O4-GO)2对染料的吸附量,mg/g;Qt为t时(PAH/Fe3O4-GO)2对染料的吸附量,mg/g;k1为准一级动力学模型中的速率常数,min-1;k2为准二级动力学模型中的速率常数,g/(mg·min)。速率常数k和吸附量Qe可通过绘制图的斜率和截距计算获得。
图10示出(PAH/Fe3O4-GO)2微胶囊吸附亚甲基蓝的准一级动力学和准二级动力学吸附拟合曲线。表1列出了与2种动力学模型相关的参数。由图10和表1中的相关系数(R2)可知,当染料初始质量浓度为1.0、2.5 mg/mL时,采用准二级动力学方程拟合得到的平衡吸附量Qe与吸附实验测量值差异较小,相关系数(R2>0.999)更高,这意味着准二级动力学模型与准一级动力学模型相比更适合用来描述吸附过程,其原因可能是因为(PAH/Fe3O4-GO)2对亚甲基蓝染料的化学吸附控制着吸附过程[18]。
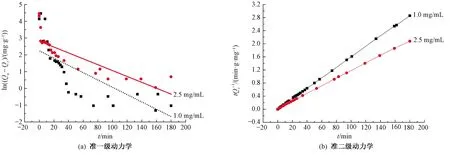
图10 (PAH/Fe3O4-GO)2微胶囊吸附亚甲基蓝的准一级动力学和准二级动力学吸附拟合曲线Fig.10 Pseudo-first-order(a) and pseudo-second-order (b) kinetic for adsorption of MB by (PAH/Fe3O4-GO)2 microcapsules
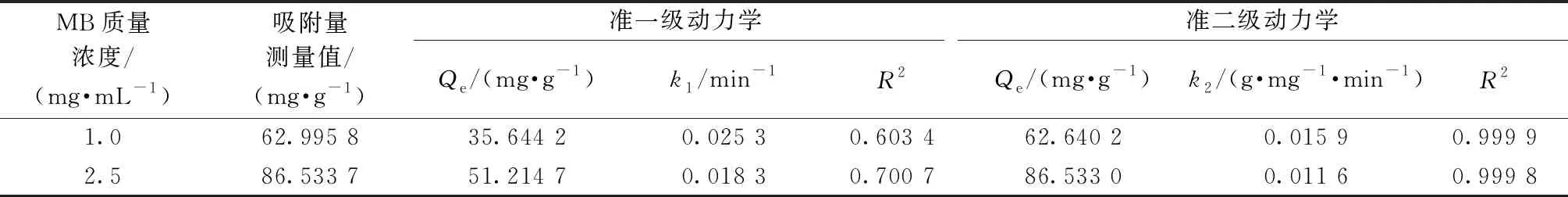
表1 (PAH/Fe3O4-GO)2微胶囊吸附染料的动力学模型参数 Tab.1 Kinetic model parameters for adsorption of MB by (PAH/Fe3O4-GO)2
2.4.2 吸附等温线
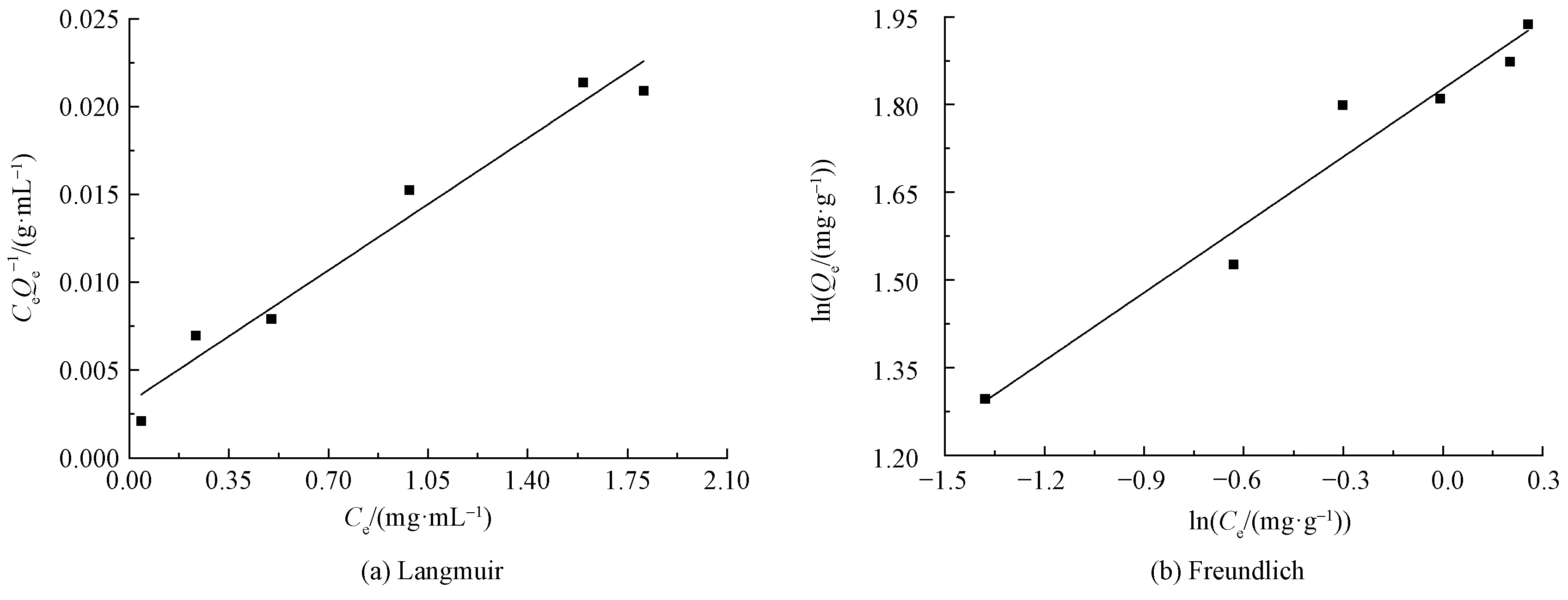
图11 (PAH/Fe3O4-GO)2微胶囊吸附亚甲基蓝的Langmuir和Freundlich吸附等温线Fig.11 Langmuir and Freundlich adsorption isotherms of MB on (PAH/Fe3O4-GO)2 microcapsules
取16 mg的(PAH/Fe3O4-GO)2微胶囊分别置于初始浓度不同的亚甲基蓝溶液中,在溶液的pH值不变的条件下进行研究。为进一步了解吸附剂(PAH/Fe3O4-GO)2对亚甲基蓝染料分子的吸附过程,利用Langmuir方程(见式(6))和Freundlich方程(见式(7))模型作为吸附等温线模型。
(6)
(7)
式中:Ce为平衡时的亚甲基蓝染料的质量浓度,mg/L;KL为Langmuir吸附模型中的吸附常数;Qmax为Langmuir吸附模型的最大吸附量,mg/g;KF为Freundlich模型中的吸附常数;n为Freundlich模型中的异质性因素。以Ce为横坐标、Ce/Qe为纵坐标作图,通过拟合得到的直线斜率和截距可计算得到KL和Qmax。
图11示出(PAH/Fe3O4-GO)2微胶囊吸附染料的Langmuir和Freundlich吸附等温线。
(PAH/Fe3O4-GO)2对亚甲基蓝染料的Langmuir和Freundlich模型的相关参数如表2所示。Langmuir模型的R2高于Freundlich模型,这说明Langmuir模型更适合用来描述吸附剂(PAH/Fe3O4-GO)2对染料的吸附。基于Langmuir模型,可以计算得到吸附剂(PAH/Fe3O4-GO)2对亚甲基蓝的最大吸附量,为219.996 mg/g。这同时说明吸附剂(PAH/Fe3O4-GO)2微胶囊对阳离子染料亚甲基蓝具有较好的吸附性能。

表2 (PAH/Fe3O4-GO)2微胶囊吸附亚甲基蓝的 等温线模型参数Tab.2 Adsorption isotherm parameter for adsorption of MB by (PAH/Fe3O4-GO)2
2.5 脱附行为
亚甲基蓝很容易溶于甲醇中,醋酸的加入有利于洗脱液与吸附的亚甲基蓝的充分接触。此外,醋酸洗脱液有助于破坏亚甲基蓝和(PAH/Fe3O4-GO)2之间的静电力的作用[19]。醋酸-甲醇溶液体积分数为10.0%时,脱附次数对(PAH/Fe3O4-GO)2脱附率的影响如表3所示。结果表明,经4次洗脱后,亚甲基蓝的脱附率可达54%,说明脱附染料后的微胶囊仍然可以作为下一步吸附染料的载体,实现吸附剂的再利用,为印染废水的清洁处理提供了一种可循环多次使用的载体材料。

表3 洗脱次数对磁性微胶囊脱附率的影响Tab.3 Effect of elution times on desorption rate of (PAH/Fe3O4-GO)2
3 结 论
本文基于层层自组装的方法,制备了一种磁性氧化石墨烯/聚丙烯胺盐酸盐杂化微胶囊(PAH/Fe3O4-GO)n,用于吸附染料以净化印染废水。在20 min左右,(PAH/Fe3O4-GO)2对亚甲基蓝的吸附达到平衡点;pH值为12时,(PAH/Fe3O4-GO)2的吸附率最高可达96.5%;准二级动力学模型更符合(PAH/Fe3O4-GO)2微胶囊对亚甲基蓝的吸附过程,吸附过程属于化学吸附;25 ℃条件下的吸附过程更符合Langmuir吸附等温模型,采用Langmuir模型计算得到(PAH/Fe3O4-GO)2微胶囊对亚甲基蓝的理论最大吸附量为219.996 mg/g;当醋酸-甲醇洗脱液的体积分数为10%时,洗脱4次磁性微胶囊对亚甲基蓝的脱附率为54%。磁性氧化石墨烯/聚丙烯胺盐酸盐微胶囊由于脱附容易,循环使用性能好,利用外加磁场可实现染料与水溶液的良好分离,在去除污染物的过程中具有显著的优势,为印染废水的清洁与循环利用提供了一种有效的方法。
