纤维基介孔SiO2药物载体的构建及其释药性能
2021-01-05段红梅汪希铭黄子欣
段红梅,汪希铭,黄子欣,高 晶,王 璐
(东华大学 纺织学院,上海 201620)
近年来,慢性难愈合伤口给病患及医疗系统都带来了沉重的负担[1-2],同时也是全世界非创伤性肢体截肢的主要原因[3],伤口溃疡病变严重时甚至会导致死亡。目前国际上对于慢性伤口尚无准确定义,根据我国医疗卫生行业的一般标准,慢性伤口一般是指在4~8周内无法恢复解剖和功能上的完整性且容易复发的伤口[4]。针对慢性伤口的难愈性,药物缓释体系的建立显得尤为重要。
自从Vallet-Regi等[5]在2001年报道了将有序介孔材料MCM-41作为新的药物传递系统以来,该领域受到广泛关注。现有研究表明,介孔二氧化硅纳米颗粒(MSNs)在药物递送系统中具有十分突出的优势,主要包括良好的生物相容性、低细胞毒性、孔径可调、粒径均一、高比表面积、易于修饰的表面性质、高热稳定性以及化学稳定性等[6-8],这些特性赋予了介孔二氧化硅颗粒高效的药物负载与释放性能。Aghaei等[9]以介孔材料MCM-48为载体,以布洛芬作为药物模型进行药物释放试验,结果表明,布洛芬在15 d内呈现缓慢释放趋势,且无任何细胞毒性。
近年来,静电纺纳米纤维在药物释放系统中的应用日益广泛,其纤维具有直径细、比表面积大等结构特点[10],使其作为药物缓释载体材料更有利于药物的吸收与控制释放[11-12]。此外,其小孔径结构能够有效阻隔外界微生物进入病灶部位;高孔隙率能够保证创面与外界环境进行充分的液体和气体交换,更利于维持创面愈合所需的湿度与氧气含量[13]。Luo 等[14]制备了携带抗肿瘤药物的壳核结构静电纺纤维,并将纤维膜植入肿瘤位置。由于抗肿瘤药物被包裹在纤维的内部,在药物释放中达到了缓释的效果,避免了药物突释。动物试验表明,其对肿瘤细胞增殖起到长期明显的抑制作用,且副作用较小。
基于介孔纳米颗粒和静电纺丝纤维优良的结构特征和药物控释能力,本文将二者结合,首先采用溶胶-凝胶法[15]制备MSNs,通过改变反应体系的pH值来探究MSNs的表面形貌与pH值的关系,从而优化纳米颗粒的结构尺度;而后将合成的MSNs利用超声浸渍法负载抗菌药物盐酸环丙沙星(Cip)[16],探讨了药物溶液浓度对药物包封率和负载率的影响;最后,将一定质量分数的载药MSNs与聚己内酯(PCL)纺丝液混合,通过静电纺丝技术制备出Cip-MSNs/PCL复合纳米纤维,分别探讨了载药MSNs和复合纳米纤维膜中盐酸环丙沙星的释放行为,为针对慢性伤口的药物缓释系统的研究及在功能敷料中的应用提供了参考。
1 试验部分
1.1 材料与仪器
材料:正硅酸乙酯(TEOS)、十六烷基三甲基溴化铵(CTAB)、氢氧化钠、盐酸环丙沙星一水合物(Cip),均购于国药集团化学试剂有限公司;聚己内酯(PCL,数均分子量为80 000),购于西格玛奥德里奇(上海)贸易有限公司;二氯甲烷(DCM)、N,N-二甲基甲酰胺(DMF),购于上海泰坦科技股份有限公司。以上试剂均为分析纯。磷酸盐缓冲液(PBS)为实验室自制。
仪器:集热式恒温加热磁力搅拌器,河南予华仪器有限公司;台式高速离心机,上海卢湘仪离心机仪器有限公司;高压静电纺丝机,深圳通力微纳科技有限公司;Nicolet 6700型傅里叶变换红外光谱仪,美国赛默飞世尔公司;JEM-2100型透射电子显微镜(TEM),日本电子株式会社;D/max-2550VB/PC型X射线衍射仪(SEM),日本岛津公司;QuadraSorb SI型比表面积分析仪,美国康塔仪器公司; TM-3000型扫描电子显微镜,日本日立仪器公司; S-4800型能量色散X射线光谱仪,日本电子株式会社。
1.2 介孔二氧化硅纳米颗粒的制备
采用溶胶-凝胶法制备称取0.5 g CTAB溶于240 mL去离子水中,在40 ℃条件下搅拌,待溶液澄清后分别加入一定量的NaOH溶液,使溶液pH值分别为11.6、11.8和12.0,随后将温度升高至80 ℃;30 min后加入2.5 mL TEOS,80 ℃条件下继续搅拌2 h;将得到的白色悬浊液静置冷却一段时间后,在9 000 r/min条件下离心,并用去离子水和无水乙醇反复洗涤3次,将得到的白色凝胶在真空干燥箱中干燥12 h,再将干燥后的样品置于马弗炉中高温煅烧,在550 ℃条件下焙烧6 h后所得到的白色固体粉末即为介孔二氧化硅纳米颗粒(MSNs)。
1.3 载药MSNs的制备
1.3.1 盐酸环丙沙星的标准曲线
精确称取盐酸环丙沙星固体粉末20 mg于100 mL去离子水中,超声分散均匀,将所得到的药物溶液稀释成合适的浓度梯度,使用紫外分光光度计测量各个浓度的Cip溶液在275 nm处的吸光度,由此得到Cip在水溶液中的标准曲线。盐酸环丙沙星在pH=5.4的PBS缓冲液中的标准曲线依照同样的方法得到。
1.3.2 盐酸环丙沙星的载入
精确称取30 mg合成的MSNs于18 mL水溶液中,超声分散一段时间后分别加入一定量的Cip,使Cip的质量浓度分别为1、3、5、7、10、12 mg/mL,继续超声5 min后在避光环境中低速搅拌20 h,经高速离心后在37 ℃条件下真空干燥24 h,即得到载药MSNs(Cip-MSNs)。取离心后的上清液合并定容并稀释1 000倍,分别测量其在275 nm处的吸光度,得到残余的Cip浓度。包封率(E)及载药量(D)的计算公式[17]分别如式(1)、(2)所示。
(1)
(2)
式中:ma为上清液中药物的质量,mg;mb为投入体系中药物的质量,mg;mdl为载药颗粒的质量,mg。
1.4 Cip-MSNs/PCL复合纤维膜的制备
1.4.1 纺丝液的配制
称取一定量的载药MSNs于DMF中,超声分散一段时间后加入PCL及DCM,使溶液的质量浓度为0.15 g/mL,DCM与DMF的体积比为7∶3,改变MSNs的质量分数分别为3%、6%和9%。将配制好的溶液在室温下搅拌12 h以获得稳定均匀的纺丝液。
1.4.2 静电纺丝工艺
设置纺丝针头到接收滚筒的距离为20 cm,纺丝电压为16 kV,推注速度为1 mL/h,纺丝一段时间后得到一定厚度的载药复合纤维膜(Cip-MSNs/PCL)。纺丝结束后,将制得的纤维膜放入37 ℃的真空干燥箱中干燥24 h,便于后续试验。
1.5 药物的体外释放
在伤口愈合的炎性阶段,由于细菌感染,创面环境呈酸性[18-19],因此,本文中的药物释放试验均模拟创面环境,在酸性条件下进行。
1.5.1 Cip-MSNs中药物的体外释放
配制pH=5.4的PBS缓冲液,精确称取20 mg Cip-MSNs放入装有5 mL PBS缓冲液的透析袋中,再将透析袋置于150 mL PBS中,在恒温摇床中进行试验,试验条件为37 ℃和60 r/min。分别在一定时间间隔点取出5 mL释放介质,稀释至适宜浓度后测量其在275 nm处的吸光度,每次取出后同时补充相同体积、温度以及pH值的PBS缓冲液。根据式(3)计算Cip的累积释放率。
(3)
式中:Cn为第n个取样时间点释放介质中Cip的质量浓度,mg/mL;V为释放时体系的恒定体积,mL;Ci为第i个取样时间点释放介质中Cip的质量浓度,mg/mL;Vi为每次测试时取出的介质体积,mL;m0为投入到释放介质中的药物质量,mg。
1.5.2 Cip-MSNs/PCL中药物的体外释放
将干燥好的复合纤维膜裁剪成相似形状,质量控制为20 mg,置于离心管中,加入8 mL pH值为5.4的PBS缓冲液,放入同样条件的恒温摇床中进行试验。分别在一定时间间隔取出1 mL释放介质,其他操作同1.5.1节,并计算累积释放率。
1.6 性能测试与表征
使用傅里叶变换红外光谱仪(FT-IR)对焙烧前后的介孔SiO2颗粒的化学组成进行表征,采用KBr压片法进行测试。
使用透射电子显微镜(TEM)对介孔SiO2颗粒的结构及形貌进行直观表征,将样品超声分散于乙醇介质中,滴于铜网上自然干燥后测试。
使用X射线衍射仪对合成的介孔SiO2进行小角X射线衍射(SAXD)试验,扫描范围为0.7°~6.0°。
使用比表面积分析仪对介孔SiO2的比表面积和孔径进行分析。测试氛围为氮气,测试温度为77 K,测试前样品先进行真空脱气处理[20]。
使用扫描电子显微镜(SEM)对制备的Cip-MSNs/PCL纤维膜的微观形貌进行观察,并使用Origin对数据进行分析。
使用能量色散X射线光谱仪(EDX)对Cip-MSNs/PCL纤维膜中的硅元素和氯元素进行表征。
2 结果与讨论
2.1 MSNs的表征分析
2.1.1 pH值对MSNs形貌的影响
在MSNs合成过程中,通过改变加入NaOH溶液的量使体系在不同pH值条件下反应,所得产物的TEM照片如图1所示。可以看出,在pH=11.6时,几乎无法形成形貌规则的颗粒;随着pH值的增大,MSNs的粒径也随之增加,且孔道结构逐渐清晰均匀。在pH=11.8时,由TEM观察到的纳米粒子的平均粒径为(63±9)nm;在pH=12.0时,平均粒径为(184±31)nm。考虑到MSNs在静电纺丝过程中的可操作性,采用粒径较小的样品进行后续试验。

图1 不同pH值条件下反应得到的MSNs的TEM照片Fig.1 TEM images of MSNs obtained by reaction at different pH value
2.1.4 载药前后MSNs的红外光谱分析
MSNs在550 ℃焙烧前后的红外光谱图如图2所示。可以看出,焙烧前后的MSNs在801和1 091 cm-1处均有明显吸收峰,对应的是Si—O—Si的伸缩振动;1 634和955 cm-1处的吸收峰来自水分子和Si—OH的伸缩振动。对比发现,焙烧后3 000~2 800 cm-1处的尖锐吸收峰基本消失,此处对应的是CTAB中C—H键的伸缩振动带,表明本试验采用的焙烧方法能基本去除模板剂分子,从而在二氧化硅纳米颗粒中形成介孔孔道。

图2 MSNs在550 ℃焙烧前后的红外光谱图Fig.2 FT-IR spectra of MSNs before and after calcination at 550 ℃
2.1.4 载药前后MSNs的XRD图谱分析
MSNs的小角X射线衍射图如图3所示。在2θ为2.400°处出现衍射峰,说明此材料在一定尺度范围内出现了规则排列的结构形态,存在一定的有序度。结合TEM测试结果分析,可证明该材料中介孔结构的存在。

图3 MSNs的小角X射线衍射图Fig.3 SAXD pattern of MSNs
2.1.4 MSNs的比表面积及孔径分布
MSNs的氮气吸脱附等温线及孔径分布曲线如图4所示。由图4(a)可看出,所制备样品材料的氮气吸脱附等温线有一个较小的回滞环,属于Ⅳ型等温线,符合典型的介孔物质的吸附曲线。图4(b)中纵坐标dV/dD代表孔容随孔径的变化率,可看出,样品材料的孔径大小较为集中。采用BET模型计算得到的比表面积和孔容分别为821.124 m2/g和0.646 cm3/g,介孔平均孔径为3.537 nm,适合用作载体材料。
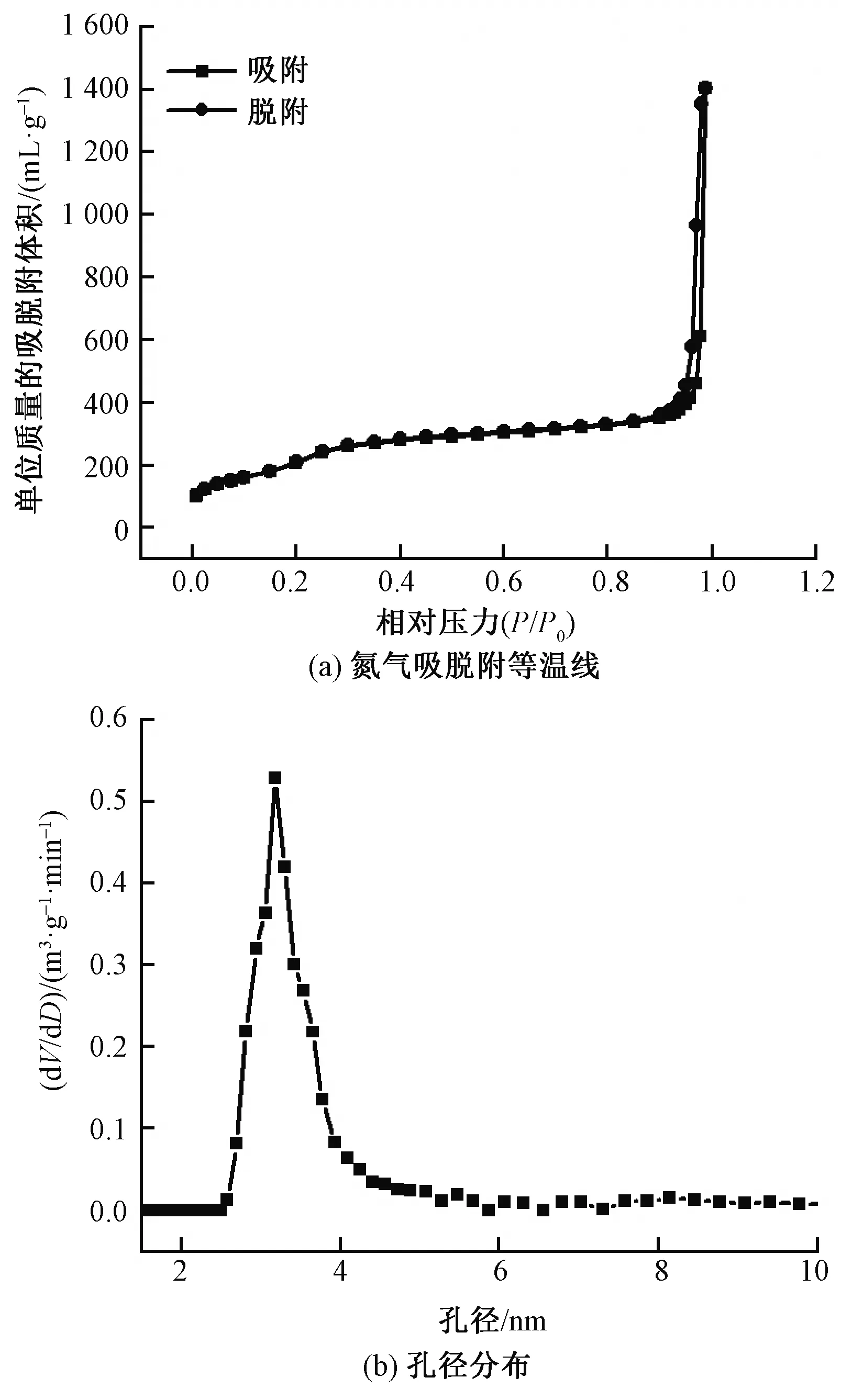
图4 MSNs的氮气吸脱附等温线和孔径分布图Fig.4 N2 adsorption-desorption isotherms(a) and pore size distribution of MSNs(b)
2.2 MSNs的载药性能
2.2.1 Cip的质量浓度-吸光度标准曲线
图5示出Cip在水溶液和pH值为5.4的PBS缓冲液中的质量浓度(C)-吸光度(A)标准曲线,其线性方程分别为A=106.36C和A=103.76C,拟合度R2分别为0.999 95和0.999 99。可见,在这2种介质中,盐酸环丙沙星溶液质量浓度与吸光度具有很好的线性相关性。

图5 Cip在水溶液和pH=5.4的PBS缓冲液中的 标准曲线Fig.5 Standard curve of Cip in aqueous solution(a) and in pH=5.4 PBS buffer(b)
2.2.2 最佳药物溶液质量浓度
药物质量浓度梯度设置为1、3、5、7、10、12 mg/mL,分别对应的药物包封率及载药量曲线如图6所示。可以看出,在药物溶液浓度较低时,MSNs的载药量和包封率均随着药物溶液质量浓度的增加而增加,这是由载体与介质之间的浓度梯度决定的典型扩散作用,但当药物溶液质量浓度进一步增加时,二者均出现下降的趋势,这可能是由于溶液中药物分子质量浓度过高而形成的二聚体甚至体积较大的多聚体,由此形成的空间位阻效应阻碍了药物顺利进入介孔孔道的缘故[21]。在Cip质量浓度达到7 mg/mL时,测得载药量为51.5%,包封率为11.4%,均达到相对较高水平。
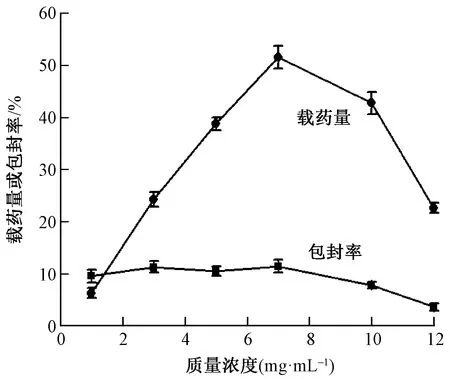
图6 药物溶液质量浓度对MSNs包封率和 载药量的影响Fig.6 Effect of drug solution concentration on encapsulation efficiency and drug loading of MSNs
2.3 Cip-MSNs/PCL纤维膜的表征分析
2.3.1 MSNs含量对纤维膜表观形貌的影响
在纺丝液中分别加入质量分数为3%、6%及9%的MSNs进行静电纺丝,纤维膜的纤维形貌及直径分布如图7所示。可以看出,纤维在3种不同MSNs质量分数的条件下均呈现表面光滑、平直连续的状态。随着MSNs质量分数的增加,纤维直径呈现出逐渐下降的趋势,分别为1.50±0.27、1.36 ± 0.23及(1.32±0.45) μm。这主要是因为MSNs的引入破坏了PCL链之间的分子间相互作用和链缠结,降低了纺丝液的黏度,使纺丝液的电导率增加,射流受到较大的电场力作用拉伸,因此,得到的纤维直径变小[22]。综合考虑纤维的细度及均匀度,选择质量分数为6%的MSNs作为后续试验的纺丝条件。

图7 不同MSNs质量分数Cip-MSNs/PCL复合 纤维膜的SEM照片Fig.7 SEM images of Cip-MSNs/PCL composite fiber membrane with different MSNs mass fraction
2.3.2 药物小分子的分布
Cip-MSNs/PCL复合纤维膜的EDX图谱如图8所示,可直观地表征药物分子在纤维膜中的分布情况。以药物Cip为例,由于药物Cip中含有特征性F元素,因此可以根据F元素的分布状况来观察Cip的分布。如图8(b)所示,F元素呈均匀分布,表明Cip在纤维膜中呈现高度分散的均匀分布。同样从图8(a)中可看出,MSNs在纤维膜中分布均匀。

图8 Cip-MSNs/PCL复合纤维膜的EDX图谱Fig.8 EDX analysis of Cip-MSNs/PCL composite fiber membrane. (a) Distribution of Si; (b)Distribution of F
2.4 药物Cip的释放行为与释放机制
酸性条件下,Cip分别在MSNs和MSNs/PCL纤维膜中的释放行为如图9所示。由图可知,Cip在2种药物载体中的释放趋势基本一致。在最初的0.5 h内药物释放速率较快,在MSNs和MSNs/PCL纤维膜中Cip的累积释放率分别为10.72%和6.09%;12 h内的累积释放率分别达到55.51%和16.53%,药物在纤维膜中的释放率由于纤维结构的包裹远低于MSNs中的释放率;此后Cip在2种药物载体中缓慢释放,在72 h时Cip的累积释放率分别达到69.16%和21.44%,纤维结构中的药物释放率仅为MSNs中的1/3;随着时间的推移,纤维中的Cip将继续缓慢释放,达到长效抗菌的目的。

图9 不同药物载体中Cip的释放曲线Fig.9 In vitro release profile of Cip in different drug carriers
为进一步探索药物Cip在2种载体中的释放机制,采用Ritger-Peppas模型(式(4))对药物释放结果进行拟合,结果如图10所示。
(4)
式中:Mt为t时刻时释放药物的质量;M∞为t无穷大时释放药物的质量;k为常数,表示释放系统的结构和几何特征;n为释放指数,用以表征药物释放的机制。
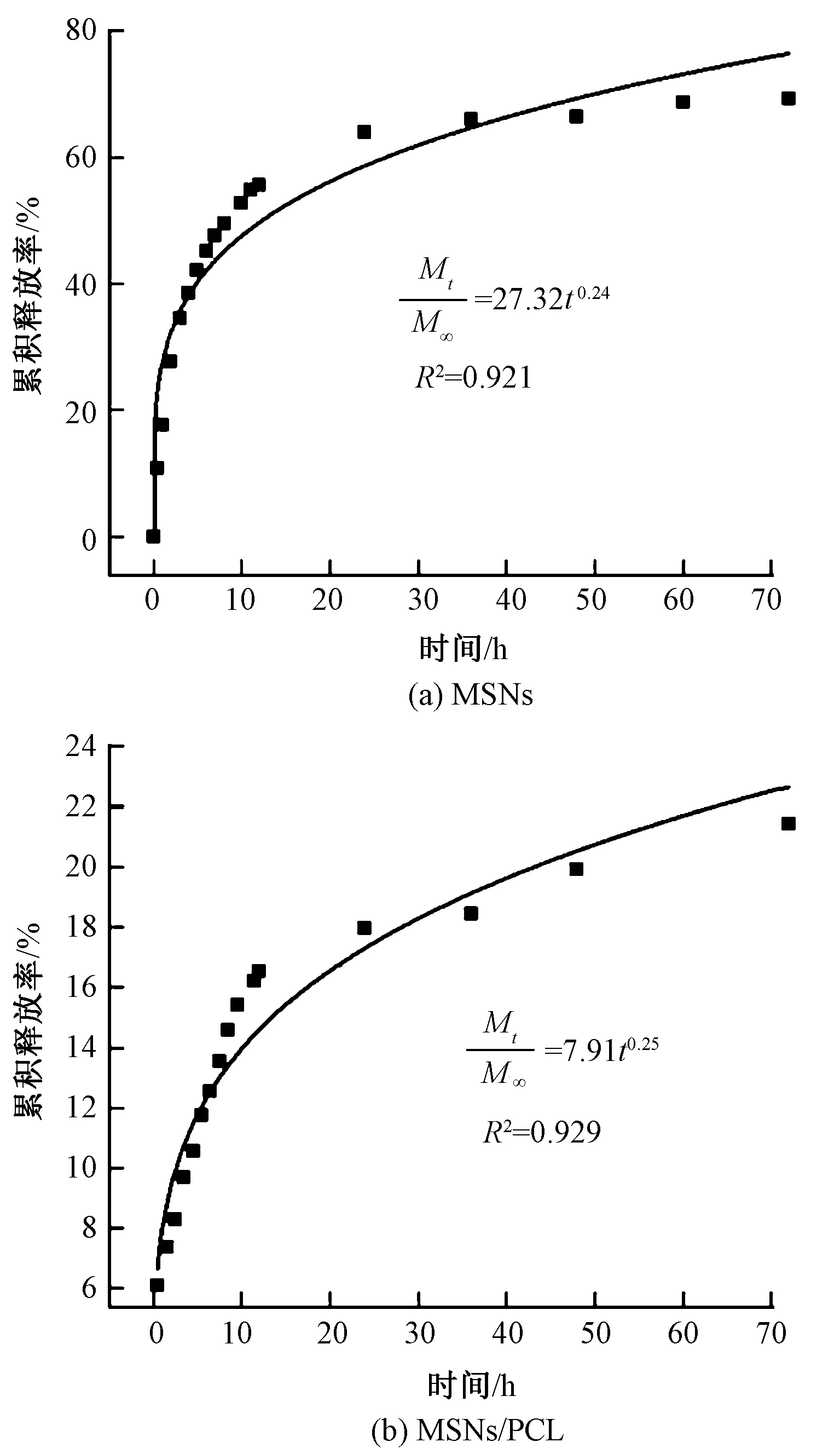
图10 不同载体中药物Cip释放动力学模型拟合Fig.10 Fitting of kinetic model of drug Cip release in different carriers
在使用Ritger-Peppas模型进行拟合的过程中,当n≤0.45时,药物释放机制为Fick扩散;当n≥0.89时,药物释放以骨架溶蚀为主;当0.45 1)采用溶胶-凝胶法制备了MSNs,并探究了反应体系pH值对MSNs表观形貌的影响,发现其粒径大小随pH值的增大而增大。 2)MSNs负载抗菌药物盐酸环丙沙星的试验结果表明,当盐酸环丙沙星的质量浓度为7 mg/mL时,MSNs的载药量可以达到51.5%,包封率为11.4%,表现出良好的载药性能。 3)采用静电纺丝技术将载药MSNs纺入PCL纳米纤维中,得到Cip-MSNs/PCL复合纤维膜,研究发现,当载药MSNs质量分数为6%时得到的纤维较为均匀,药物小分子在纤维膜中呈现出均匀分布的特征。 4)Cip-MSNs颗粒和Cip-MSNs/PCL复合纤维膜在酸性条件下的药物释放试验结果表明,盐酸环丙沙星在2种载体中的释放趋势基本一致,在最初的0.5 h内释放较快,在MSNs和MSNs/PCL纤维膜中Cip的累积释放率分别为10.72%和6.09%;12 h内的累积释放率分别达到55.51%和16.53%;72 h后药物仍有缓慢释放,但纤维结构中的药物释放率远低于MSNs中药物的释放率。 5)使用 Ritger-Peppas模型对2种药物释放模型进行动力学研究,结果表明,扩散是药物在2种载体中释放的主要机制。 具有缓释性能的药物释放模型在慢性伤口的治疗中研究非常广泛,本文所制备的复合纤维膜药物释放模型有望在功能性敷料中得到应用,后续有待更深入地研究。3 结 论
