Atox1参与调控肺癌细胞的增殖和迁移
2021-01-05刘克强谭健张卫强马静波赵京
刘克强,谭健,张卫强,马静波,赵京
1.解放军总医院第七医学中心 胸外科,北京 100700;2.南方医科大学 第二临床医学院,广东 广州 510280
肺癌是严重威胁人类生命健康的恶性肿瘤,其发病率和死亡率较高,转移性强往往是肺癌死亡率高的因素之一[1-2]。癌症转移由一系列敏感地依赖于细胞迁移能力的过程组成,在局部组织浸润时,癌细胞通过肿瘤间质和血管迁移,到达并生长在远处转移部位。铜是肿瘤细胞增殖和血管生成所必需的,细胞铜代谢受铜转运蛋白和伴侣蛋白网络的调节[3],与正常组织比较发现,肿瘤组织中铜的含量更高[4]。
Atox1是细胞内铜转运的重要伴侣蛋白。人Atox1是一种相对分子质量为7400的可溶性蛋白质,折叠成铁氧化还原蛋白样βαββα结构[5]。过去几年,大部分研究焦点集中在Atox1作为铜伴侣的功能上。Atox1的主要功能是将铜输送到ATP7A和ATP7B[6],这种生理过程对细胞维持铜稳态至关重要。Atox1的失活或缺失将导致铜结合分泌酶(PAM)的不成熟[7]。目前多数关于Atox1的研究都是基于Atox1-ATP7A/B铜转移模型,例如 Menkes和 Wilson 病[8]、顺铂耐药[3]、神经元分化和血管损伤后的新内膜形成[9]等。最近的研究发现,Atox1在乳腺癌、结直肠癌、子宫癌、肝癌等癌症中上调,与患者生存率和癌症转移相关[3-4,9-11]。
本研究主要探讨Atox1在转移性肺癌细胞系及非转移性肺癌细胞系中的表达特点及其对细胞增殖和迁移的影响,初步阐明Atox1在肺癌中的生物学功能。
1 材料与方法
1.1 材料
转移性肺癌细胞系(NCI-H292、95-D)、非转移性肺癌细胞系(A549)、正常肺上皮细胞BEAS-2B购自中国科学院上海生命科学研究院细胞资源中心;pCMV-Atox1购自北京义翘神州生物技术有限公司;pCMV-Atox1突变型表达载体由北京海创科业生物科技有限公司构建;Atox1-shRNA慢病毒的构建和包装由北京基石生命科技有限公司完成;RNA逆转录试剂盒和SYBR Green染料购自TaKaRa公司;Atox1引物购自生工生物工程(上海)股份有限公司;Atox1抗体及辣根过氧化物酶标记的二抗购自Abcam公司;CCK-8试剂盒购自日本同仁化学公司;Transwell小室购自康宁公司;F12K培养基购自Sigma公司;RPMI-1640培养基及胎牛血清购自Gibco公司。
1.2 细胞培养与细胞转染
按培养基∶血清为9∶1配置完全培养基,转移性肺癌细胞系NCI-H292、95-D和正常肺上皮细胞BEAS-2B采用RPMI-1640培养基培养,非转移性肺癌细胞系A549采用F12K培养基培养。5%CO2、37℃恒温培养箱为细胞培养环境。
细胞转染采用LipofectAMINE 3000。6孔板中,每孔siRNA浓度为20 nmol/L,质粒用量8 μg/孔,转染细胞24 h后进行后续实验。
1.3 UALCAN在线分析Atox1在肺癌组织中的表达量
采用UALCAN(http://ualcan.path.uab.edu/)分析Atox1在肺癌组织及癌旁组织中的差异表达。
1.4 RNA提取及逆转录
采用TRIzol提取组织或细胞中的RNA,冰上裂解5~10 min后加入氯仿,混匀,静置15 min,4℃、12 000 r/min离心沉淀RNA,吸取上清液至新的EP管中并弃去沉淀,加入等体积异丙醇,4℃静置10 min,12 000 r/min离心10 min,加入75%酒精充分洗涤沉淀,离心去除上清液,将RNA样品沉淀至于超净台干燥5 min,加入DEPC水溶解,Nanodrop测量总RNA浓度,-80℃保存。
将提取的RNA样品置于冰上,采用逆转录试剂盒进行逆转录实验,得到的cDNA样品于-20℃保存待用。
1.5 qRT-PCR实验
采用染料法试剂盒进行荧光定量PCR扩增实验。Atox1正向引物为5′-CTCAGTCATGCCGA AGCA-3′,反向引物为 5′-CTTCAGGGTTGCAAGC AGAG-3′;GAPDH 正向引物为 5′-AGAAGGCTGG GGCTCATTTG-3′,反向引 物 为 5′-AGGGGCCATC CACAGTCTTC-3′。
1.6 蛋白质印迹
冰上裂解细胞并提取细胞中的总蛋白,BCA法检测总蛋白浓度,向蛋白样品中加入上样缓冲液,进行SDS-PAGE。接着进行恒流转膜,脱脂奶粉封闭,4℃孵一抗过夜,次日进行二抗常温孵育,二抗孵育完成后加入化学发光液与蛋白条带反应,凝胶成像仪观察结果。
1.7 细胞增殖检测
按1×104/孔接种细胞至96孔培养板,待细胞贴壁生长覆盖率达50%左右,用LipofectAMINE 3000转染细胞并持续培养4 d。分别于不同时间点,弃去培养基,加入用无血清培养基配置的10%CCK-8反应液,37℃恒温培养40 min,酶标仪检测D450nm值。
1.8 细胞迁移检测
将转染后24 h的5×104各组细胞接种至Transwell的上室,下室分别加入800 μL含20%胎牛血清的培养基,继续培养24 h,取出小室,用PBS清洗3次,甲醇固定15 min,DAPI染色后在荧光显微镜下观察,随机选取5个以上视野拍照计数。
1.9 Atox1稳定敲低细胞株的建立
接种状态良好的NCI-H292细胞至6孔板中,密度为60%~80%,待细胞贴壁后,按照病毒定量结果加入病毒上清液,6 h后更换完全培养基,转染48 h后加入2.0 μg/mL新霉素,继续筛选培养2周至单克隆细胞群形成。
1.10 统计学方法
采用Graphpad Prism 7.0进行统计学分析,Shapiro-Wilk检测实验数据均服从正态分布。多组间均值差异采用单因素方差分析,组内两两分析采用LSD-t,双因素组间均值差异采用双因素方差分析,检测水准α<0.05双侧,实验均重复3次以上,P<0.05表示显著性差异,具有统计学意义。
2 结果
2.1 Atox1在肺癌组织和细胞中的表达分析
UALCAN在线分析肺癌组织与癌旁组织中Atox1的表达量,结果如图1A,肺癌组织中Atox1的表达量明显高于癌旁组织。采用qRT-PCR及蛋白质印迹检测转移性肺癌细胞系(NCI-H292、95-D)、非转移性肺癌细胞系(A549)及正常肺上皮细胞BEAS-2B中Atox1的mRNA和蛋白表达水平,结果如图1B、C。Shapiro-Wilk检测实验数据服从正态分布,S-WNCI-H292=0.995,PNCI-H292=0.859;SW95-D=0.838,P95-D=0.208;S-WA549=0.893,PA549=0.363;S-WHCC827=0.993,PHCC827=0.843。NCI-H292、95-D、A549和HCC827中Atox1的mRNA相对表达量分别为1.000±0.070、0.970±0.101、0.640±0.063、0.530±0.056,F=29.97,P<0.01;转移性肺癌细胞系(NCI-H292,95-D)的mRNA和蛋白表达量均明显高于非转移性肺癌细胞系(A549)和正常肺上皮细胞BEAS-2B,差异具有统计学意义。
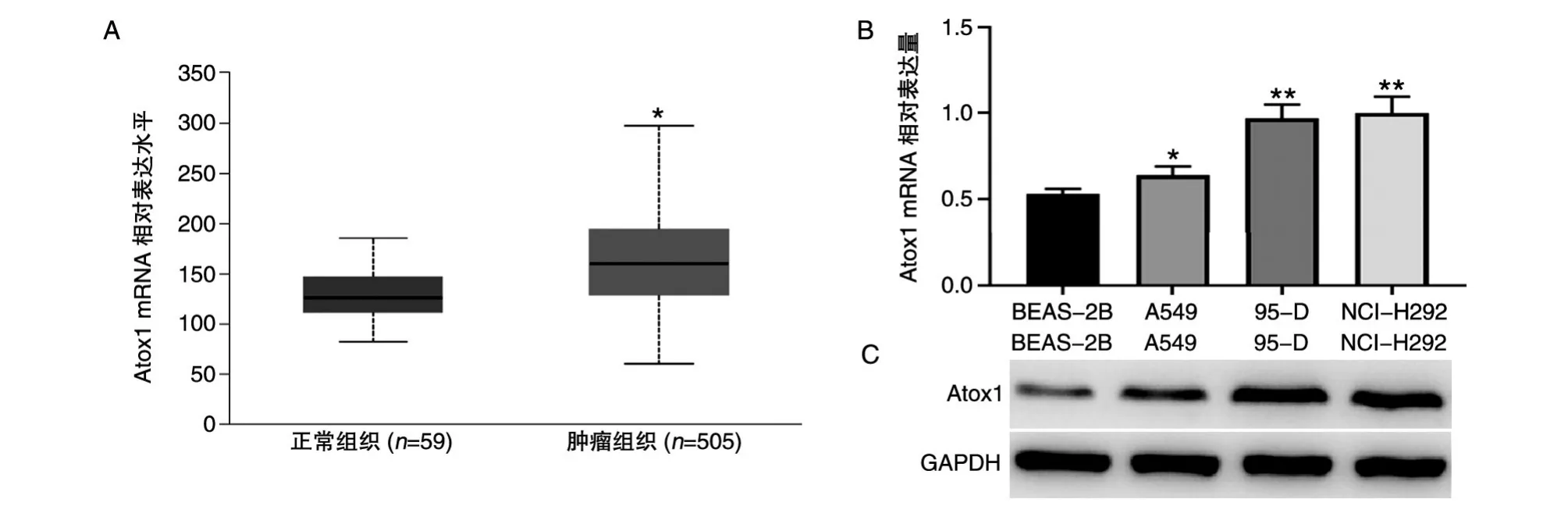
图1 Atox1在肺癌组织和肺癌细胞系中的表达分析
2.2 敲低Atox1抑制NCI-H292细胞增殖和迁移能力
在NCI-H292细胞中用siRNA敲低Atox1,利用qPCR和蛋白印迹分别检测Atox1 mRNA和蛋白表达水平,结果如图2A,相比si-NC组,si-Atox1组蛋白表达量显著降低。采用CCK-8检测敲低Atox1对NCI-H292细胞增殖的影响,结果如图2B,24、48及72 h si-Atox1组细胞增殖能力明显低于si-NC组。Transwell检测敲低Atox1对NCI-H292细胞迁移能力的影响,结果如图2C、D,si-Atox1组细胞迁移能力显著低于si-NC组。综上,通过抑制Atox1的表达能够下调NCI-H292细胞增殖和迁移能力。
2.3 过表达Atox1促进A549细胞增殖和迁移能力
在A549细胞中转染pCMV-control和pCMVAtox1质粒,蛋白质印迹检测蛋白表达水平,结果如图3A,相比对照组,Atox1组蛋白表达量显著增加。采用CCK-8检测过表达Atox1对A549细胞增殖的影响,结果如图3B,Atox1过表达组细胞增殖能力明显高于对照组。Transwell检测过表达Atox1对A549细胞迁移能力的影响,Atox1过表达组细胞迁移能力明显高于对照质粒组(图3C、D)。综上,过表达Atox1能够增加A549细胞增殖和迁移能力。
2.4 Atox1的亚细胞定位影响其功能
Atox1早期作为铜分子伴侣被大量研究,但最近研究发现Atox1还具有转录因子活性。Atox1对NCI-H292细胞增殖和迁移的调控是否依赖于其转录活性呢?首先,我们利用Atox1-shRNA慢病毒载体建立Atox1稳定敲除的NCI-H292细胞株(图4A)。Atox1如果发挥转录因子活性,必然会依赖于其核定位信号进入细胞核。因此,我们分别构建了野生型和缺失核定位信号(KKTGK)[12]的突变型Atox1过表达载体(图4B)。野生型Atox1在稳定敲除细胞株中主要定位于细胞核,而突变型Atox1则集中定位于细胞质(图4C)。野生型Atox1能够促进细胞增殖和迁移,而突变型Atox1的这种促进效应显著下调(图5A、B)。以上结果揭示Atox1对NCI-H292细胞增殖和迁移的调控可能与自身亚细胞定位和转录活性密切相关。
3 讨论
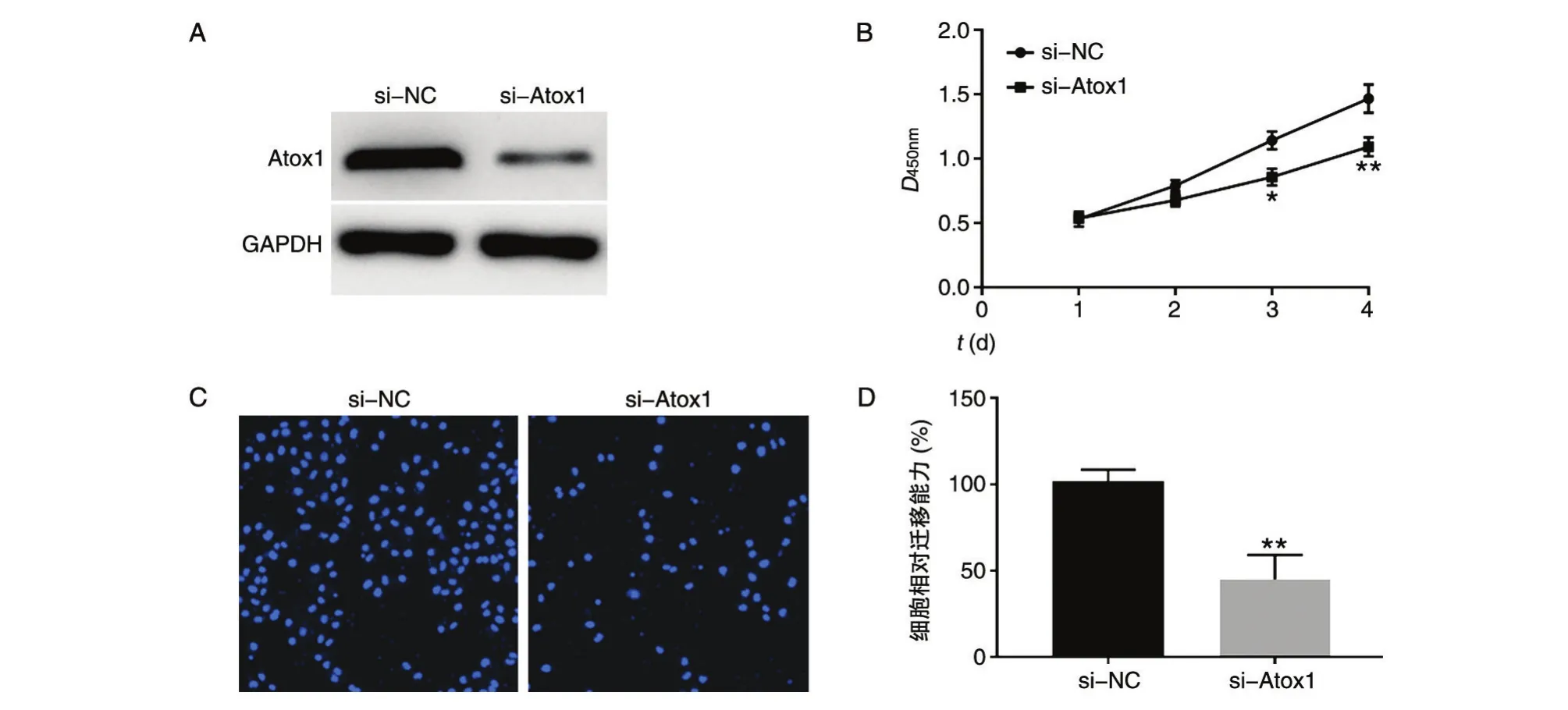
图2 敲低Atox1对NCI-H292细胞增殖和迁移能力的影响
大多数肺癌患者死于癌症转移扩散,迫切需要探索新的治疗方法,提高肺癌治疗效果。在过去10年,肺腺癌中发现了基因组分子激活突变,并衍生出针对特异性突变的分子疗法,使得某些晚期肺癌患者显著提高了生存率[2,13]。
研究表明,细胞恶性转化与代谢变化有关,调节肿瘤代谢的信号转导通路中的许多分子已被作为分子癌症治疗靶点加以研究[3,14]。除了葡萄糖代谢的变化外,细胞恶性转化还与其他代谢途径的变化有关,包括蛋白质合成、脂肪酸代谢和金属代谢,如铜代谢。Atox1是细胞中可以与铜结合的伴侣蛋白,参与促进细胞增殖的关键基因周期蛋白D1的表达,从而促进肿瘤的侵袭和转移过程[10]。最初体内实验研究发现铜能够刺激小鼠胚胎成纤维细胞,并显著促进细胞增殖、周期蛋白D1表达和进入S期,而Atox1-/-组则抵消了这些作用[12]。研究表明,在癌症和动脉粥样硬化的增生性病变中,细胞核中的铜含量高于正常组织。Blockhuys等研究发现Atox1聚集在转移性乳腺癌细胞的板状伪足边界,并且Atox1的沉默导致了转移缺陷,表明Atox1在乳腺癌转移中的作用[15]。为了揭示Atox1在细胞迁移中的可能作用,他们后续探究了Atox1促进乳腺癌细胞迁移的作用机制,发现Atox1通过ATP7A-LOX轴上的铜协调运输介导了乳腺癌细胞的迁移,Atox1可能是转移潜能的预测指标,并可作为铜治疗的生物标志物[10]。此外,通过沉默Atox1能够增加一些抗癌治疗药物比如铜螯合剂的敏感性,激活细胞凋亡通路[16]。
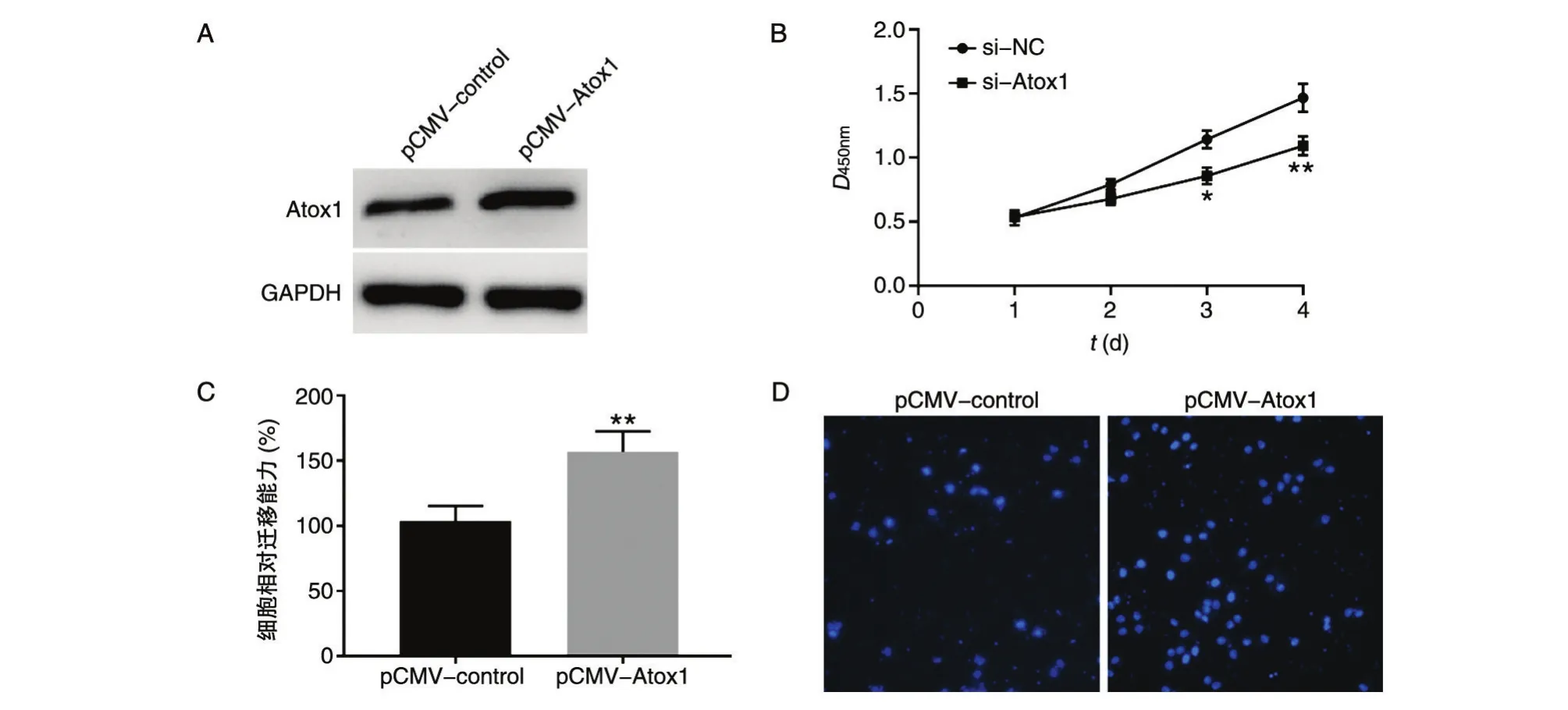
图3 过表达Atox1对A549细胞增殖和迁移能力影响
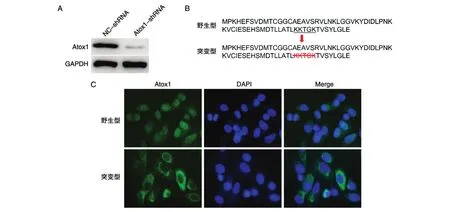
图4 过表达野生型和缺失核定位信号的突变型Atox1
近年来研究发现,Atox1除作为铜伴侣蛋白外还具有转录因子的活性。Atox1能够依靠C端高度保守的核定位信号序列KKTGK进入细胞核,在铜离子存在的情况下结合到周期蛋白D1的GAAAGA启动子区域,提高其mRNA和蛋白表达水平,从而影响铜诱导的细胞增殖[12]。Atox1能与位于细胞外基质的超氧化物歧化酶SOD3的启动子区GAAAGA序列结合,调控SOD3的转录和表达,从而影响细胞外超氧阴离子自由基的水平,影响血管氧化应激压力,进而调控血压和内皮功能[17]。Jana等比较了转移性大肠癌细胞系SW620与其相关的非转移性细胞系SW480中Atox1的细胞定位,发现相比非转移性细胞系SW480,转移性大肠癌细胞系SW620的Atox1核定位增加[4]。
本研究主要探究Atox1沉默对转移性肺癌细胞系及非转移性肺癌细胞系增殖和迁移的影响。首先,通过在线预测Atox1在肺癌组织和癌旁组织中的表达量差异,发现Atox1在肺癌组织中高表达。接着检测了转移性肺癌细胞系及非转移性肺癌细胞系中Atox1的mRNA和蛋白表达,结果表明转移性肺癌细胞系中Atox1的mRNA和蛋白表达均高于非转移性肺癌细胞系。通过si-Atox1敲低NCI-H292细胞Atox1表达,发现明显降低了NCI-H292细胞增殖和迁移能力;而通过在A549细胞中过表达Atox1,发现明显促进A549细胞细胞增殖和迁移能力。进一步,我们在稳定敲除Atox1的NCI-H292细胞中回复表达野生型或缺失核定位信号的突变型Atox1,证明Atox1促细胞增殖和迁移能力与其细胞核定位密切相关,提示Atox1调控细胞增殖和迁移能力与它的转录活性可能相关联。
目前报道的Atox1作为转录因子主要与GAAAGA启动子区域相互作用,而GAAAGA序列在不同物种中具有高度保守性[18]。下一步,我们需要借助生物信息学确定Atox1转录调控的潜在靶标,进一步深入分析Atox1在肺癌细胞中调控通路。Atox1作为铜伴侣蛋白维持细胞内铜离子平衡,同时可发挥转录调控作用,响应细胞中多种功能性调控机制。因此,详细理解Atox1在细胞中的功能具有重要的生物学意义。
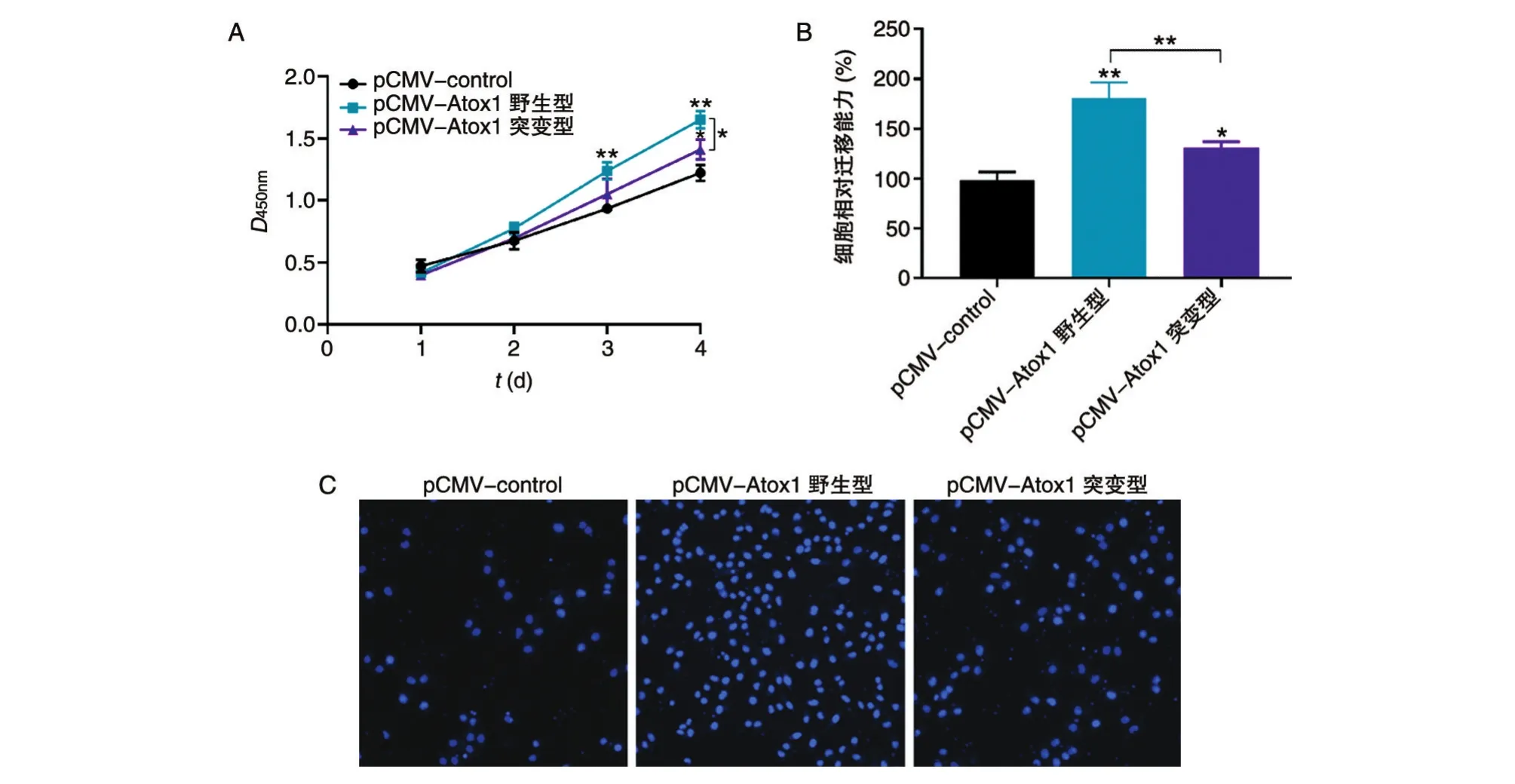
图5 野生型与突变型Atox1的功能差异
