卵清蛋白的棕榈酸化修饰及其对免疫反应的影响
2021-01-05张义浜陈智峰马晓英
张义浜,陈智峰,马晓英
江苏大学 药学院,江苏 镇江 212013
通过基因工程表达的抗原蛋白类疫苗在免疫机体时,往往还需要额外添加诸如氢氧化铝或MF59等佐剂。已知蛋白类药物可通过脂肪酸修饰,改善蛋白类药物的脂溶性,提高与靶细胞的结合程度,从而延长体内半衰期,降低用药剂量,减少用药频率[1]。同样地,如果将抗原蛋白进行体外脂肪酸修饰,增强抗原蛋白的脂溶性,甚至诱导组装形成复杂的纳米结构,使其不易被体内的蛋白酶所降解破坏,延长体内半衰期,从而提高被免疫细胞识别和吞噬的几率,有望达到减少抗原和佐剂的接种量,降低疫苗副作用发生率等目的。
我们以卵清蛋白(ovalbumin,OVA)为模型抗原,拟采用化学反应实现OVA的棕榈酸化修饰,通过一系列体内外研究,比较OVA经棕榈酸体外修饰前后在理化性质和免疫方面的改变。
1 材料与方法
1.1 材料
卵清蛋白购自合肥博美生物科技有限责任公司;棕榈酸N-羟基琥珀酰亚胺酯(棕榈酸-NHS)购自萨恩化学技术(上海)有限公司;8-苯胺基-1-萘磺酸铵(ANS)购自梯希爱(上海)化成工业发展有限公司;BCA法蛋白定量试剂盒购于碧云天生物科技公司;其他为国产分析纯试剂。
1.2 OVA的棕榈酸修饰反应
根据OVA(1 mg/mL)(蛋白中的赖氨酸)与棕榈酸-NHS的摩尔比2∶1、1∶1、1∶2分别进行投料反应,在OVA溶液中缓慢滴入棕榈酸-NHS(溶于N,N-二甲基甲酰胺),室温磁力搅拌反应1 h。反应结束后反应液于12 000 r/min离心10 min,各取适量上清和沉淀部分进行SDS-PAGE分析。
1.3 pH对OVA棕榈酸修饰反应的影响
采用pH5~pH8的磷酸盐缓冲液配成OVA溶液,各缓慢滴加棕榈酸-NHS,室温磁力搅拌1 h。反应结束后12 000 r/min离心10 min,取适量上清液行SDS-PAGE分析,并采用BCA法进行蛋白含量测定。
1.4 棕榈酸修饰卵清蛋白的疏水性分析(ANS荧光探针法)[2]
分别取0.1、0.2、0.3、0.4、0.5、1.0、2.0、3.0 mL OVA溶液,各加入0.2 mL ANS(0.8 mmol/L)水溶液,补加磷酸缓冲液至4 mL;另设同浓度的ANS溶液作为空白对照组。溶液置摇床上避光振荡15 min后荧光分光光度计检测,激发波长378 nm,扫描发射波长400~600 nm。空白组的荧光强度设为零点,将蛋白浓度与对应的荧光强度绘制成曲线,计算回归方程,直线的斜率即为表面疏水值S0。
1.5 体外释放
利用Franz扩散池进行OVA修饰前后在不同亲疏水膜中渗透的差异对比,选取亲水性的混合纤维素和聚砜醚(PES)膜,疏水性的PVDF膜,滤膜孔径为0.45 μm。开启透皮扩散试验仪,温度设为37℃;安装好装置后,加样,搅拌,分别在0、0.5、1、1.5、2、3、6、12 h各时间点从接收池吸取一定量溶液,BCA法测定各时间点接收池中的蛋白浓度。蛋白透过率(%)=(接收池蛋白浓度×接收池体积)/初始蛋白量×100%
1.6 动物的免疫与血清采集
雌性昆明白小鼠(体重18~20 g)由江苏大学实验动物中心提供。实验组采用棕榈酸修饰OVA分别经皮下和肌肉注射,阴性对照组为肌肉注射OVA,肌肉注射OVA加铝佐剂作为阳性对照组,每组各免疫5只小鼠。接种量按OVA计算,每只5 μg。动物初免后,每2周加强免疫一次,共免疫3次。初免后第14、28、42 d取免疫小鼠血清,ELISA法检测特异性抗体滴度。
1.7 ELISA法测定小鼠血清抗体效价
用包被液(pH9.6的0.05 mol/L碳酸盐缓冲液)将OVA蛋白稀释至1 μg/mL,96孔板包被,每孔 100 μL,4℃过夜,弃液体,用 PBST(含0.05% Tween-20的PBS溶液)洗涤3次,按200 μL/孔加入含0.5%牛血清白蛋白(BSA)(PBST配制)的封闭液,37℃封闭1 h,弃液体,PBST洗涤3次,加1∶10 000稀释(用封闭液稀释)的免疫小鼠血清,每孔 100 μL,37℃孵育 2 h;弃液体,PBST洗涤 3次,每孔加100 μL经1∶3000稀释的HRP标记的羊抗小鼠IgG,37℃孵育30 min,PBST洗涤3次,每孔加100 μL TMB底物显色液,37℃显色20 min,每孔加50 μL反应终止液(2 mol/L硫酸),酶标仪选择450 nm处扫板。若实验组D450nm值/阴性对照组D450nm值≥2.1,则结果判为阳性。
1.8 统计学分析
所有数据为至少经过3次以上实验的平均值和标准差,采用GraphPad Prism 5.0软件进行统计学分析,以One-way ANOVA检验组间差异,P<0.05视为有统计学差异。
2 结果
2.1 投料比对修饰反应的影响
通过改变OVA与棕榈酸-NHS的投料比,对棕榈酸修饰前后的OVA进行SDS-PAGE分析,结果如图1。比较原样与反应产物的上清液和沉淀样品在电泳凝胶中的迁移情况,可以发现不同的投料比下,上清液样品的电泳条带基本与原样的电泳条带处于同一位置,而沉淀物的电泳条带位置相对处于更低的位置,表明其在电泳过程中的迁移速度比反应上清和原样更快。从修饰效果来看,3种不同投料比的产物的电泳无明显差异,考虑到棕榈酸-NHS过量可能会导致产物中的杂质量增加,因而选定投料摩尔比为1∶1。
2.2 pH值对修饰反应的影响
采用ANS荧光探针检测不同条件下修饰后蛋白的表面疏水性,OVA水溶液在激发波长378 nm,扫描发射波长400~600 nm,得到对应的荧光强度,以荧光强度对OVA浓度做图(图2)。从图2A可以看出,ANS自身的激发波长为378 nm,最大发射波长为510 nm。当OVA与ANS混合后,溶液的最大发射波长蓝移至474 nm。以最大发射波长474 nm处的荧光强度为纵坐标、蛋白浓度为横坐标绘制曲线,计算回归方程,结果见图2B,计算得回归方程y=569.83x+16.853,相关系数r2>0.99,表明蛋白浓度与荧光强度具有良好的线性关系。当ANS浓度为0.04 mmol/L,OVA浓度为0~1.125 mg/mL时可用于测定其表面疏水值S0。
基于以上结果,改变磷酸缓冲液的pH值,对棕榈酸修饰OVA的产物分别进行表面疏水值和蛋白含量的测定。从表面疏水值来看,在反应液pH为5~8时(考虑到pH值过低或过高都不太利于保持蛋白结构的稳定),随pH值增大,修饰物的表面疏水值呈先增加后减小的趋势,pH6时达到最大值(图2C)。蛋白含量测定结果表明,不同pH值条件下的修饰产物中上清的蛋白含量与原样相比,变化幅度不明显。因此,采用pH6作为OVA棕榈酸修饰反应的最佳条件。
2.3 棕榈酸修饰对OVA二级结构的影响
圆二色谱(CD)分析结果见图3。OVA经棕榈酸修饰前后,在190~195 nm处均有1个正峰,在邻近的208、222 nm处有2个负峰,说明OVA所含的二级结构以α螺旋为主。OVA分别处于纯水或pH6的磷酸缓冲液环境下,对CD谱无明显影响;而OVA在经棕榈酸修饰后,除在205 nm左右处有1个小肩峰外,其产物上清的CD谱图和修饰前基本无明显变化,故认为棕榈酸修饰对OVA蛋白的二级结构无明显影响。
2.4 OVA棕榈酸修饰物的体外释放
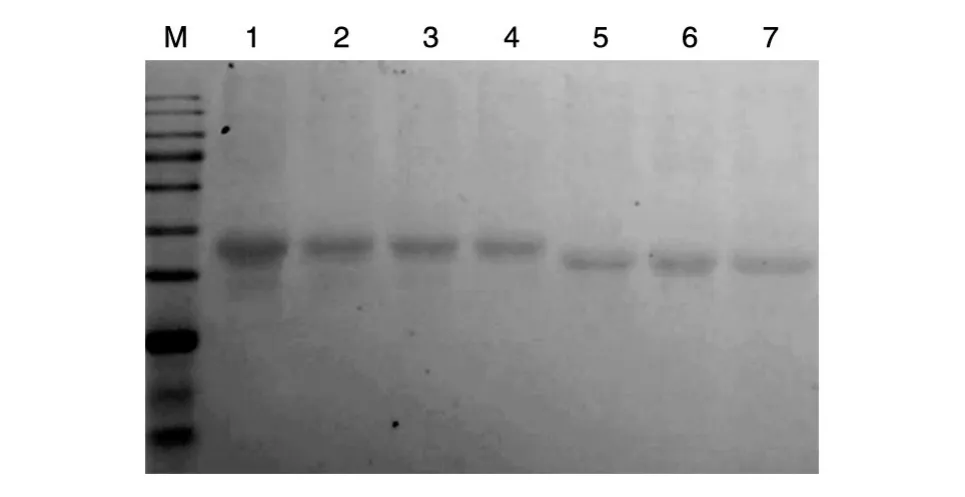
图1 OVA/棕榈酸-NHS不同比例下修饰产物的SDS-PAGE分析
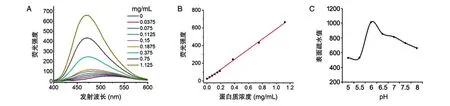
图2 蛋白表面疏水值测定
采用3种材料和性质不同的微孔滤膜来比较修饰前后OVA的体外渗透差异,蛋白在不同膜中的体外累积渗透曲线结果见图4。可以看到,蛋白在3种微孔滤膜中的累积透过量基本在2 h之内达到峰值,其中OVA在亲水膜PES中的透过非常迅速,加样后0.5 h内基本已达到100%;而经过棕榈酸修饰的OVA,12 h后在PES膜中的累积渗透率却仍然不足40%,说明可能是由于修饰后的OVA与膜的相互作用较强,使得蛋白不易从膜中渗透入接收池中。
亲水性混合纤维素膜中的累积透过率曲线与PES膜相反,未修饰的OVA未能在12 h内全部渗透过滤膜,而修饰后的OVA能够在3 h内基本渗透过膜。该结果提示蛋白与2种亲水性膜材料的相互作用程度不同。
当采用疏水性的PVDF滤膜时,经棕榈酸修饰的OVA渗透得更快,且在3 h内累积释放率接近100%,而未修饰OVA的累积释放率不足80%。
以上体外释放实验从侧面表明OVA经过棕榈酸修饰后,其性质发生了不同程度的改变。
2.5 体内免疫结果分析
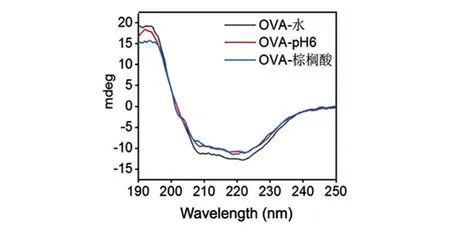
图3 不同反应条件下所得OVA样品的圆二色谱分析
根据图5所示免疫后动物血清中特异性抗体滴度的测定结果来看,实验组均比OVA组的滴度水平要高(均为P<0.05);但从接种方式来看,肌肉注射和皮下注射棕榈酸修饰OVA的免疫效果差别不大。棕榈酸修饰OVA虽然未能达到阳性组(含铝佐剂OVA)所产生的血清抗体滴度,但和未修饰OVA相比明显提高,说明棕榈酸修饰对蛋白的体内过程产生了一定程度的影响,这可能是由于蛋白的棕榈酸修饰改变了其理化性质,尤其提高了蛋白的疏水性,增加对细胞膜的亲和力,延长了体内半衰期,提高了免疫细胞的识别和提呈效率,从而在相同条件下刺激产生了浓度更高的特异性抗体。
3 讨论
在真核生物体内通过棕榈酰转移酶作用实现蛋白的棕榈酰化修饰,是天然界中最为普遍且惟一可逆的脂质修饰,与蛋白的转运、定位和功能发挥有关[3]。而感染宿主细胞的病毒,有些蛋白也会发生脂酰化修饰,以促进病毒识别及进入细胞,帮助病毒复制和组装[4]。这些研究背景促使我们尝试探讨体外脂肪酸修饰对抗原蛋白体内免疫的影响。
我们在对OVA进行体外棕榈酸修饰时,发现反应过程中溶液会变得浑浊,说明有水不溶物产生,因此在反应结束后进行了离心处理,观察到在离心管底确有少量白色沉淀。后来尝试在反应体系中加入不同量的吐温80或泊洛沙姆等表面活性剂,以期起到增溶效果,甚至还通过改用不同浓度乙腈作为反应溶剂来改善不溶物的形成,但均收效甚微。
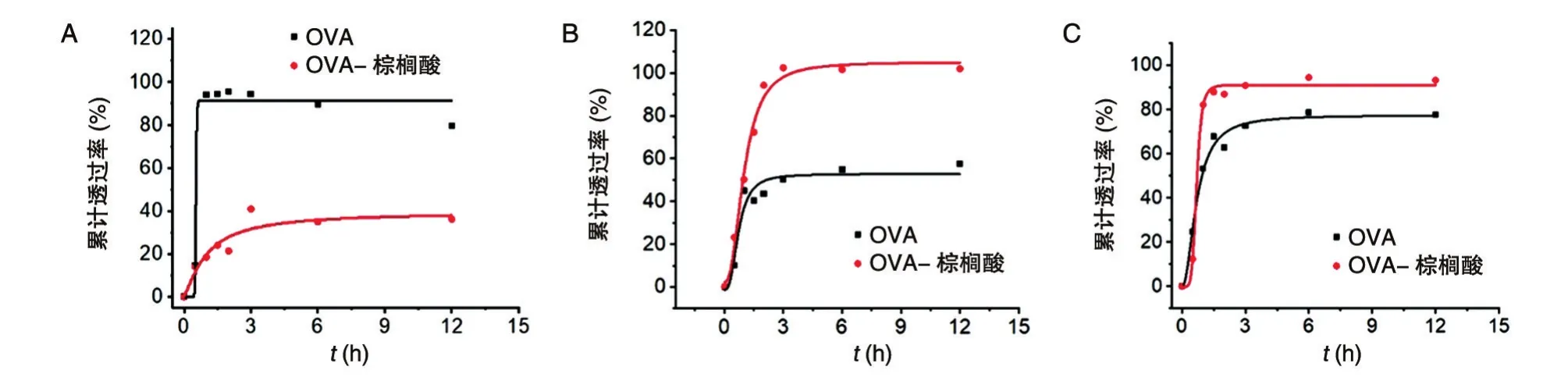
图4 OVA经棕榈酸修饰前后在PES膜(A)、混合纤维素膜(B)、PVDF膜(C)的体外累积透过率
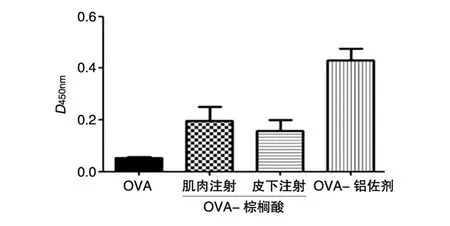
图5 免疫42 d后小鼠血清中特异性抗体滴度检测
对沉淀物的SDS-PAGE分析发现其条带明显靠近相对分子质量更低的位置,分析其原因很可能是由于沉淀物中OVA的棕榈酸修饰程度相对更高,疏水性更强,从而在水溶液中的溶解度明显降低,导致与去污剂十二烷基磺酸钠(SDS)的结合量增加(同比未修饰蛋白的负电荷增加),故而在电场作用下迁移速度加快,因此并非是由于相对分子质量降低导致。此现象及其原因在蛋白脂酰化修饰的文献中[5-7]未见涉及讨论和研究,但可惜由于制备所得的沉淀物量少,且尚未能找到合适的溶剂来溶解沉淀物,因此难以对其做进一步的分析研究和应用。
另外,我们对棕榈酸修饰后的OVA进行了体外稳定性研究,发现经棕榈酸修饰后的OVA溶液样品在4℃冷藏条件下可稳定保存至少1个月(通过对保存过程中蛋白含量测定、SDS-PAGE、表面疏水值测定等分析比较手段),该研究也从侧面提示棕榈酸修饰能够提高抗原蛋白的稳定性。
本研究初步确认以蛋白和棕榈酸-NHS投料摩尔比为1∶1,pH6的磷酸缓冲液为溶剂,对OVA进行体外棕榈酸修饰的效果最佳。通过棕榈酸修饰,可显著提高模型抗原OVA的表面疏水值和体外稳定性。体内免疫结果表明,OVA经棕榈酸修饰后,可在一定程度上提高免疫小鼠血清中特异性抗体的滴度。因此,我们认为对蛋白类抗原的棕榈酸修饰,可在不改变抗原二级结构的前提下,通过提高抗原的表面疏水性,增强免疫效果,有助于减少疫苗抗原和佐剂的使用量。
后续,我们将继续优化实验方案,对OVA或其他模型抗原蛋白进行不同脂肪酸修饰,比较不同脂肪酸修饰物对蛋白抗原免疫应答的影响,探讨其可能的分子作用机制。
