过表达miR-203对脓毒症急性肾损伤大鼠的保护作用
2021-01-05李启成虞大为宗静朱江磊徐东升王忠祥王诗波
李启成,虞大为,宗静,朱江磊,徐东升,王忠祥,王诗波
解放军联勤保障部队第904医院 a.急诊科;b.消化内科;江苏 无锡 214100
脓毒症是指由感染引起的全身性炎症反应综合征,可累及多个系统和器官,进而导致患者死亡[1]。其中,脓毒症引起的急性肾损伤(acute kidney injury,AKI)是严重的并发症之一,病死率高[2-3]。研究表明,AKI的早期发现及治疗可减少患者的死亡[4]。
微小RNA(microRNA,miRNA)是长度约22个核苷酸的内源性非编码单链RNA[5],研究证实其影响人体内关键代谢途径[6]、病理进程[7],进而在细胞增殖、分化、凋亡及应激反应[8]等方面发挥重要作用。miR-203在不同的器官组织、肿瘤中具有差异性表达,例如膀胱癌[9]、胃癌[10]、大肠癌[11]、肺癌[12]、乳腺癌[13]等,但目前鲜有报道miR-203的异常表达与脓毒症大鼠急性肾损伤间的关系。本研究将探讨miR-203对脓毒症大鼠急性肾损伤的保护作用,以期为临床早期干预脓毒症急性肾损伤提供相应的理论依据。
1 材料与方法
1.1 材料
健康的SPF级雄性成年SD大鼠购自河南省实验动物中心[动物生产许可证号:SCXK(豫)2014-0002],体重200±50 g,于SPF级实验室用无菌水和饲料饲养1周后进行造模处理。
Keygen Trans新型转染试剂购自江苏凯基生物技术股份有限公司;miRNA qRT-PCR检测试剂盒、cDNA合成试剂盒购自武汉艾美捷科技有限公司;改良HE染色试剂盒、高效RIPA裂解液购自北京索莱宝科技有限公司;miR-203 agomir、agomir-NC由上海吉玛制药技术有限公司设计并合成;大鼠肌酐(Cr)ELISA定量检测试剂盒、大鼠尿素氮(BUN)ELISA试剂盒、大鼠肾损伤分子1(KIM-1)ELISA试剂盒购自北京百奥莱博科技有限公司;大鼠中性粒细胞明胶酶相关脂质运载蛋白(NGAL)ELISA试剂盒购自上海康朗生物科技有限公司;大鼠白介素1β(IL-1β)ELISA试剂盒购自安徽经科生物技术有限公司;大鼠肿瘤坏死因子α(TNF-α)ELISA试剂盒购自南京森贝伽生物科技有限公司;β-actin抗体(ab6276,小鼠单克隆抗体)、Toll样受体4(TLR4)抗体(兔多克隆抗体)、磷酸化p65(p-p65)抗体(兔多克隆抗体)、山羊抗兔IgG H&L(HRP)、山羊抗小鼠IgG H&L(HRP)购自艾博抗(上海)贸易有限公司;磷酸化NF-κB(p-IκBα)抗体(小鼠单克隆抗体)购自美国圣克鲁斯生物技术公司。
1.2 实验分组及建模
将40只SPF级雄性SD大鼠随机分为假手术组、模型组、miR-203 agomir组、agomir-NC组,每组10只,通过盲肠结扎穿刺法(CLP)建立脓毒症大鼠模型。miR-203agomir、agomir-NC组模型建立后分别尾静脉注射miR-203 agomir和agomir-NC,每次10 nmol/L,模型组和假手术组注射等量的生理盐水,24 h后检测相关指标变化情况。
1.3 RT-qPCR检测miR-203表达水平
提取大鼠肾组织总RNA,反转录为cDNA,RT-qPCR测定miR-203表达水平,U6为内参,采用2-ΔΔCt法计算其相对表达。miR-203正向引物为5′-ACACTCCAGCTGGGGTGAAATGTTTA-3′,反向引物为 5′-TGGTGTCGTGGAGTCG-3′;U6 正向引物为 5′-CTCGCTTCGGCAGCACA-3′,反向引物为5′-AACGCTTCACGAATTTGCGT-3′。反应条件:95℃预变性 15 min,然后按 95℃ 5 s、60℃ 30 s进行35个循环扩增。
1.4 ELISA检测血清肾功能指标、肾损伤指标、炎性指标
收集全血标本,4℃、1000 r/min离心20 min,收集上清。将ELISA检测试剂盒于室温条件下平衡20 min,标准孔中加入不同浓度的标准品50 μL,样本孔中加入待测样本50 μL;每孔加入辣根过氧化物酶标记的检测抗体100 μL,用封板膜封住反应孔,37℃孵育60 min;弃上清,加入350 μL洗涤液,室温孵育1 min;弃上清,上述步骤重复5次;每孔加入底物A、B各50 μL,37℃避光孵育15 min;每孔加入50 μL终止液,用酶标仪测定各孔的D450nm值。
1.5 HE染色观察各组大鼠肾组织病理变化
SD大鼠造模成功24 h后麻醉处死。取肾组织,4%多聚甲醛固定后进行梯度无水乙醇脱水,石蜡包埋,切片,脱蜡,用苏木精-伊红溶液染色,脱水,中性树脂封片。光学显微镜观察大鼠肾组织的病理变化。
1.6 Western印迹检测蛋白表达水平
组织匀浆后用RIPA裂解液提取各标本的总蛋白,BCA法测定蛋白浓度。配制分离胶和浓缩胶进行SDS-PAGE。转PVDF膜后加入5%脱脂牛奶进行封闭,然后加入一抗(1∶1000),4℃过夜孵育;加入二抗(1∶3000),室温孵育1 h;洗膜后用ECL发光液显影,采用Image J软件对条带进行灰度分析。
1.7 统计学分析
采用SPSS 20.0医学统计学软件进行统计分析。计量资料以x±s表示,多组数据之间比较采用F检验,组间比较采用LSD-t检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 各组大鼠miR-203表达水平
与假手术组比,模型组和agomir-NC组大鼠肾组织miR-203表达水平显著下降(P<0.05);与agomir-NC组比,miR-203 agomir组大鼠肾组织miR-203表达水平显著升高(P<0.05),提示转染成功(图1)。
2.2 各组大鼠血清中肾功能及肾损伤标志物含量
与假手术组比,模型组和agomir-NC组大鼠血清Cr、BUN、NGAL、KIM-1含量均显著升高(F值依次为36.249、124.320、38.819、260.307,P<0.05);与agomir-NC组比,miR-203 agomir组大鼠血清Cr、BUN、NGAL、KIM-1含量均显著下降(t值依次为5.650、8.559、7.498、16.797,P<0.05)(图2)。
2.3 各组大鼠血清炎性因子含量
与假手术组比,模型组和agomir-NC组大鼠血清TNF-α、IL-1β含量均显著升高(F值分别为248.561、91.946,P<0.05);与agomir-NC组比,miR-203 agomir组大鼠TNF-α、IL-1β含量均显著下降(t值分别为16.926、7.516,P<0.05)(图3)。
2.4 各组大鼠肾组织病理变化
假手术组大鼠肾组织结构正常;模型组和agomir组大鼠肾组织细胞水肿,伴有炎性浸润、肾小球皱缩、肾小管闭塞;miR-203 agomir组大鼠肾组织水肿、炎性浸润以及肾小球和肾小管病变情况均得到缓解(图4)。
2.5 miR-203对TLR4/NF-κB信号通路的影响
与假手术组比,模型组和agomir-NC组大鼠肾组织 TLR4、p-p65、p-IκBα蛋白表达水平显著升 高(P<0.05);与 agomir-NC 组 比 ,miR-203 agomir组大鼠肾组织TLR4、p-p65、p-IκBα蛋白表达水平显著下降(P<0.05)(图5)。
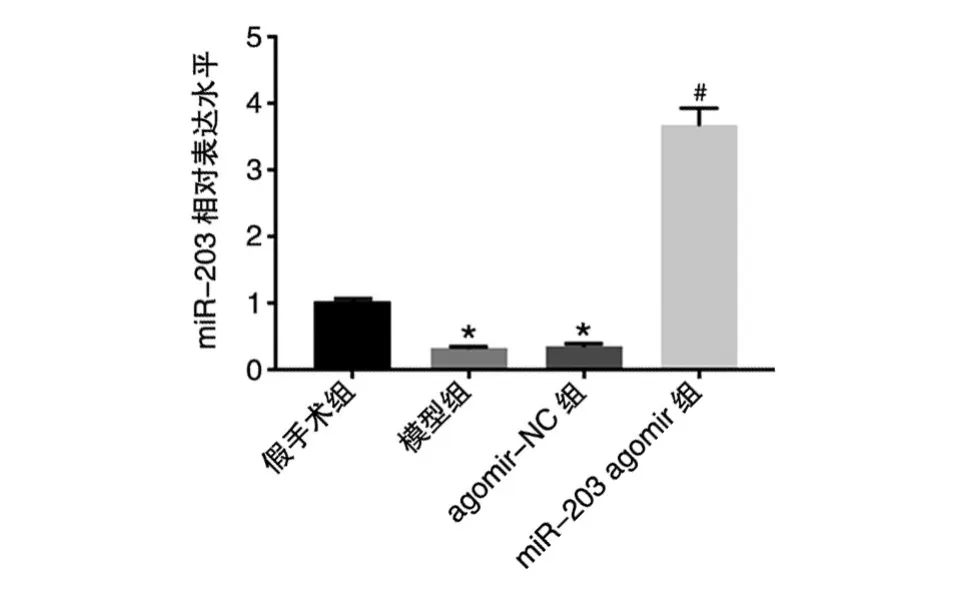
图1 各组大鼠miR-203表达水平

图2 各组大鼠血清中肾功能及肾损伤标志物含量
3 讨论
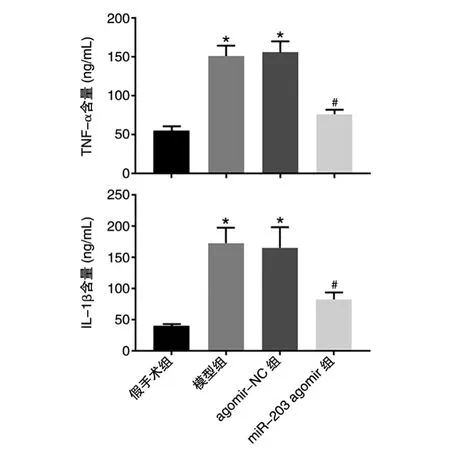
图3 各组大鼠血清炎性因子含量
30%~50%脓毒症患者会发生脓毒症急性肾损伤,这是常见的并发症之一,具有病情危重、临床治疗不佳、致死率高等特征[14]。已有研究表明,异常表达的miR-203在多种类型的癌症中扮演着抑癌的角色。Shen等[9]发现miR-203可能通过负调控组织转录因子Twist同系物1(Twist1)而在膀胱癌细胞中充当肿瘤抑制性miRNA。Du等[11]研究表明miR-203通过靶向重组人帕金森病蛋白7(DJ-1,PARK7)抑制大肠癌细胞的增殖并促进细胞凋亡。Chen等[15]发现miR-203通过靶向脂肪酸结合蛋白4(FABP4)抑制肺癌细胞转移。本研究通过RT-qPCR检测各组大鼠肾组织miR-203表达水平,发现与假手术组比,模型组和agomir-NC组大鼠肾组织miR-203表达水平显著下降;与agomir-NC组比,miR-203 agomir组大鼠肾组织miR-203表达水平显著升高。这提示miR-203在脓毒症急性肾损伤发生发展中扮演着抑癌作用。
HE染色结果显示,与假手术组比,模型组和agomir-NC组大鼠肾组织细胞水肿,且伴有炎性浸润、肾小球皱缩;过表达miR-203后,肾组织水肿、炎性浸润及肾小球皱缩均得到显著改善。Cr和BUN是判断肾功能损害的重要指标,在急性肾损伤中高表达[16];KIM-1和NGAL是急性肾损伤的重要生物标志物,在急性肾损伤早期高表达[17]。Han等[18]研究表明虎杖和肉桂通过降低Cr、BUN、NGAL、KIM-1水平并抑制肝黄嘌呤氧化酶(xanthine oxidase,XOD)表达进而改善高尿酸血症大鼠生物肾脏功能。通过ELISA实验观察各组大鼠肾功能指标Cr与BUN的变化,结果显示,与假手术组比,模型组和agomir-NC组血清Cr、BUN、NGAL、KIM-1水平均显著升高;过表达miR-203后,血清 Cr、BUN、NGAL、KIM-1水平均显著下降。这提示miR-203能够降低脓毒症急性肾损伤的肾功能损害程度。
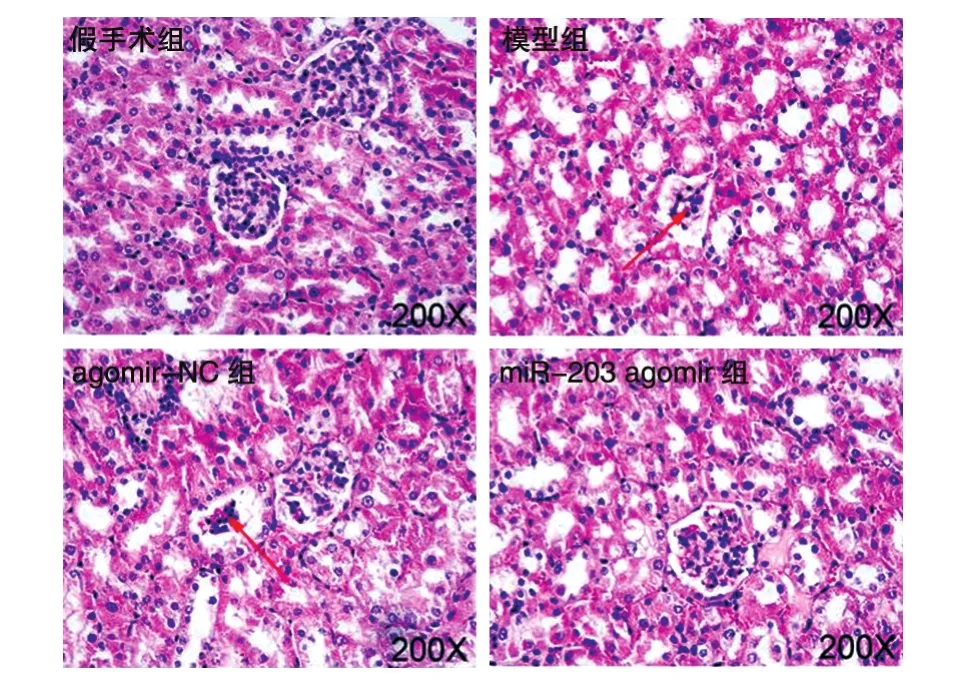
图4 各组大鼠肾组织病理变化(200×)
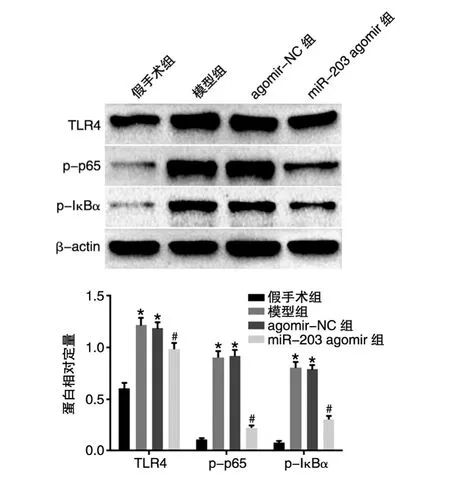
图5 miR-203对TLR4/NF-κB信号通路的影响
IL-1β和TNF-α是脓毒症级联反应中单核巨噬细胞产生的重要炎性因子,是反映机体炎症程度的指标[19]。本研究结果显示,与假手术组比,血清IL-1β、TNF-α水平均显著升高;过表达miR-203后,血清IL-1β、TNF-α水平均显著下降。这提示miR-203可能通过抑制炎症反应而发挥肾脏保护作用。
王彬等[20]研究表明,在实验性重度急性胰腺炎组织中的TLR4、NF-κB p65表达变化与肾损伤严重程度和促炎因子的变化一致。Zhang等[21]研究表明Tec激酶的负调控通过TLR4/NF-κB信号通路减轻脂多糖诱导的小鼠急性肾脏损伤。Zhang等[22]发现棕榈酸通过激活 TLR4/Krüppel样转录因子(KLF7)/NF-κB炎性信号促进炎性细胞因子IL-6的表达。Li等[23]研究表明红景天苷通过抑制TLR4/NF-κB和MAPK信号通路,并减少炎性细胞因子 IL-1β、IL-6、TNF-α的释放,进而改善肾间质纤维化。李登等[24]研究表明miR-203通过下调TLR4-Myd88-NF-κB信号通路诱导M2型巨噬细胞极化。本研究结果显示,与假手术组比,模型组和agomir-NC组肾组织TLR4、p-p65、p-IκBα水平均显著升高;过表达miR-203后,肾组织 TLR4、p-p65、p-IκBα水平均显著下降。这提示miR-203对脓毒症急性肾损伤的保护作用是通过抑制TLR4/NF-κB信号通路起作用的。
综上所述,本研究表明miR-203在脓毒症急性肾损伤的发生及发展中发挥一定的作用,miR-203在其中呈低表达水平,miR-203能够抑制炎症反应,对脓毒症急性肾损伤大鼠起到保护作用,其机制可能与miR-203抑制TLR4/NF-κB信号通路有关。miR-203可作为脓毒症急性肾损伤中的预测性生物标志物,对临床诊断及疗效判定等方面具有重要的意义。
