UPLC法测定血液科患者血浆中利奈唑胺的浓度
2021-01-05沈越凡范国荣唐原君
陈 明,沈越凡,范国荣,唐原君*
(1.上海交通大学附属第一人民医院临床药学科,上海 200080;2.上海市嘉定区江桥医院药剂科,上海 201800)
1 仪器和试药
1.1 仪器 Thermo UltiMate_3000 UPLC仪(包括LPG-3x00色谱泵、WPS-3000自动进样器、TCC-3x00柱温箱、VWD-3x00检测器和Chromeleon 6.80工作站,美国Theromo Fisher公司);HY-5涡旋混合器(美国SI公司);Centrifuge 5804R冷冻离心机(德国Eppendorf公司);AL104-01电子分析天平(瑞士Mettler Toledo公司);CPA2250电子分析天平(德国赛多利斯公司);SK7200H超声仪(上海科导超声仪器有限公司);Auto Vap S60浓缩仪(美国ART公司);Hi-Tech水纯化系统(18.2 Ω,上海和泰仪器有限公司)。
1.2 试药 利奈唑胺(纯度98%,批号M0801AS)、苯妥英钠对照品(纯度99%,批号J0727AS,大连美仑试剂有限公司);磷酸二氢钾(批号20190725,上海凌峰化学试剂有限公司);甲醇(批号1036307929,德国Merck Millipore公司);甲基叔丁基醚(批号17080261,美国Tedia公司);异丙醇(批号K49790140802,德国Merck Millipore公司);水为用Hi-Tech水纯化系统自制的超纯水。
2 方法和结果
2.1 溶液配制
2.1.1 利奈唑胺对照品储备液 精密称取利奈唑胺对照品10.50 mg, 置于10 ml容量瓶中, 加甲醇溶解并定容, 摇匀, 即得利奈唑胺浓度为1.05 mg/ml的对照品储备液, 置于4 ℃冰箱保存。
2.1.2 苯妥英钠内标溶液 精密称取苯妥英钠对照品10.01 mg,置于10 ml容量瓶中,加甲醇溶解并定容,摇匀,即得苯妥英钠浓度为1.01 mg/ml的对照品储备液。精密吸取苯妥英钠对照品储备液,用甲醇逐级稀释成1.01 μg/ml的内标溶液,置于4 ℃冰箱保存。
2.2 血样前处理 人血浆样品于室温下解冻后,取200 μl置于一1.5 ml Eppendorf塑料离心管中,加入20 μl苯妥英钠浓度为1.01 μg/ml的内标溶液,涡旋混匀,再加入1 ml提取溶剂(叔甲醚∶异丙醇=90∶10),涡旋振荡5 min,于1.889 4×104×g离心10 min。取上清液800 μl,于氮气下吹干,加200 μl流动相复溶,涡旋振荡1 min,于1.889 4×104×g离心5 min,取上清液80 μl置于进样器中自动进样20 μl,进行HPLC分析,采用内标标准曲线法检测人血浆样品中利奈唑胺的浓度。
2.3 色谱条件 色谱柱:Agilent ZORBAX SB-C18柱(100 mm×2.1 mm,1.8 μm);流动相:甲醇∶水=55∶45(V∶V),等度洗脱,流速0.3 ml/min,柱温:30 ℃,检测波长254 nm,进样量20 μl,分析时间为3 min。
2.4 方法学验证
2.4.1 方法专属性 在本研究条件下,利奈唑胺的保留时间为1.473 min,内标保留时间为2.577 min,样品峰型良好。血浆中的内源性物质对测定无干扰,具有较好的特异性。典型色谱图见图1。

图1 人血浆中利奈唑胺的UPLC谱图Figure 1 UPLC chromatograms of linezolid in human plasmaA:空白血浆;B:空白血浆添加浓度为10.50 μg/ml的利奈唑胺对照品溶液和浓度为1.01 μg/ml的内标苯妥 英钠溶液;C:患者血浆样品添加浓度为1.01 μg/ml的内标苯妥英钠溶液;1:利奈唑胺;2:苯妥英钠
2.4.2 标准曲线和定量下限 精密吸取2.1项下利奈唑胺对照品储备液,用空白血浆配制成利奈唑胺浓度为21.00、10.50、5.250、2.100、1.050、0.525、0.210和0.105 μg/ml的标准对照品溶液,按2.2项下方法操作后进样测定。以待测物浓度(X)为横坐标,待测物峰面积与内标峰面积比值(Y)为纵坐标进行线性回归,得利奈唑胺浓度测定的标准曲线方程为:Y=1.094X-0.035 17,r=0.999 9。标准曲线上各点回算后所得浓度与标示量的偏差均<15%。结果表明,利奈唑胺浓度在0.105~21.00 μg/ml范围内线性关系良好。本方法定量下限为利奈唑胺标准曲线的最低浓度点0.105 μg/ml,检测限为0.052 5 μg/ml。
2.4.3 准确度和精密度 按2.4.2项下方法配制利奈唑胺浓度分别为0.210、2.100和16.80 μg/ml的低、中、高3种浓度的质控样品,每个浓度平行配制5份,按2.2项下方法处理后进样测定。将血浆样品中利奈唑胺的峰面积与内标峰面积比值代入相应的随行标准曲线,通过测得浓度与配制浓度的比值计算相对回收率,并计算日内精密度。将低、中、高3个浓度的质控样品连续测定5 d,每次每个浓度测定5份,计算日间精密度,结果见表1。
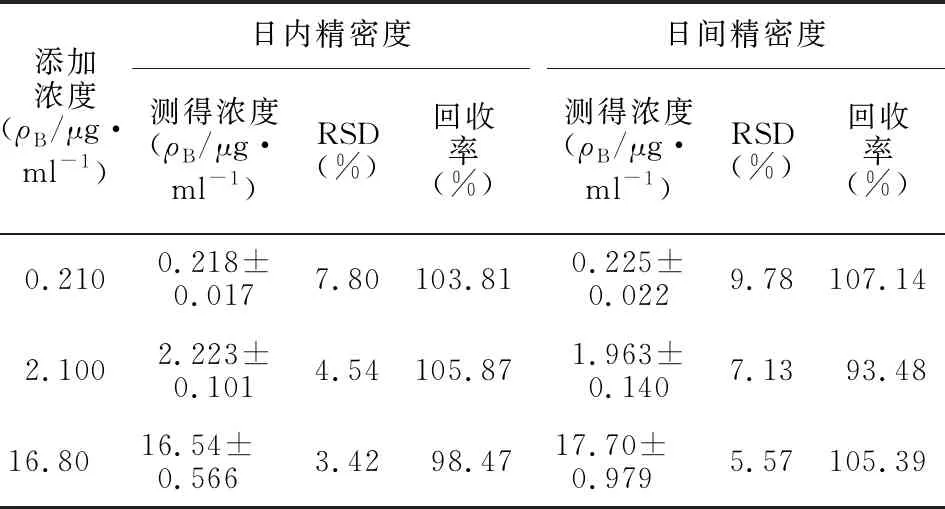
表1 UPLC法测定利奈唑胺的 回收率和精密度实验结果Table 1 Results of recovery and precision tests of linezolid by UPLC method (n=5)
2.4.4 提取回收率 按2.4.2项下方法配制含利奈唑胺浓度分别为0.210、2.100和16.80 μg/ml的低、中、高3种浓度的质控样品,每个浓度平行配制5份,按2.2项下方法处理后进样测定,得样品和内标的峰面积A1、A2。将空白血浆按2.2项下方法处理至样品吹干,用利奈唑胺对照品溶液配制成浓度为0.210、2.100、16.80 μg/ml的溶液复溶,每个浓度样品平行配制5份,进样得样品和内标的峰面积B1、B2。以样品和内标峰面积B1、B2与相应峰面积A1、A2的比值计算提取回收率,重复操作5次,得到利奈唑胺及内标的提取回收率为81.03%~88.65%。
2.4.5 稳定性实验 本研究主要考察了利奈唑胺质控样品室温放置12 h、反复冻融3次、-70 ℃密封保存1个月的稳定性。取含利奈唑胺浓度分别为0.210、2.100和16.80 μg/ml的低、中、高浓度的质控样品进行稳定性实验,按2.2项下方法处理后进样测定,每次平行测定5份样品。结果血浆样品中利奈唑胺回收率为86.53%~110.26%,RSD均<15%(n=5),表明利奈唑胺质控样品在上述条件下均稳定。
2.5 血液科患者利奈唑胺的血药浓度监测 收集上海交通大学附属第一人民医院血液科患者62例,其中男性33例,女性29例,平均年龄(47.93±15.37)岁。经临床医师确认使用利奈唑胺注射液(商品名 斯沃,批号18J22U31,美国辉瑞公司)0.6 g,q12 h,ivgtt治疗。当药物浓度达到稳态时,采集患者谷浓度血样(第5剂前0.5 h),按2.2项下方法处理并测定,根据测定当日的随行标准曲线进行定量。结果62例患者的血样均能得到有效分离。利奈唑胺谷浓度分布情况见图2。图2中每个点代表各患者血样中利奈唑胺的具体浓度,可以直观看出利奈唑胺谷浓度的大致分布范围。按常规给药方式,有9.68%的患者谷浓度<2 μg/ml,19.35%的患者谷浓度>8 μg/ml,70.97%的患者谷浓度范围在2~8 μg/ml。62例患者利奈唑胺平均谷浓度为(5.98±3.56) μg/ml,与文献报道的利奈唑胺谷浓度参考范围2~8 μg/ml接近[8-9]。其中,最低浓度为0.11 μg/ml,最高浓度为15.62 μg/ml,患者间利奈唑胺谷浓度变异率为59.64%。Cattaneo等[9]研究表明,在常规剂量下,利奈唑胺药动学个体差异较大。本研究通过测定62例患者利奈唑胺血药浓度,证实了利奈唑胺个体化差异的存在,体现了进行利奈唑胺血药浓度监测的意义。
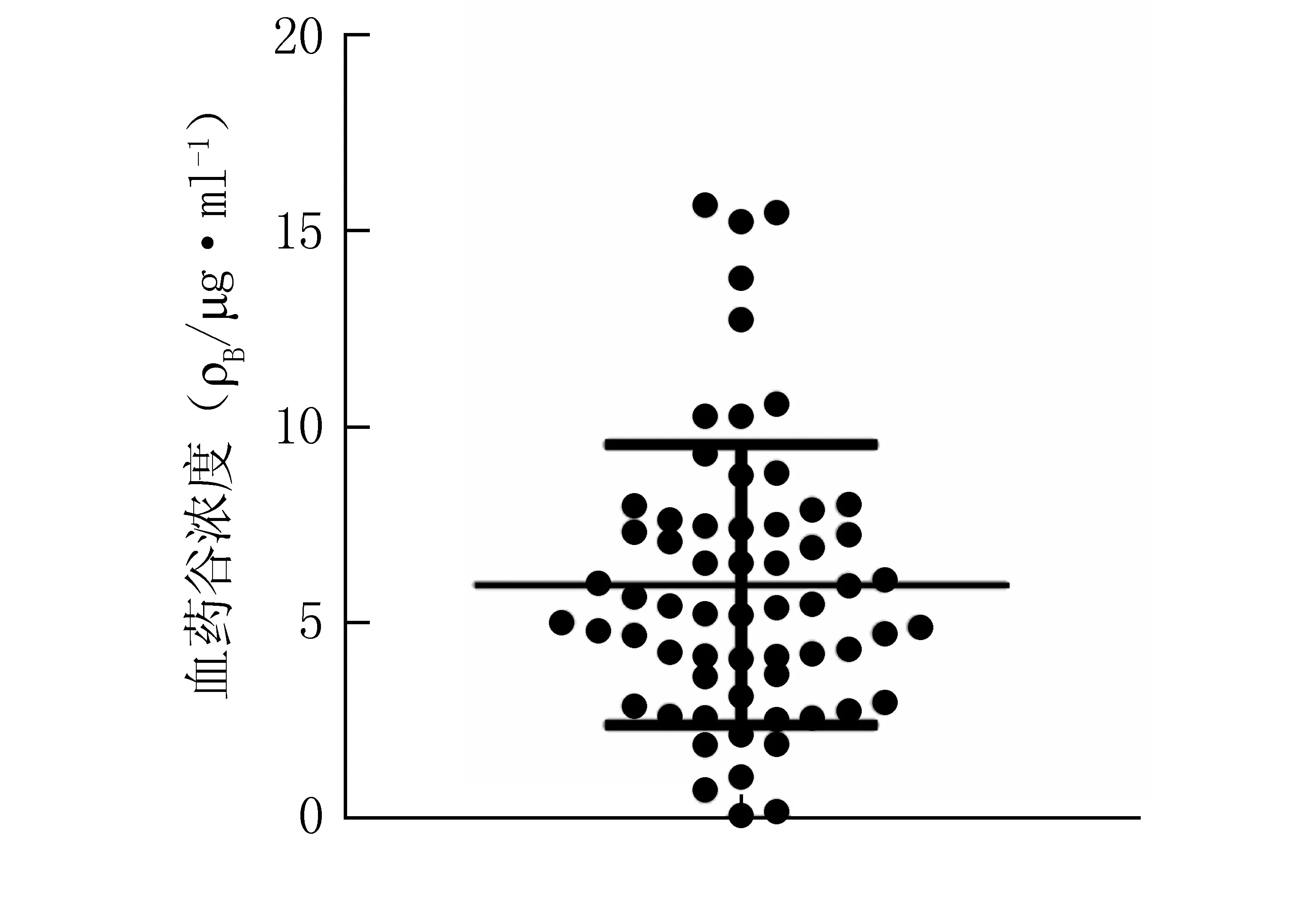
图2 62例患者利奈唑胺 血药谷浓度的散点图aFigure 2 Scatter plot of plasma trough concentrations of linezolid in 62 patientsa a:水平实线表示均值和正负标准差
3 讨 论
本研究建立了UPLC法测定患者血浆中利奈唑胺的浓度,采用1.8 μm小颗粒填料色谱柱,整体分析时间为3.5 min。与传统的HPLC法以及常规色谱柱相比[10],在保证方法特异性的基础上显著缩短了分析时间。以小流速进样,在相同样品量的情况下,大幅度减少了试剂的消耗,节约了成本。同时具有更高的灵敏度和更佳的数据质量。与国内已有的质谱测定方法[7]相比,在相同或相近分析时间下,本方法更加经济、易行,更具有推广的可能性。将该方法应用于临床,为临床提供更加快捷、准确的血药浓度监测技术支持,有利于个体化治疗方案的制订,并且减少实验成本,降低患者经济负担。
根据利奈唑胺的出峰时间和空白血浆的杂质峰影响情况,本研究针对实验室现有的内标物苯妥英钠、喹硫平、奥氮平、利培酮、伊马替尼、替考拉宁、美罗培南等进行选择。由于苯妥英钠出峰时间不受样品峰和杂质峰干扰,且与目标化合物出峰时间接近,可以实现3 min内所有样品和内标出峰完全,达到快速检测的目的,所以本研究选择苯妥英钠作为内标。
对于样品预处理方法,本研究采用液-液萃取的方法,所得标准曲线定量下限达到0.105 1 μg/ml,相比已报道的蛋白沉淀的预处理方法[6],其样品更干净、杂质峰更少、灵敏度更高、重现性更好。在萃取剂选择上,本研究考察了乙酸乙酯、甲基叔丁基醚、乙酸乙酯-异丙醇(9∶1,V∶V)、甲基叔丁基醚-异丙醇(9∶1,V∶V)。比较发现,乙酸乙酯、甲基叔丁基醚在提取过程中挥干时间较短,但提取回收率均<75%,而混合溶剂的提取回收率较高(>75%),但乙酸乙酯-异丙醇(9∶1,V∶V)作为萃取剂时挥干时间过长(>1 h),综合考虑,最终选用甲基叔丁基醚-异丙醇(9∶1,V∶V)作为萃取剂,提取回收率高且预处理时间适宜。这一结论也与李春杏等[10]测定人血清、脑脊液和胰液中利奈唑胺浓度时所采用的样本前处理方法相似。整个预处理过程操作简便、快捷,有利于样品分析通量的提高,适合临床大样本的研究。
血液科患者由于疾病本身造成的免疫缺陷以及放化疗、免疫抑制剂的应用,导致其医院感染的发生率较高。利奈唑胺是首个获得美国FDA批准用于治疗G+球菌特别是耐甲氧西林金黄色葡萄球菌(MRSA)感染的唑烷酮类抗菌药物,可作用于各类耐药G+球菌,与其他抗G+球菌药物相比其最小抑菌浓度更加稳定,目前已广泛应用于血液科患者的抗感染治疗。有文献报道利奈唑胺的药动学过程受肾功能、年龄、体质量和联合用药等的影响[9],利奈唑胺的疗效、血液系统ADRs与其药动学/药效学参数明显相关[11]。本研究中62例血液科患者服用利奈唑胺后的谷浓度变异系数为59.64%,可见其药物浓度在患者中个体差异较大,因而对患者进行利奈唑胺治疗药物监测是有必要的。
本研究采用UPLC法对血液科62例患者服用利奈唑胺后的血浆样本进行测定,考虑到患者临床合并用药较多,对常用的合并用药替考拉宁、伏立康唑、氟康唑、美罗培南、亚胺培南、头孢哌酮钠舒巴坦钠、哌拉西林钠他唑巴坦钠等进行检测,发现本方法中目标化合物的测定未受到其他药物的干扰,表明本研究建立的方法准确可靠、灵敏度高、专属性好,能够对复杂用药环境下的血药浓度进行检测,适用于血液科患者利奈唑胺的常规血药浓度测定。
