丹参酮Ⅱ A 对结肠癌细胞株Caco-2 的作用
2021-01-04唐江锋单丽红柳开忠
唐江锋 单丽红 柳开忠
(中国科学院大学附属肿瘤医院< 浙江省肿瘤医院>< 中国科学院肿瘤与基础医学研究所> 浙江 杭州 310022)
结肠癌是严重威胁人类健康的消化道恶性肿瘤之一,早期不易发现,而多数中晚期患者仍死于复发或转移。部分患者对化疗药物不敏感,且化疗药物不良反应多。因此,充分发挥中医中药作用,积极寻找天然抗肿瘤中药成分成为时下热点。近年来对中药丹参的研究逐渐增多, 丹参有效成分中的丹参酮Ⅱ A(Tanshinone Ⅱ A, Tan Ⅱ A)具有较强的抗肿瘤活性[1],但有关丹参酮Ⅱ A 与结肠癌之间的机制研究尚不多。本文拟采用不同浓度的丹参酮Ⅱ A 体外干预结肠癌细胞株Caco-2,观察其对Caco-2 细胞的作用,并对其相关机制进行初步研究。
1.材料与方法
1.1 主要材料
人结肠癌细胞株Caco-2 购自中国科学院上海细胞库,Tan Ⅱ A 购自中国药物制品检定所,胎牛血清、DMEM 高糖培养基购自Gibco,MTT 购于碧云天生物技术研究,Trizol 试剂盒、RT-PCR 试剂盒购自大连宝生物工程有限公司。
1.2 方法
1.2.1 细胞培养
将人结肠癌Caco2 细胞株培养于DMEM 高糖培养基中,加入10%胎牛血清,置于5% CO2浓度,37℃培养箱中培养。
1.2.2 引物设计
β-actin(F:5’-TGGCACCCAGCACAATGAA-3’;R:5’-CTA AGTCATAGTCCGCCTAGAAGCA-3’)
Smad4(F:5’-GAGAACTITGCCGTTGAAGC-3’;R:5’-CTCAATGTCAAGGGCCATCT-3')
Smad2(F:5’-T T T G C G G A A T A A T C G T G T-3’;R:5’-AAGGTGCTTTAATTGATGAGAC-3’)
1.2.3 MTT 法检测细胞增殖抑制率
收集对数生长期的Caco2 细胞,用0.25%胰酶消化、收集细胞、计数细胞密度,制备成2×104/ml 细胞悬液,接种于96孔板内,每孔加入200mL 细胞悬液,培养24h 后,将其分为 4个实验组,分别加入不同浓度TanⅡ A培养液,使其终浓度为0.3、0.6、1.2、2.4mg/L,另设不加细胞只加等量培养液的对照组。分别作用24h、48h、72h 后,每孔加入新鲜配置的5g/L MTT 溶液20μL,继续37℃孵育4h 后弃上清,再加入150μL DMSO,震荡10min 后,使用酶标测定仪测定吸光度(OD)值,并计算细胞抑制率(%)=(1-实验组OD 值/对照组OD 值)×100%。
1.2.4 RT-PCR
分别收集对照组、Tan Ⅱ A 1.2mg/L 组,Tan Ⅱ A 2.4mg/L组处理72 小时后的Caco-2 细胞,按Trizol 试剂盒说明方法提取细胞总RNA,再根据One Step RT-PCR 试剂盒说明书,按照25 μl 体系,以β-actin 为内参照进行操作。最后观测扩增曲线及溶解曲线,根据2-ΔΔct分析结果。
1.3 统计学方法
本组数据应用SPSS 20.0 统计软件处理, 计量资料数据均以均数±标准差(x±s)表示,各组间比较采用方差分析, P<0.05 具有统计学意义。
2.结果
2.1 MTT 法测定Tan Ⅱ A 对Caco-2 增殖抑制率的影响
不同浓度的Tan Ⅱ A 对Caco-2 细胞增殖抑制率的影响,见表1。不同药物浓度组与对照组之间的细胞增殖抑制率均有统计学差异(P <0.05),同一药物浓度组以72 小时抑制率最高。而同样作用72 小时,以2.4mg/L 组抑制率最高,见表1。
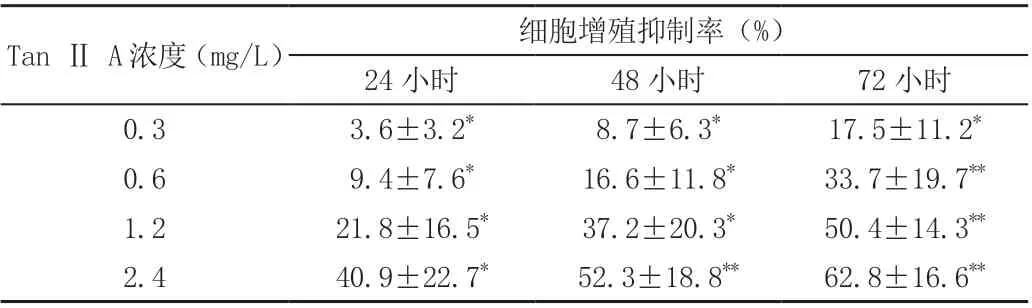
表1 Tan II A 对Caco-2 增殖抑制率的影响
2.2 Tan Ⅱ A 对Caco-2 Smad4 和Smad2 mRNA 表达的影响
利用RT-PCR技术检测Smad4和Smad2 mRNA表达情况,见图1。与对照组相比,Tan Ⅱ A 1.2mg/L 和2.4mg/L 实验组Smad4、Smad2 mRNA 表达明显增多(P <0.01)。
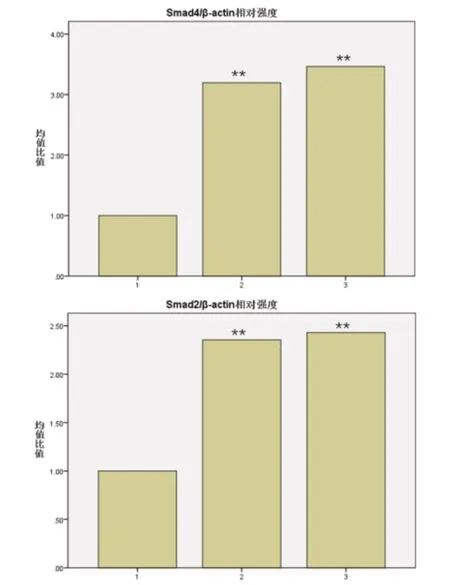
图1 TanII A 干预Caco-2 细胞72 小时后Smad4 mRNA、Smad2 mRNA 的RT-PCR结果
3.讨论
结肠癌是常见的消化道恶性肿瘤之一,其发生发展是一个多步骤、多阶段的过程,早期症状不明显,许多病人发现时已属中晚期,即使是结肠癌早期患者接受了根治性手术及辅助治疗,也仍有约半数术后患者死于复发和转移[2]。
Smad 蛋白家族是转化生长因子β(transforming growth factor beta,TGF-β)家族的重要下游信号分子,在信号转导、调节靶基因的转录过程中发挥着重要的作用。Smad 蛋白根据结构和功能的不同分为受体激活型Smads、共同介导型Smads 及抑制型Smads。Smad2 属于受体激活型Smad 蛋白,可被TGF-β的I 型丝氨酸-苏氨酸激酶受体磷酸化,随后与共同介导型的Smad4 蛋白形成异源性多聚体,并进入核内与DNA 特异性短序列SBE-Smads 结合,激活DNA 转录,调节靶蛋白的表达[3]。其中Smad4 基因位于人染色体18q21,是首先在胰腺癌中发现的抑癌基因,其所编码的Smad4 蛋白是TGF-β/Smad 信号通路的中心分子,在信号转导、调节靶基因的转录过程中发挥重要的作用,所有生物学效应都是不同类型Smads 蛋白与Smad4 相互作用的结果[4]。有研究[5]发现约1/3的结肠癌患者存在Smad4缺失或突变,而结肠癌患者中也常有Smad2 基因的失活,而这种突变、缺失和失活与结肠癌的恶化及侵袭转移密切相关,且Smad2、Smad4 蛋白低表达的结肠癌患者往往不良预后[6]。
丹参酮Ⅱ A 是从中药丹参中提取的脂溶性有效成分,其不仅具有抗炎,抗氧化和抗纤维化的作用,还具有抗肿瘤的作用。近年来的研究发现,丹参酮ⅡA 具有诱导肿瘤细胞分化和凋亡的作用,并可通过细胞毒作用抑制肿瘤细胞的增殖[7]。本研究发现丹参酮Ⅱ A 能抑制结肠癌Caco-2 细胞增殖,同一药物浓度组作用24、48、72 小时后,以72 小时抑制率最高。进一步的PCR分析发现丹参酮Ⅱ A 实验组Smad2、Smad4 mRNA 表达较对照组显著升高。这些结果提示丹参酮Ⅱ A 能抑制结肠癌细胞Caco-2增殖生长,其机制可能是通过调节Smad2、Smad4 表达进而达到抑制肿瘤的目的。
综上所述,丹参酮Ⅱ A 能够抑制结肠癌细胞株Caco-2 的增殖,其机制可能与丹参酮Ⅱ A 上调Smad2、Smad4 表达有关,为中医中药治疗结肠癌提供新思路。
