挂树预贮对‘徐香’猕猴桃采后耐贮性和冷敏性的影响
2020-12-31舒雪瑶饶景萍
屈 魏,高 萌,冉 昪,李 欢,舒雪瑶,饶景萍*
(西北农林科技大学园艺学院,陕西 杨凌 712100)
猕猴桃因富含维生素、矿物质、膳食纤维等而被誉为营养成分最突出的水果之一[1]。近年来随着生活水平的提高,猕猴桃已成为人们日常餐桌必备水果之一,亚洲新兴市场已经形成[2];但存在采收期集中、市场压力大的突出问题。采收期对猕猴桃的贮藏性有很大的影响。猕猴桃果实采收成熟度低不仅影响其品质,也会导致其冷敏性高,易发生冷害;而采收过晚,果实易软化,导致贮藏期、货架期均变短。猕猴桃属呼吸跃变型果实,采收后易软化,营养损耗快[3],低温能有效延长其贮藏期,但猕猴桃为冷敏性果实,低温条件下很容易诱发冷害,造成出库后大量腐烂变质[4]。挂树预贮作为一种新兴贮藏方式,已经在石榴[5]、葡萄[6]、柑橘[7]等水果上成功地应用。与常规采收相比,适当地延迟采收既可以减轻集中上市带来的运输等压力,又能很好地调节鲜果的供应期,重要的是可以降低果实的冷敏性,是一项很有实践应用价值的技术[8]。而挂树预贮对猕猴桃采后品质以及耐贮性、冷敏性的影响目前尚不清楚。本实验选用秦岭北麓产区的主栽品种‘徐香’果实为材料,通过不同时间的挂树预贮,比较其采后生理、品质变化及冷敏性特点,探讨挂树预贮对猕猴桃果实的耐贮性和耐冷性的影响,以期为延长猕猴桃果实采收期和上市期、降低采后损失提供有效参考。
1 材料与方法
1.1 材料与试剂
‘徐香’果实采自陕西省周至县广济镇一管理良好的果园,对照组果实(可溶性固形物质量分数(soluble solid content,SSC)6.5%~7.5%)采于2018年10月10日,随后每隔7 d采果一次。均在采收后2 h内运回西北农林科技大学园艺学院采后实验室,散去田间热。挑选大小均匀、果形端正、色泽相近、无病虫害及机械损伤、成熟度相对一致的果实作为试材。
甘露醇 深圳市鑫科化实验仪器有限公司;三氯乙酸 上海山浦化工有限公司;乙二胺四乙酸、乙酰水杨酸、碘化钾、柠檬酸、柠檬酸钠、淀粉 广东光华科技股份有限公司;核黄素 北京奥博星生物科技有限公司;3,5-二硝基水杨酸 上海鼓臣生物技术有限公司。
1.2 仪器与设备
3K15 型高速冷冻离心机 美国Sigma公司;PAL-1手持式糖度计、PAL-ACID水果酸度计 日本Atago公司;7001型CO2分析仪 美国Telaire公司;UV-1800型紫外-可见分光光度计 安徽科大中佳公司;BCD-236DT型冰箱 青岛海尔股份有限公司;Trace GC Ultra型气相色谱仪 美国Thermo Scientific公司;DDS-320电导率仪 上海康仪公司;GY-4型硬度计 杭州绿博公司;CR-400型色差仪 日本Konica Minolta公司。
1.3 方法
1.3.1 样品处理
以不同的挂树预贮时间作为不同的处理,分别记为处理I、II、III、IV(具体见表1)。每个处理设置3 个重复,每个重复取44 kg果实。于采收当天从各处理的每个重复中随机取20 个果实测定干物质质量分数,其余果实入(0.0±0.5)℃、相对湿度(90±5)%的冷库贮藏。贮藏过程中从第0天起,每隔10 d取样。在冷库中直接测定呼吸速率和乙烯释放速率(每个重复随机取15 个果实),取样出冷库后进行硬度、果肉亮度、可滴定酸质量分数、相对膜透性的测定,并用液氮速冻留样保存于-80 ℃的超低温冰箱中用于后续淀粉质量分数、淀粉酶活力、丙二醛含量、超氧化物歧化酶(superoxide dismutase,SOD)及过氧化氢酶(catalase,CAT)活力的测定;同时,每重复取30 个果实移至20 ℃室温条件下,放置5 d后统计其冷害指数并拍照观察。在冷库中各重复另固定100 个果实,待处理组果实和对照组果实的硬度平均降至20 N/cm2左右时出库,统计其冷害率、质量损失率、腐烂率、VC含量,出库后在20 ℃室温条件下放置,每天测定记录硬度,并统计硬度降至7.84~9.80 N/cm2的时间,即货架期,货架期结束时(可食用状态下)测定SSC含量并进行感官评价。

表1 果实样品采收及处理设置Table 1 Fruit harvest and treatment settings
1.3.2 果实相关指标的测定
1.3.2.1 品质指标的测定
干物质质量分数采用烘干法测定;SSC使用手持式糖度计测定;可滴定酸质量分数用水果酸度计测定;果实肉色泽用色差仪测定,将果实沿赤道横切后测果肉L*值,L*值代表果实肉亮度,能反映果实褐变及成熟衰老情况[9]。VC含量的测定参照李军[10]的钼蓝比色法,结果以每100 g鲜质量中还原型VC质量表示,单位为mg/100 g;淀粉酶活力的测定参照Bonghi等[11]的方法,淀粉质量分数的测定参照曹建康等[12]的方法。感官评价为不同时期采收的果实实出库后,常温下后熟至硬度适宜食用状态时,小组成员(由9 人固定组成)按照表2对外观、口感、风味、质地进行感官评价打分,比较出不同采收期的果实实在食用品质方面的差异。评价时,每个处理取18 个猕猴桃,切开后随机放于编码的白色盘内,每人一份。
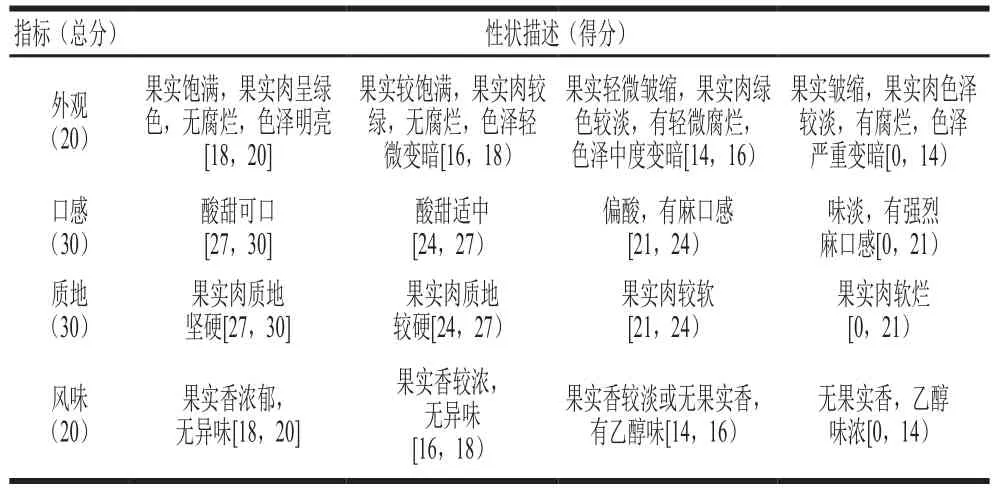
表2 猕猴桃感官评价标准Table 2 Criteria for sensory evaluation of kiwifruit
1.3.2.2 贮藏性指标测定
果肉硬度用硬度计测定。质量损失率参照王玮[13]的方法测定,腐烂率参考胡苗等[14]的方法测定,质量损失率和腐烂率的具体计算分别见公式(1)、(2)。

呼吸速率和乙烯释放速率的测定参照董晓庆等[15]的方法,分别使用CO2分析仪和气相色谱仪测定,单位分别为mg/(kg·h)和μL/(kg·h)。
1.3.2.3 冷害及抗氧化指标测定
冷害指数的测定参照马秋诗等[16]的方法,冷害率的计算具体见式(3)。

相对膜透性参照姚丹等[17]的方法,使用电导率仪测定;丙二醛含量及超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活力的测定参照曹建康等[12]的方法,以每分钟每克果肉反应体系对氮蓝四唑光化还原的抑制达50%为1 个SOD活力单位(U),单位为U/(g·min);以每克果肉1 min内OD240nm值变化0.01为1 个CAT活力单位,单位为U/(g·min)。
1.4 数据统计分析
采用Excel 2010软件进行数据处理,结果以平均值±标准差表示。用SigmaPlot 12.5软件制图,用SPSS 20.0软件的单因素方差分析进行显著性比较,P<0.05表示差异显著。
2 结果与分析
2.1 挂树预贮对‘徐香’果实干物质质量分数和果肉亮度的影响

图1 挂树预贮对猕猴桃果实干物质质量分数(A)和L*值(B)的影响Fig.1 Effect of tree-hanging pre-storage on dry matter content (A)and L* value (B) of kiwifruit
如图1A所示,采收当天处理I~IV组比对照组果实干物质质量分数分别高2.06%、3.15%、4.16%、4.69%,但对照组与各处理组间无显著性差异(P>0.05)。表明猕猴桃成熟后,干物质质量分数不会随着挂树时间的延长而显著变化。L*值的下降程度可以直观地反映果实在贮藏过程中由于色素聚集或是酶促褐变所引起的果实肉变暗的程度,L*值越低,代表褐变越严重,果实衰老进程越快[16]。图1B中,采收时对照组和处理I组的亮度显著高于处理II、III、IV组(P<0.05)。在0 ℃冷藏期间果实肉亮度变化表现为前中期亮度快速下降,到后期趋于缓慢,且对照组和I组亮度差异不大。在整个贮藏过程中,处理IV组的亮度均显著低于其他组(P<0.05),至70 d时比对照组低5.5%。这表明挂树预贮时间过长,易造成猕猴桃果肉变暗。
2.2 挂树预贮对猕猴桃果实硬度和SSC的影响
果实的硬度和SSC不仅是果实的品质指标,同时也是反映其耐贮性的重要指标[14]。由图2A可知,果实采收时间越晚,果实硬度越小。冷藏期间果实硬度均呈倒S型下降趋势,即前期启动阶段软化缓慢,中期快速软化,后期又趋于缓慢。处理组果实表现为挂树时间越长,快速软化出现时间越早,软化速率越快。从入库到硬度降至20 N/cm2,处理I组果实贮藏了100 d,而处理II、III、IV的贮藏期分别为90、80、70 d,且贮至70 d时,对照组果实硬度显著高于各处理组(P<0.05)。这说明适度挂树预贮可保持较长贮藏期,过度挂树则会很大程度地缩短贮藏期。

图2 挂树预贮对猕猴桃果实冷藏过程中硬度(A)和可食用状态下SSC(B)的影响Fig.2 Effect of tree-hanging pre-storage on hardness (A) and soluble solid content (B) of kiwifruit
SSC能直接反映果实的成熟度和品质状况,果实成熟过程中随着淀粉等大分子物质的降解,SSC逐渐增加,各处理组猕猴桃采收时SSC如表1所示。与对照组相比,各处理组的SSC均明显增加。在贮藏前期,果实SSC均迅速上升,到后期变化趋于缓慢直至稳定。对照组果实的SSC达到稳定所用时间最长,挂树越长的果实越早达到稳定。图2B为可食硬度下不同挂树期果实的SSC比较,对照组与其他处理组差异不显著(P<0.05),各处理组之间差异也不明显。这说明猕猴桃后熟后SSC达到的稳定值不会因挂树时间的不同而发生明显变化。
2.3 挂树预贮对猕猴桃果实可滴定酸质量分数和VC含量的影响
可滴定酸是果实风味构成的重要物质之一。如图3A所示,采收和贮藏过程中各处理组的可滴定酸质量分数显著低于对照组,且挂树时间越长其果实可滴定酸质量分数越低,贮藏70 d时,处理I、II组间无显著性差异,但显著高于处理III、IV组(P<0.05)。
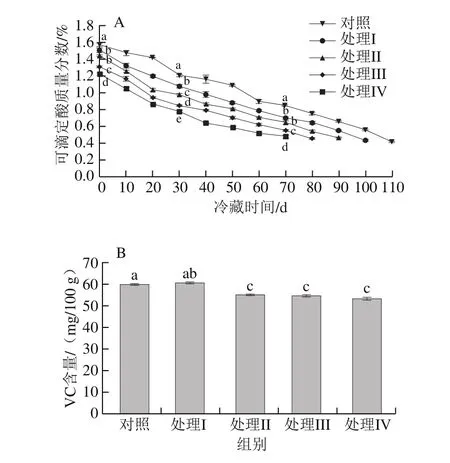
图3 挂树预贮对猕猴桃果实冷藏过程中可滴定酸质量分数(A)和出库时VC含量(B)的影响Fig.3 Effect of tree-hanging pre-storage on titratable acid content (A)during storage and ascorbic acid content (B) at the end of storage of kiwifruit
图3B为不同挂树果实在出库时的VC含量比较,对照及处理I~IV组猕猴桃果实的VC含量分别为59.72、60.57、54.94、54.61、53.13 mg/100 g,此时处理I组的VC含量显著高于其他处理组(P<0.05),但与对照组无显著差异,处理II、III、IV组之间无显著差异,说明适当挂树预贮(处理I)有利于猕猴桃果实营养物质的保持。
2.4 挂树预贮对猕猴桃果实淀粉质量分数和淀粉酶活力的影响
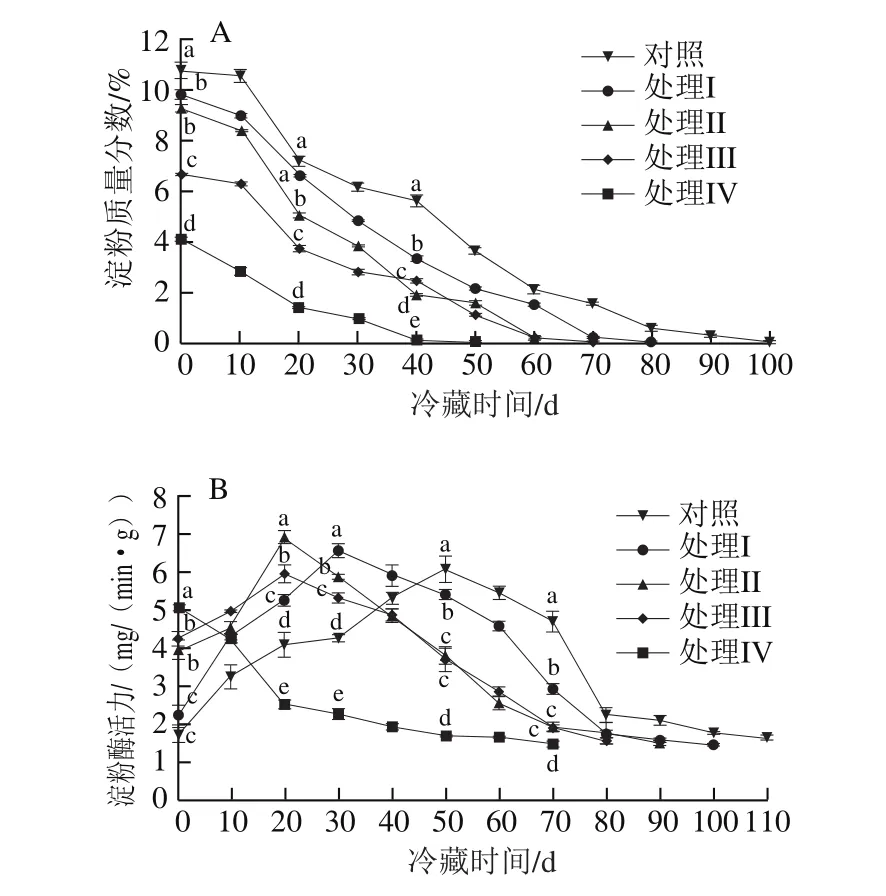
图4 挂树预贮对猕猴桃果实冷藏过程中淀粉质量分数(A)和淀粉酶活力(B)的影响Fig.4 Effect of tree-hanging pre-storage on starch content (A) and amylase activity (B) of kiwifruit
未成熟果实中存在大量的淀粉,在果实成熟过程中淀粉在淀粉酶作用下逐渐转化成可溶性糖。如图4A所示,采收时对照组果实淀粉质量分数最高,处理IV组淀粉质量分数最低。对照组和处理组淀粉质量分数均在贮藏前期迅速下降,对照组与处理I~IV组果实淀粉完全降解所用时间分别为100、80、70、70、50 d,表现为挂树期越长淀粉完全降解所用时间越短。
由图4B可知,对照组的淀粉酶在贮藏50 d时出现活力高峰,各处理组的淀粉酶活力峰值均较对照组提前,特别是处理IV组淀粉酶活力在贮藏0 d时最高。处理I、II组的淀粉酶活力峰均高于对照组,但仅处理II组与对照组差异显著(P<0.05)。
2.5 挂树预贮对猕猴桃果实呼吸速率和乙烯释放速率的影响

图5 挂树预贮对猕猴挑果实冷藏过程中呼吸速率(A)和乙烯释放速率(B)的影响Fig.5 of tree-hanging pre-storage on respiration rate (A) and ethylene release rate (B) of kiwifruit
猕猴桃为呼吸跃变型果实,呼吸作用是其采收后重要的生理活动。如图5A所示,对照组和处理组果实在贮藏过程中均呈现出明显的呼吸高峰,但呼吸峰出现的时间不同,对照组的呼吸峰出现最晚,在贮藏40 d时出现,且呼吸峰值最大;与对照组相比,各处理组的呼吸峰出现时间提前,但呼吸峰值降低。对于处理组I~III,采收越晚(挂树期越长),猕猴桃果实的呼吸峰值出现越早,峰值越低,处理IV组果实呼吸峰值出现时间和峰值几乎与处理III组一致。综上说明挂树预贮可降低呼吸强度。乙烯是致熟激素,它促进果实的后熟衰老进程。各采收期果实乙烯释放速率如图5B所示,对照组和处理组的乙烯高峰出现时间与呼吸速率几乎一致,即各挂树预贮处理的猕猴桃果实乙烯释放高峰均提前,且峰值均低于对照组峰值,仅处理IV组的乙烯释放峰组与对照组达到显著性差异(P<0.05)。
2.6 挂树预贮对猕猴桃果实质量损失率和腐烂率的影响

图6 挂树预贮对猕猴桃果实出库时质量损失率(A)和腐烂率(B)的影响Fig.6 Effect of tree-hanging pre-storage on mass loss rate (A) and decay incidence (B) of kiwifruit
果实采后在(0.0±0.5)℃贮藏过程中质量不断减少,出库时的质量损失率如图6A所示,对照组与处理I~IV组的质量损失率分别为2.47%、1.75%、1.46%、1.26%、1.13%。对照组的质量损失率显著高于各处理组,各处理组间,处理I、II组又显著高于处理III、IV组(P<0.05)。果实出库时腐烂率如图6B所示,对照组与处理I~IV组的腐烂率依次为12.67%、10.67%、9.33%、18.33%、17.00%。处理III、IV组的腐烂率最高,处理I、II组腐烂率显著低于对照组和其他处理组,且这两组间无显著差异(P>0.05),这说明适当挂树预贮既有利于保持猕猴桃果实的质量,又可以降低其腐烂率。
2.7 挂树预贮对猕猴桃果实货架期和感官得分的影响
延长货架期或调整果实上市时间是延迟采收的重要目的之一。果实的货架期如图7A所示,对照组与处理I~IV组的货架时间依次为9、8、7、6、6 d。对照组与处理I组之间的货架时间无显著性差异,但均显著长于其他3 个处理组(P<0.05)。感官评价是对出库后,后熟达到食用品质的猕猴桃果实进行外观、口感、质地和风味等品质进行鉴定打分,比较出不同采收期的果实在食用品质方面的差异,结果如图7B所示。处理I组和对照组果实的感官评分最高,二者无显著性差异,均显著高于处理II、III、IV组(P<0.05),说明与其他预贮处理相比,处理I有利于保持猕猴桃果实的整体口感和风味。

图7 挂树预贮对猕猴挑果实货架期时间(A)和可食用状态下感官得分(B)的影响Fig.7 Effect of tree-hanging pre-storage on shelf life (A) and sensory evaluation score (B) of kiwifruit
2.8 挂树预贮对猕猴桃果实冷害的影响

图8 0 ℃贮藏70 d后于室温后熟5 d的猕猴桃果肉组织Fig.8 Symptoms of chilling injury in pulp tissue of control and treated kiwifruits stored at 0 ℃ for 70 days and then post-ripened at 20 ℃ for 5 days
猕猴桃果实的冷害症状在低温贮藏期间不明显,在室温模拟货架期时,冷害症状开始逐渐显现[16],本实验猕猴桃冷害症状与其相符。由图8可以看出,猕猴桃果实冷害主要表现为皮下果实肉组织呈现出水渍状斑块(如箭头所指),并伴随着轻微的木质化和褐化。处理II、III、IV组果实经过0 ℃贮藏70 d后果实肉水渍化面积明显大于处理I组,并出现出较明显的木质化和褐化,而处理I组果实的上述冷害症状在相同的冷藏时间下最轻。

图9 挂树预贮对猕猴桃果实冷害指数(A)和出库时冷害率(B)的影响Fig.9 Effect of tree-hanging pre-storage on chilling injury index (A)and chilling injury rate (B) of kiwifruit
图9A为在0 ℃贮藏不同时间后于20 ℃条件下放置5 d时猕猴桃果实的冷害指数,对照组和处理I组在60 d时才出现冷害,此时处理I组的冷害指数显著低于其他处理组(P<0.05),其余处理表现为挂树时间越长,果实在0 ℃贮藏时冷害出现时间越早,冷害指数也越高。在整个冷藏过程中,处理I组的冷害指数始终低于对照组及其他处理组。由图9B可知,出库时,对照组及各处理组的冷害率依次为16%、11.66%、24.11%、35%、42.5%。处理I组的冷害率显著低于对照组及其他各处理组(P<0.05)(图8B)。由此可见,适当挂树预贮(处理I)有利于减轻猕猴桃果实的冷害,过度晚采会加重冷害,且采收时间越晚,冷害越严重。
2.9 挂树预贮对猕猴桃果实冷藏过程中相对膜透性和丙二醛含量的影响
如图10所示,猕猴桃果实相对细胞膜透性与丙二醛含量均随着贮藏时间延长而上升。在贮藏前期,对照组及各处理组间相对膜透性和丙二醛含量差异不大,贮藏50 d时各处理组间出现显著差异(P<0.05),此后处理I组的相对膜透性和丙二醛含量最低(P<0.05)。处理IV组达到出库硬度时(70 d),处理I组的相对细胞膜透性较对照组和处理II、III、IV组分别低10.02%、22.14%、32.70%、37.22%,丙二醛含量分别低8.19%、20.13%、26.37%、31.43%。结果表明,适当挂树预贮(处理I)有利于降低猕猴桃果实的相对膜透性和丙二醛含量,而过度晚采会提高相对膜透性并加速丙二醛的积累。
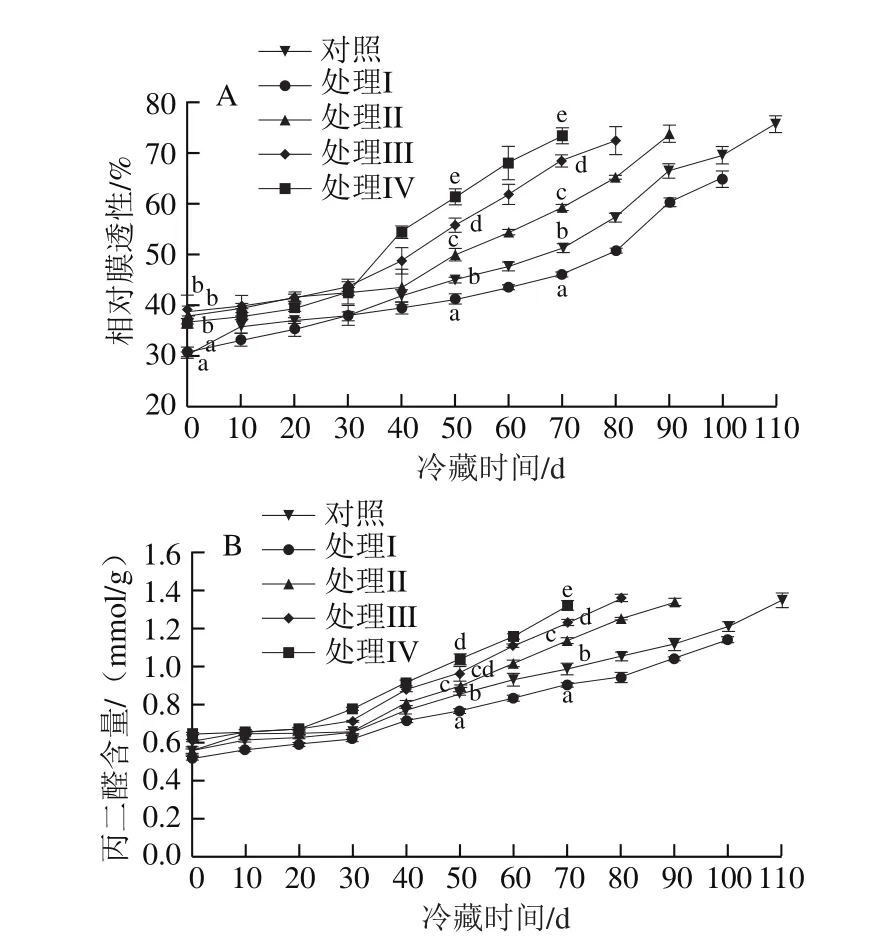
图10 挂树预贮对猕猴桃果实冷藏过程中相对膜透性(A)和丙二醛含量(B)的影响Fig.10 Effect of tree-hanging pre-storage on relative membrane permeability (A) and malondialdehyde content (B) of kiwifruit
2.10 挂树预贮对猕猴桃果实冷藏过程中SOD和CAT活力的影响
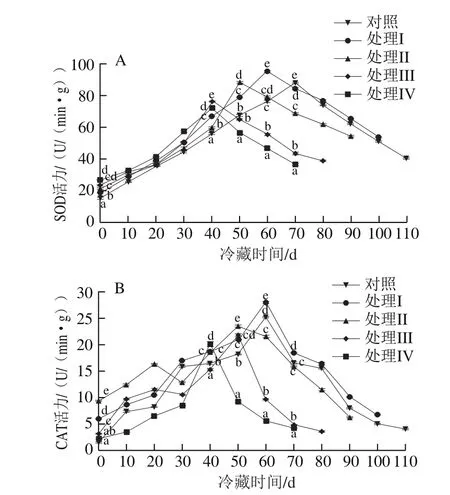
图11 挂树预贮对猕猴桃果实冷藏过程中SOD(A)和CAT(B)活力的影响Fig.11 Effect of tree-hanging pre-storage on SOD (A) and CAT (B)activities of kiwifruit
从图11A可以看出,处理组与对照组果实在贮藏期间SOD活力的变化趋势一致,刚入冷库时SOD活力处于较低水平,且各组差异不大,之后呈迅速上升的趋势。但相比对照组,处理组果实达到SOD活力峰值的时间更短,并且采收越晚,SOD活力高峰出现的时间越早。对照组果实SOD活力在贮藏70 d时达到高峰,处理I~IV组分别在60、50、40、40 d时达到SOD活力高峰。处理I组的SOD活力高峰显著高于对照组及其他处理组(P<0.05)。图11B显示,猕猴桃果实的CAT活力在开始时较低,随着贮藏时间的延长,CAT活力逐渐降低,处理I组和对照组果实在贮藏的第60天CAT活力均达到高峰,其他处理组的果实CAT活力分别在50 d(处理II和III组)和40 d(处理IV组)达到高峰,之后又下降,处理I组的CAT活力峰值高于对照组及其他处理组,并且差异显著(P<0.05)。
3 讨 论
本实验以正常采收期的猕猴桃果实作为对照组,以不同的挂树预贮时间作为不同的处理,探究挂树预贮对猕猴桃果实的耐贮性和冷敏性的影响。硬度的保持可以降低果实软化率、延长贮藏期[18]。冷藏过程中对照组及处理I组的果实与其他处理组相比,硬度一直较高。故处理I有效保持了果实较长的贮藏期,减缓了果实的软化腐烂。淀粉酶催化淀粉水解,淀粉的降解是猕猴桃果实软化的主要原因之一[19]。对照组及处理I组的淀粉酶活力在采收时(贮藏0 d)低于其他处理组,并且峰值出现的时间也晚于其他处理组,与其他处理相比,对照和处理I组减缓了淀粉的降解,延缓了果实的软化。研究表明,在低温贮藏条件下,猕猴桃果实软化衰老伴随着果实硬度和果肉亮度的下降、质量损失率和腐烂率的上升,以及呼吸高峰和乙烯释放高峰的出现[20-23]。处理I组虽然挂树预贮1 周,但其仍能在0 ℃条件下贮藏100 d,并且其出库时的腐烂率显著低于对照组及处理III、IV组,感官得分及货架期与对照组无显著性差异。表明适当晚采(SSC介于7.5%~8.0%)可以较好地保持猕猴桃果实的耐贮性和品质,有利于降低其采收期和上市集中的压力,而过度晚采耐贮性和品质都会显著下降。
冷敏型植物在低温胁迫下,细胞膜结构最先损伤,随着膜功能丧失活性氧代谢失调,启动膜脂过氧化,生成丙二醛,进一步加剧冷害[24]。相对细胞膜透性和丙二醛含量的高低能反映逆境条件下细胞膜损伤程度。本实验中,处理I组猕猴桃果实的相对细胞膜透性和丙二醛含量最低,说明冷害使其膜结构受损程度较轻,膜脂过氧化程度低于对照组及其他处理组,进而抗冷能力更高。冷敏植物在低温胁迫下,呼吸速率的提高可能预示着冷害即将发生,且冷害发生前期伴随着大量乙烯生成[25]。本实验中冷害出现较早的处理组(III、IV)的呼吸速率高峰出现时间均早于对照组,这可视为冷刺激诱导的自我保护反应[26],处理I组虽然呼吸峰出现时间早于对照组,但其冷害出现时间与对照组相同,且出库时冷害率最低,说明处理I组果实的抗逆性强,这是多个保护机制共同协调的结果。研究表明,衰老的猕猴桃伴随着自由基水平的升高[27],SOD和CAT作为植物体内两种极为重要的抗氧化酶,它们与过氧化物酶、抗坏血酸过氧化物酶等协同作用,来防御活性氧、过氧化氢或过氧化物自由基对细胞膜系统的伤害,从而减少自由基对有机体的伤害。本实验中,处理I组的SOD、CAT活力在中期和后期明显高于对照组及其他处理组,说明挂树预贮7 d能抑制猕猴桃果实的膜脂过氧化,从而减轻冷害的发生。可溶性固形物能通过调节细胞渗透势降低冰点,提高果实耐冷性[28],其中糖分代谢除了供能还参与胁迫下活性氧清除的信号传导和基因调控,诱导果实抗性[29]。处理I组猕猴桃采摘时的SSC介于7.5%~8.0%,高于对照组,故其抗冷性也明显强于对照组。处理II、III、IV组的抗冷性弱于对照组、处理I组,可能与果实的衰老有关。本研究表明果实的抗冷性不仅与SSC有关,而且还与果实细胞的衰老程度有关,果实的衰老程度越高,其细胞内的抗氧化酶等抗逆系统的功能也越弱。在果实完成挂树后熟的前期,SSC为影响其抗冷性强弱的主要因素,而随着挂树时间的延长,果实的衰老程度成为影响其抗冷性的主要影响因素,故适当晚采可以延缓猕猴桃果实冷害的发生,而过度晚采则会加重其冷害。
综上所述,猕猴桃在0 ℃冷藏,处理I(SSC介于7.5%~8.0%时采收)可以在降低果实出库时质量损失率和腐烂率的同时,保持较长的货架期;其相对细胞膜透性和丙二醛含量在冷藏中后期最低,SOD、CAT活力在中期和后期显著高于对照组及其他处理组,出库时冷害率也最低,故处理I可以有效延缓果实冷害的发生。在品质方面,挂树预贮可以提高猕猴桃果实SSC,降低可滴定酸质量分数,提高淀粉降解速率。其中处理I组在冷藏过程中具有较高的果肉亮度,在出库时具有较高的VC含量,在可食用状态下感官评分较高。可见处理I(挂树预贮7 d)在保持果实较好的耐贮性和品质的同时也降低了其冷敏性,可以为生产提供参考,而挂树预贮期过长,不仅缩短果实贮藏期、货架期,降低品质,还会提高其冷敏性。
