苯乳酸和醋酸联用对单核细胞增生李斯特菌的协同抑菌机理
2020-12-31宁亚维付浴男何建卓侯琳琳王志新贾英民
宁亚维,付浴男,何建卓,苏 丹,侯琳琳,王志新,贾英民*
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.北京工商大学食品与健康学院,北京 100048)
单核细胞增生李斯特菌是一种革兰氏阳性杆状细菌,广泛存在于熟食肉类、软奶酪、牛奶和其他乳制品中[1],能引发食源性疾病,包括败血症、流产、中枢神经系统功能障碍和胃肠炎等[2]。例如在美国,单核细胞增生李斯特菌每年导致约1 600 例疾病[3];仅2015年欧洲28 个成员国由单核细胞增生李斯特菌导致的疾病就有2 206 例[4]。此外,单核细胞增生李斯特菌能够在食品加工环境如冷藏、高盐、高pH值环境中长期存在[5-7],甚至黏附在食品加工设备的表面,形成难以去除的生物膜[8]。因此,有必要研究抑制食品中单核细胞增生李斯特菌的生长以提高食品的安全性。
苯乳酸是近年来发现的一种新型抑菌物质[9],具有广谱抑菌活性,不仅对金黄色葡萄球菌[10]、肠道沙门氏菌[11]、埃希氏菌、单核细胞增生李斯特菌[12]等多种革兰氏阳性菌和革兰氏阴性菌有抑制作用,对青霉、黑曲霉、黄曲霉等真菌以及滑念珠菌、胶红酵母等酵母同样有良好的抑制作用[13-14]。此外,苯乳酸对细胞和动物无毒[15-16]。因此,苯乳酸具有较高的应用潜力。
苯乳酸对单核细胞增生李斯特菌具有较好的抑菌特性,其相关抑菌特性研究主要针对苯乳酸单独使用的抑菌机理。Dieuleveux等[10,17]率先报道了苯乳酸对单核细胞增生李斯特菌的抑菌活性,并发现细胞壁为苯乳酸的抑菌靶位;本课题组前期研究发现苯乳酸对单核细胞增生李斯特菌的细胞膜和DNA均产生破坏作用[12];Sorrentino等[18]发现苯乳酸对单核细胞增生李斯特菌的抑菌靶位主要在细胞表面和细胞质膜中,从而导致细胞结构破裂。本课题组前期通过研究苯乳酸与防腐剂联用的抑菌效果,发现苯乳酸与苯甲酸钠、山梨酸钾等常用防腐剂联用对大肠杆菌具有协同抑菌效应,然而其与苯甲酸钠、山梨酸钾、对羟基苯甲酸乙酯、乳酸链球菌素、聚赖氨酸等多种防腐剂联用对单核细胞增生李斯特菌均不产生协同效应[19]。后续本课题组经过扩大联合抑菌剂筛选范围,发现醋酸与苯乳酸联用可以增强其抑菌活性,该发现与Rodríguez等[11]报道的苯乳酸与有机酸共存时能增强其抑菌活性的结果一致。然而具体的联合抑菌效应及机制尚鲜有报道。由于醋酸来源广泛、经济易得,不仅可以作为酸度调节剂使用,还可作为防腐剂添加到食品中,在食品体系中具有较好的应用价值。因此,本研究考察了苯乳酸和醋酸联用对单核细胞增生李斯特菌的抑菌机制,以期为苯乳酸在食品防腐中的应用提供理论依据。
1 材料与方法
1.1 菌株、材料与试剂
单核细胞增生李斯特菌Listeria monocytogenes10403S由河北科技大学食品与生物技术安全实验室保藏;苯乳酸、DiSC3(5) 美国Sigma公司;LIVE/DEAD试剂盒美国Thermo Fisher Scientific公司;Minibest细菌基因组DNA提取试剂盒 日本Takara公司;其他试剂均为国产分析纯。
1.2 仪器与设备
F-7000-FL 220荧光分光光度计、S-4800-I扫描电子显微镜(scanning electron microscope,SEM) 日本日立公司;Accuri C6 plus流式细胞仪 美国Becton Dickinson公司;BX53荧光显微镜 日本奥林巴斯株式会社;Evolution 220紫外分光光度计 美国Thermo Fisher Scientific公司;Gel DocTMXR+凝胶成像系统 美国Bio-Rad公司。
1.3 方法
1.3.1 最小抑菌浓度及联合抑菌指数的测定
苯乳酸和醋酸的最小抑菌浓度(minimum inhibitory concentration,MIC)使用肉汤微量二倍稀释法测定。取培养至对数期的单核细胞增生李斯特菌,调整细菌浓度为1×106CFU/mL备用。在96 孔板第一列分别加入20 mg/mL的苯乳酸和醋酸,再用营养肉汤在第2~10列进行系列梯度稀释。然后在每个孔注入100 μL的菌液。第11列不加抑菌剂,只加100 μL营养肉汤及100 μL菌液,第12列只加200 μL 营养肉汤作阴性对照。之后于37 ℃恒温培养箱培养24 h后通过酶标仪测定吸光度,以细菌被抑制的最低抑菌剂浓度作为MIC。
根据Fratini等[20]的方法测定苯乳酸与醋酸部分抑菌浓度指数(fractional inhibitory concentration index,FICI)。制备质量浓度范围为1/8~4 MIC的苯乳酸和醋酸二倍稀释菌液备用。然后,将100 μL的苯乳酸以水平方向添加到96 孔板中,并将相同量的醋酸以垂直方向添加到96 孔板中。最后将每孔含有不同质量浓度的试剂与100 μL细菌培养液(106CFU/mL)混合,并在37 ℃下培养24 h。按下式计算FICI。
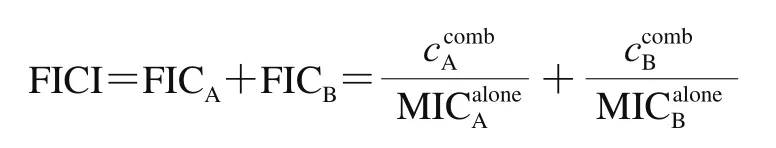
1.3.2 时间-杀菌曲线的绘制
将培养至对数期的单核细胞增生李斯特菌接种到新鲜营养肉汤中,使其浓度为106CFU/mL,然后加入不同质量浓度的抑菌剂,分别为1/4 MIC、MIC的苯乳酸,1/2 MIC、MIC的醋酸,以及1/4 MIC苯乳酸+1/2 MIC醋酸,然后于37 ℃恒温培养箱培养。在适当的时间点取样并采用平板计数法测定培养活菌数。以时间为横坐标,活菌数的对数值为纵坐标绘制时间-杀菌曲线。
1.3.3 单核细胞增生李斯特菌Zeta电位的测定
采用马尔文激光粒度仪考察了苯乳酸、醋酸对单核细胞增生李斯特菌Zeta电位的影响。取生长对数期的单核细胞增生李斯特菌,4 700×g离心10 min,用无菌超纯水清洗重悬,调节菌体浓度至2×108CFU/mL。取1 mL菌悬液分别与1 mL不同质量浓度抑菌剂等体积混匀,用超纯水作空白对照,以pH 3的HCl溶液作阳性对照,在37 ℃下孵育1 h后用马尔文激光粒度分析仪进行电位检测。
1.3.4 单核细胞增生李斯特菌膜电位的测定
采用DiSC3(5)考察苯乳酸、醋酸对单核细胞增生李斯特菌膜电位的影响。收集对数期的细菌,清洗并用5 mmol/L HEPES缓冲液(pH 7.2~7.4,含10 mmol/L葡萄糖)重悬至2×108CFU/mL。然后,将DiSC3(5)加入到细胞悬液中,使其终浓度为1 μmol/L,于30 ℃黑暗条件下温育15 min。之后清洗、重悬,并加入KCl,使其终浓度为100 mmol/L,以平衡细胞质和外部钾离子浓度。最后,用等体积的抑菌剂与菌悬液于比色皿中混匀,以缬氨霉素(18 mmol/L)处理组作为阳性对照,尼日利亚菌素(2 mmol/L)处理组作为阴性对照,在激发波长650 nm、发射波长672 nm条件下测定荧光强度变化。
1.3.5 单核细胞增生李斯特菌细胞膜完整性的分析
采用荧光显微镜考察了苯乳酸与醋酸联用对单核细胞增生李斯特菌细胞膜完整性的影响。收集对数期的单核细胞增生李斯特菌,清洗、重悬,调整细菌浓度为2×108CFU/mL,将等体积的菌悬液与不同浓度抑菌剂混合,未用苯乳酸和醋酸处理的样品作为阴性对照,用体积分数70%异丙醇溶液处理的样品作为阳性对照,并在37 ℃孵育60 min。然后通过离心收集细胞,清洗、重悬以除去抑菌剂,并在黑暗条件下用2 μmol/L SYTO9和12 μmol/L碘化丙啶(propidium iodide,PI)染色15 min。之后清洗、重悬,菌体采用荧光显微镜观察和Accuri C6 Plus流式细胞仪分析。
1.3.6 单核细胞增生李斯特菌微观形态的观察
采用扫描电子显微镜考察单核细胞增生李斯特菌外部形态的变化。将收集好的细胞用0.1 mol/L 磷酸盐缓冲液清洗后,在4 ℃下用体积分数2.5%戊二醛溶液固定过夜。然后用乙醇(体积分数分别为30%、50%、70%、85%、90%、100%)进行梯度脱水,每次15 min,无水乙醇脱水两次。之后用乙酸异戊酯将乙醇置换两次,冷冻干燥后通过扫描电子显微镜观察。
1.3.7 琼脂糖凝胶阻滞电泳分析
采用琼脂糖凝胶阻滞电泳考察苯乳酸和醋酸对细菌基因组DNA的影响。将单核细胞增生李斯特菌培养至对数期,然后用Minibest细菌基因组DNA提取试剂盒按试剂盒说明书提取细菌基因组DNA,之后用Evolution 220紫外分光光度计测定DNA的浓度及纯度。将纯度合格(OD260nm/OD280nm=1.98)的DNA与不同浓度的抑菌剂作用后,用1%琼脂糖凝胶电泳考察DNA在琼脂糖中的迁移率。电泳指示条带在1×TAE缓冲液中迁移至整块胶板4/5后用凝胶成像系统进行观察分析。
1.4 数据统计与分析
所有实验重复3 次取其平均值,采用Origin Pro 8软件对实验结果进行统计分析并作图。
2 结果与分析
2.1 苯乳酸和醋酸对单核细胞增生李斯特菌的抑菌活性
苯乳酸和醋酸对单核细胞增生李斯特菌的MIC分别为2.25、1.75 mg/mL,FICI为0.5,表明苯乳酸和醋酸对单核细胞增生李斯特菌具有协同效应,同时表明醋酸对单核细胞增生李斯特菌的抑菌效果强于苯乳酸。根据实验结果选取1/4 MIC苯乳酸+1/2 MIC醋酸联用,并采用时间-杀菌曲线进行抑菌性的验证。通过图1中的时间-杀菌曲线实验结果可以看出,用1/4 MIC苯乳酸、1/2 MIC醋酸处理单核细胞增生李斯特菌24 h后,菌落数分别增加了3.6(lg(CFU/mL))和2(lg(CFU/mL)),结果与空白组(增加了3.6(lg(CFU/mL)))相似。而MIC苯乳酸、MIC醋酸及二者联用处理单核细胞增生李斯特菌后,24 h菌落数处于稳定状态,和初始值相比,分别下降了1.6、1.4、1.2(lg(CFU/mL))。此外,联用组与1/4 MIC苯乳酸组相比,24 h后,其活菌数减少超过2(lg(CFU/mL)),根据Jacqueline等[21]的评估方法,1/4 MIC的苯乳酸与1/2 MIC的醋酸联用对单核细胞增生李斯特菌呈现出协同抑菌效应。多项报道显示,有机酸与抑菌剂联用可以发挥协同增效抑菌作用,如乙酸(0.10%,体积分数)和百里酚(100 mg/L)或香芹酚(100 μL/L)联用对鼠伤寒沙门氏菌呈现协同抑菌作用[22];乳酸和抗坏血酸联用对大肠杆菌O157:H7具有协同抑制效应[23]。

图1 苯乳酸、醋酸对单核细胞增生李斯特菌的时间-杀菌曲线Fig.1 Time-killing curve of L.monocytogenes when exposed to PLA and ACE
2.2 苯乳酸与醋酸联用对单核细胞增生李斯特菌Zeta电位的影响
Zeta电位反映了细菌表面净电荷分布情况,即细菌表面与周围介质的电位差。从图2可以看出,未处理的细菌其Zeta电位为负值,这是由于存在羧基和磷酸盐等阴离子基团[24]。苯乳酸和醋酸单一处理组细胞表面的电荷发生较大的改变,电性甚至由负电变为正电,可能是苯乳酸和醋酸电离产生大量的氢离子基团导致电性改变。而苯乳酸和醋酸联用组和阳性对照组的电性表现结果一致,即细胞电荷发生改变,但电性仍然为阴性,说明联用对细胞表面电荷的影响受到苯乳酸和醋酸共同的作用但又不同于二者单独作用。苯乳酸和醋酸及其联用组的pH值在3.0±0.3范围内,但结果显示3 个实验组在误差pH值范围内对电荷有不同的影响,说明除了氢离子浓度(pH值)导致细菌表面电荷发生变化外,还可能由于苯乳酸及醋酸使菌体表面其他官能团被电离从而导致细胞表面电荷发生变化而达到抑菌目的。Wang Chenjie等[25]发现乳酸处理单核细胞增生李斯特菌可导致其Zeta电位变为较小的负值,甚至转变为正值,即乳酸会严重干扰单核细胞增生李斯特菌的表面电荷。表明苯乳酸、醋酸对单核细胞增生李斯特菌表面电荷的影响与乳酸相似。此外,Young等[26]研究乙酸、乳酸和柠檬酸对单细胞增生李斯特菌生长的抑制作用时发现,等pH值的有机酸对单细胞增生李斯特菌的抑制强度不同,强度顺序为乙酸>乳酸>柠檬酸,该研究同样表明有机酸的抑菌活性不仅取决于pH值,还与未解离的有机酸分子特性有关。

图2 苯乳酸、醋酸对单核细胞增生李斯特菌Zeta电位的影响Fig.2 Effect of PLA and ACE on Zeta potential of L.monocytogenes
2.3 苯乳酸与醋酸联用对单核细胞增生李斯特菌膜电位的影响
荧光探针DiSC3(5)能进入正常细胞并自我猝灭,但如果细胞在抑菌物质作用下发生去极化后,DiSC3(5)就会从细胞中释放出来,导致荧光强度的增加。由图3可知,空白组和尼日利亚菌素处理的阴性对照组荧光强度几乎一致。而用缬氨霉素处理的阳性对照组荧光强度明显增加至936.4,1/4 MIC苯乳酸、MIC苯乳酸、1/2 MIC醋酸、MIC醋酸及1/4 MIC苯乳酸+1/2 MIC醋酸联用组处理后,荧光强度分别为817.1、1 643、885.4、1 588、1 458。表明苯乳酸和醋酸对单核细胞增生李斯特菌的跨膜电势的消散程度随着抑菌剂浓度的增加而增加,其中MIC苯乳酸和MIC醋酸组对膜电势的消散作用极强,因为其荧光强度(1 643、1 588)远大于阳性对照组(936.4),且MIC苯乳酸对膜电势的消散作用强于MIC醋酸组。此外,1/4 MIC苯乳酸+1/2 MIC醋酸联用组和1/4 MIC苯乳酸、1/2 MIC醋酸组相比,荧光强度明显增加,几乎达到MIC醋酸组处理后的荧光强度,破坏程度明显增大。表明苯乳酸、醋酸及其联用组能消散膜电势,且1/4 MIC苯乳酸+1/2 MIC醋酸联用组对膜电势的消散具有协同性。
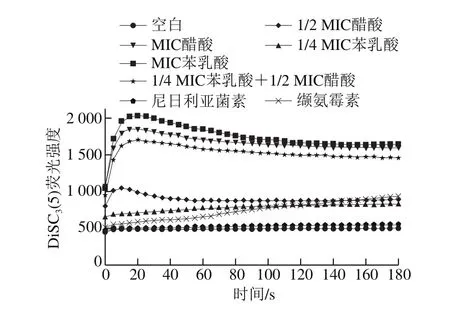
图3 苯乳酸、醋酸对单核细胞增生李斯特菌膜电位的影响Fig.3 Effect of PLA and ACE on membrane potential of L.monocytogenes
2.4 苯乳酸与醋酸联用对单核细胞增生李斯特菌细胞膜完整性的影响
采用SYTO9和PI两种荧光染料对细胞染色观察苯乳酸与醋酸对细胞膜完整性的影响[27]。SYTO9能将所有细胞染色并发出绿色荧光,PI只能穿透细胞膜受损的细胞与核酸结合发出红色荧光,因此可以用来观察受损伤的细胞。从图4可以看到,未经处理的单核细胞增生李斯特菌发出绿色荧光(图4A),表明细胞膜完整。经过1/4 MIC苯乳酸处理后,细胞发出黄绿色荧光(图4B),经过1/2 MIC醋酸处理后的大部分菌体发出黄色荧光(图4D),表明细胞膜受到损坏,而经过MIC苯乳酸、MIC醋酸、1/4 MIC苯乳酸+1/2 MIC醋酸处理后的菌体发出橙色或者橙红色(图4C、E、F),表明细胞膜受到严重破坏。
为了明确苯乳酸和醋酸对细胞膜完整性的破坏程度,进一步采用流式细胞术定量考察细胞膜完整性的破坏程度。从图5可以看出,空白组仅有3.4%的细菌膜遭到破坏,经过MIC的苯乳酸、醋酸处理后,细胞膜破损率分别为97.1%,97.2%,可以看出两种抑菌剂对细胞膜完整性的破坏作用很强,且随着质量浓度的增加而增大。此外,经过1/4 MIC苯乳酸、1/2 MIC醋酸处理后,细胞膜破坏率分别为77.7%和91.4%,而1/4 MIC苯乳酸+1/2 MIC醋酸对细胞膜完整性的完全破坏率为98.4%,显示出较好的抑菌活性。该结果与上述荧光显微镜的结果一致,均表明苯乳酸和醋酸对细胞膜完整性具有破坏性,且MIC苯乳酸、MIC醋酸、1/4 MIC苯乳酸+1/2 MIC醋酸对细胞膜完整性破坏比较严重,同时1/4 MIC苯乳酸+1/2 MIC醋酸对细胞膜还显示出协同破坏性。Liu Fang等[28]发现1%的苯乳酸即可破坏大肠杆菌细胞膜的完整性。

图4 荧光显微镜分析苯乳酸与醋酸联用对单核细胞增生李斯特菌细胞膜完整性的影响Fig.4 Effect of combination of PLA and ACE on cell membrane integrity of L.monocytogenes evaluated by fluorescence microscopy
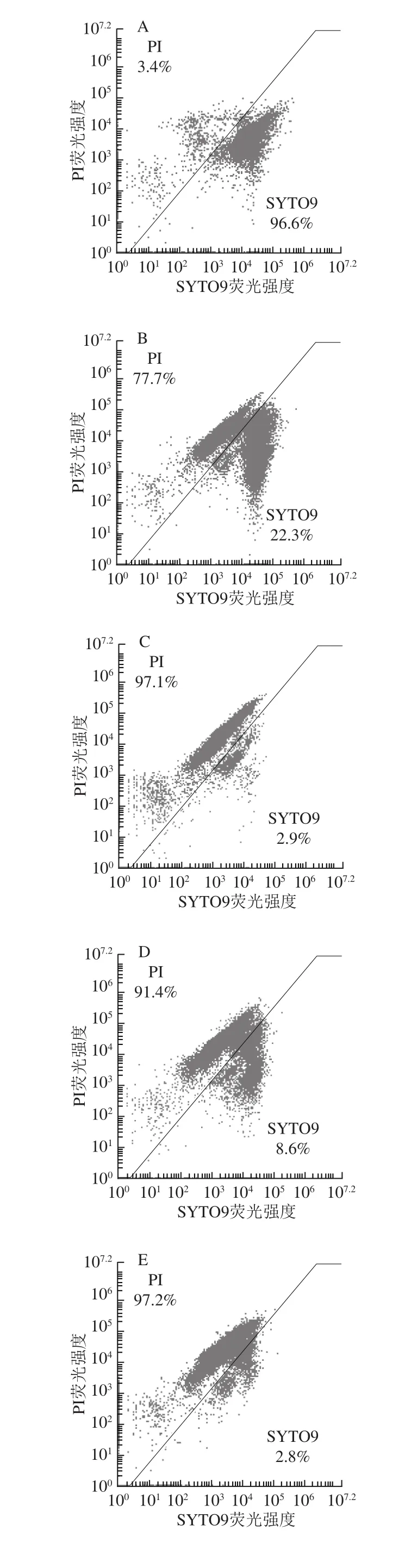

图5 流式细胞术分析苯乳酸与醋酸联用对单核细胞增生李斯特菌细胞膜完整性的影响Fig.5 Effect of combination of PLA and ACE on cell membrane integrity of L.monocytogenes evaluated by flow cytometry
2.5 苯乳酸与醋酸联用对单核细胞增生李斯特菌形态结构的影响

图6 苯乳酸与醋酸联用对单核细胞增生李斯特菌微观结构的影响Fig.6 Effect of combination of PLA and ACE on cell microstructure of L.monocytogenes evaluated by scanning electron microscope
采用扫描电子显微镜考察了苯乳酸和醋酸对单核细胞增生李斯特菌形态的影响,从图6可以看出,未经处理的单核细胞增生李斯特菌表面圆润光滑、形态完好(图6A)。经1/4 MIC苯乳酸处理后菌体出现抱团、表面皱缩(图6B);经MIC苯乳酸处理后,菌体出现黏连、内容物泄出(图6C)。经1/2 MIC醋酸处理后,菌体表面出现皱缩,发生轻微的黏连现象(图6D);经MIC醋酸处理后,菌体出现黏连、内容物泄出、细胞形态结构变化(图6E)。经1/4 MIC苯乳酸+1/2 MIC醋酸处理后,菌体表面变得粗糙,发生黏连且内容物泄出(图6F)。上述结果表明,随着苯乳酸和醋酸质量浓度的增加,对单核细胞增生李斯特菌的破坏作用增大,1/4 MIC苯乳酸+1/2 MIC醋酸对细胞的破坏程度显著高于单独使用1/4 MIC苯乳酸、1/2 MIC醋酸,能达到MIC苯乳酸、MIC醋酸对细胞的破坏程度,显示出1/4 MIC苯乳酸+1/2 MIC醋酸对细胞形态结构的协同破坏性。结合图3和图4推断苯乳酸、醋酸破坏细胞膜膜电势后,造成细胞膜通透性增加,完整性遭到破坏,进而影响细胞功能和形态,导致菌体死亡。有机酸可对细胞膜结构产生影响,如Wang Chenjie等[29]用透射电子显微镜观察乳酸对单细胞增生李斯特菌超微结构的变化,结果显示乳酸使细胞膜发生凹陷、质壁分离、细胞质密度降低等现象,从而使细胞失活。Dieuleveux等[10]报道,苯乳酸处理单核细胞增生李斯特菌后,通过扫描电子显微镜观察到菌体细胞壁失去刚性,细胞发生膨胀,最后完全崩解。
2.6 苯乳酸与醋酸联用对单核细胞增生李斯特菌基因组DNA的影响

图7 苯乳酸与醋酸联用后单核细胞增生李斯特菌基因组DNA的凝胶电泳图Fig.7 Gel electrophoresis images showing the effect of combination of PLA and ACE on genomic DNA of L.monocytogenes
采用琼脂糖凝胶电泳法考察了苯乳酸和醋酸对单核细胞增生李斯特菌基因组DNA的影响。游离的核酸凝胶染料4S Red Plus的荧光微弱,当其与DNA结合后,会发出强烈的荧光。从图7可以看出,与对照组比较,1/4 MIC苯乳酸及1/2 MIC醋酸处理的DNA条带亮度发生不同程度的减弱,可能是1/4 MIC苯乳酸和1/2 MIC醋酸破坏了DNA。此外,1/2 MIC醋酸还出现了DNA滞留在进样口的情况,表明1/2 MIC醋酸与DNA发生电中性而部分停留在上样孔。而MIC苯乳酸、MIC醋酸及1/4 MIC苯乳酸+1/2 MIC醋酸联用组均出现条带消失,表明它们对DNA的作用比单一的1/4 MIC苯乳酸或1/2 MIC醋酸强,可能将DNA降解成小碎片。上述凝胶电泳结果表明苯乳酸和醋酸可通过降解DNA,从而影响DNA复制、转录等一系列过程,达到抑菌目的。本研究结果与乳酸链球菌素等细菌素对菌体DNA的作用方式类似,均可以导致DNA降解从而发挥抑菌活性[30];此外,1/2 MIC醋酸与壳聚糖对菌体DNA的影响类似,均出现DNA滞留在进样口,且条带亮度减弱的现象,推测1/2 MIC醋酸可以通过与DNA结合,改变DNA电荷特性而发挥抑菌活性[31]。
3 结 论
苯乳酸和醋酸联用对单核细胞增生李斯特菌具有协同抑菌性,抑菌位点包括细胞膜、DNA。苯乳酸和醋酸联用通过影响细胞表面电荷、破坏细胞膜(包括细胞膜电势及细胞膜完整性)引起细菌形态结构的改变,进入细胞后与DNA发生相互作用,从而扰乱细胞内正常的生理代谢活动,使细胞死亡发挥抑菌作用。苯乳酸和醋酸联用对菌体各抑菌靶位的破坏作用显著高于各抑菌剂单独作用的破坏程度。本研究表明苯乳酸与醋酸复配能降低苯乳酸的使用量,为苯乳酸在食品防腐中的应用提供了科学依据。
