关节腔内注射碘乙酸快速建立小鼠骨关节炎模型∗
2020-12-31钟宇辰王诗淳张婷婷庞希宁
钟宇辰 王诗淳 赵 峰 张婷婷 陈 萌 施 萍 庞希宁
(1.中国医科大学基础医学院,沈阳 110122)(2.沈阳艾米奥生物工程技术研发中心有限公司,沈阳 110015)
骨关节炎(osteoarthritis,OA)作为一种常见的多因素老年骨关节慢性退行性病变,其主要的病L过程包括关节软骨破坏,滑膜炎症,软骨下骨破坏和骨赘形成,由其产生的功能障碍和疼痛,严重影响了中老年人的健康与生活质量。有研究显示,80%~90%的65岁以上老年人都会存在骨关节炎样软骨改变[1]。流行病学数据显示[2],美国大于60岁的老年人群中,有症状的OA患者大约占总人群数的10%,成为美国老年人群中最多发的骨关节疾病。随着我国人口老龄化[3]与肥胖率[4]的不断提高,OA患病率将会逐步升高。
由于损坏的膝关节软骨本身血管稀少,再生能力弱[5],导致非手术治疗主要目的在于控制疼痛和保护仅剩的关节功能,等到疾病晚期,外科手术关节置换成为唯一的治疗方法,而对于引导膝关节修复的治疗还未开展,有很大的研究前景[6]。利用哺乳动物的制作骨关节炎模型的方法已经相对成熟,如大鼠的Hulth法,碘乙酸(monoiodoacetic acid,M IA)注射,单纯前交叉韧带切断法等[7]。由于这些方法主要是通过机械磨损的方法获得OA模型,其造模时间就相对较长,并且还存在术后感染、手术创伤等易影响模型生化代谢的因素。M IA作为3-磷酸脱氢酶抑制剂,可以诱导软骨细胞迅速死亡,因此MIA注射作为大鼠骨关节造模的快速方法,广泛应用于大鼠骨关节炎疼痛方面的研究[8],但尚缺少在小鼠关节腔内注射的实验数据。为更好地研究OA的病L生L过程,为临床治疗OA给予参考。本实验初步探讨了通过关节腔内注射MIA建立小鼠OA模型的可能性,并对不同剂量的MIA构建的小鼠OA模型进行比较研究。
1 材料与方法
1.1 实验动物与试剂
本实验通过中国医科大学动物伦L委员会审批。所有实验操作根据中国医科大学实验动物处L操作进行。自辽宁长生生物有限公司购买6~8周龄雄性 C57BL/6小鼠 52只(合格证号211002300041841),体质量(20±1.1)g,SPF 级动物房室温饲养,昼夜规律交替(12 h/12 h),给予充足水,食物,给予自由活动空间。适应性饲养3 d后进行OA造模。
使用试剂:MIA、戊巴比妥钠、HE染色试剂盒、番红O-固绿染色试剂盒、75%酒精、10%多聚甲醛。
1.2 方法
C57BL/6小鼠随机分为 4组,每组 13只:①0.025 mg/0.05 mg组;②0.1 mg/PBS组;③0.2 mg/空白组;④0.5 mg/空白组[9]。戊巴比妥钠麻醉后应用眼科剪剔除膝关节处毛发,行关节腔内注射术,注射前用游标卡尺测量小鼠初始膝关节宽度。将不同质量MIA溶于10μL的 PBS中注入膝关节,在右侧外方髌韧带与髌骨旁韧带中间缝隙处进针,直至针头碰到股骨内上髁时,回退2 mm,然后注入MIA溶液,PBS对照组注入10μL PBS,空白对照组将针刺入关节腔内不做注射。注射完毕后,确保麻醉苏醒和动物存活的情况下将小鼠放回笼内,保证充足食物饮水和活动空间。
1.3 组织取样与数据测量
分别于膝关节注射后1 d、4 d、1周、2周和 4周测量小鼠膝关节宽度,并于1周、2周、4周测量各组小鼠质量,同时每组各取3只小鼠,脱颈致死,解剖膝关节进行大体观察评分(表1)[9]。评分时胫骨内外侧髁状突均进行评分,取两侧中分数高者作为此关节的大体评分。

表1 评分标准Table 1 Scoring Standard
1.4 组织学测量
取出膝关节后,剔除多余肌肉组织,4%多聚甲醛固定后14%EDTA脱钙21 d,每4 d换液一次,30%蔗糖溶液脱水24 h,然后进行OCT胶包埋冰冻切片,行矢状位切片后HE染色与番红O-固绿染色,番红O-固绿染色切片请2位实验员分开采用国际OA研究学会(Osteoarthritis Research Society Internation,OARSI)分级制度评分(表2)[10]
1.5 统计方法
采用GraphPad Prism 5.0统计软件进行两组实验资料的统计学检验,实验数据以平均数±标准差(±s)表示,进行t检验,P<0.05视为差异有统计学意义。

表2 OARSI评分标准Table 2 OARSI Scoring Standard
2 结果
2.1 造模后小鼠的基本情况
经过注射后0.5~1 h后,所有小鼠均苏醒,能自由在笼内活动、饮食。小鼠平均体质量从注射前(22.079±1.50)g增加为 28 d之后的(22.713±1.50)g(表3)。 28 d后小鼠均存活,活动基本正常,无特殊体态。
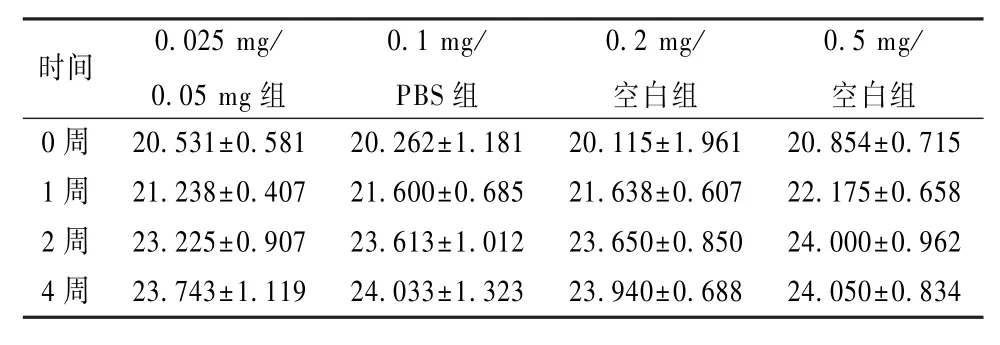
表3 小鼠平均体质量Table 3 Average w eight of m ice
2.2 膝关节宽度
经过注射后,各组的膝关节均有肿胀,膝关节宽度测量结果见表4所列。其中较大剂量组(≥0.1 mg)膝关节与较小剂量组(<0.1 mg)相比肿胀明显(P<0.05),1 d后关节肿胀开始消退,直到1周后除0.5 mg组以外其余各组差异不显著。给药后1 d,0.5 mg组关节宽度显著高于0.1 mg组与0.2 mg组(P<0.05);给药2周后,各组之间膝关节宽度差异不显著(P>0.05)。给药4周后,较小剂量组(<0.1 mg)也分别有所上升,但并不存在统计学差异,可能与小鼠本身发育增长有关。

表4 膝关节宽度Table 4 Knee joint width
2.3 大体观察评分
注射MIA 1周、2周、4周之后,获取小鼠膝关节进行拍照并对其大体评分进行分析,由图1可知,破坏主要居中在靠中心位置的骨关节面上,以小的软骨缺损为主。由表5可知,除PBS组外各组的评分都有所增加,1周时0.2 mg组与0.5 mg组大体破坏较大(P<0.05),2周时0.1 mg组也出现了较大的损伤(P<0.05),4周时0.05 mg组也出现较大损伤(P<0.05),从变化趋势来看,各组初始1周时评分差距大,2周之后各组的破坏程度差异明显缩小,组间差异不明显(P>0.05),但总体变化趋势为2周大体损伤最大,4周之后大体损伤放缓。

表5 膝关节大体评分Table 5 Knee joint score
2.4 组织学观察评分

图1 膝关节损坏照片Fig.1 Photos of the knee joint dam age
注射MIA 1周、2周、4周后,获取小鼠的膝关节切片进行HE染色和番红O-固绿染色(表6、图2和图3)。较小剂量组(<0.1 mg)MIA在1周与2周时主要表现为关节面的粗糙和连续性中断,而较大剂量组(≥0.1 mg)MIA对于关节面的破坏主要表现为软骨的缺失和破碎。相较于PBS组的关节面,MIA注射后关节面软骨细胞明显紊乱、分布不均,番红无法染色。从组织学评分来看(表6),0.5 mg组在1周时即表现出明显破损,而0.2 mg组与0.1 mg组也在2周时表现出明显损伤。总体看来,早期各个剂量之间损伤变化差异不大,但在4周之后剂量较小组(<0.1 mg)与较大剂量组(≥0.1 mg)差异明显(P<0.05),同时,2~4周中较大剂量组(≥0.1 mg)在评分上差异不大,而较小剂量组(<0.1 mg)与PBS组的差距开始显现(P<0.05)。
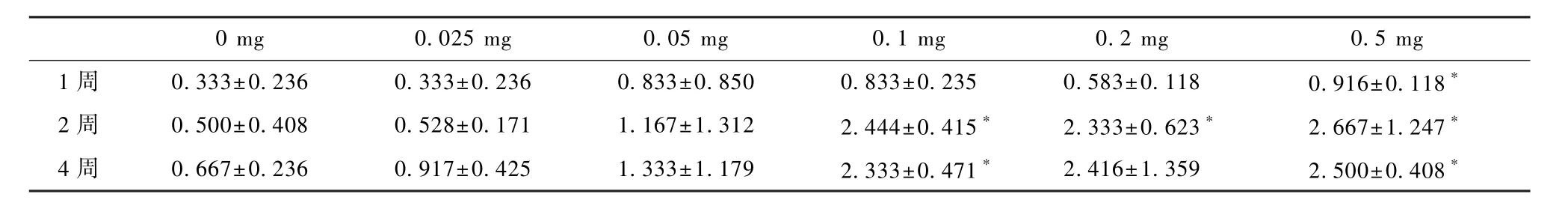
表6 膝关节切片组织学评分Table 6 Histological score of knee joint section

图2 膝关节HE染色关节破坏Fig.2 Knee joint destruction with HE staining

图3 膝关节番红O-固绿染色关节破坏Fig.3 Knee joint destruction with safranin O-fixation green staining
3 讨论
3.1 M IA对于膝关节软骨的损伤特点
MIA的作用为抑制骨关节细胞中3-磷酸脱氢酶,切断抑制细胞的三羧酸循环,使蛋白质和多糖合成减少,最终导致细胞坏死,从而模拟 OA时的过程[11]。有文献表示此方法无法造成临床OA样的损伤,推荐将此方法用于OA疼痛模型的建立[12],但也有文献选择将MIA用于OA破坏模型的建立[13-14],本文更倾向于MIA可以形成OA样损伤而非仅造成疼痛。与此同时,M IA具有自身独特优势,相较于传统的 Hulth法、单纯前交叉韧带切断法,MIA建立OA模型的方法速度较快,在1~2周内即可观察到骨关节的损害。此外,相较于手术方法,注射的过程对于膝关节的损伤较小,不易产生感染和周围软组织损伤与结构性破坏。而韧带切断术后由于膝关节不再稳定,手术后小鼠的日常的攀爬动作和悬吊动作,小鼠的搬运都有可能造成的关节异常活动,从而对膝关节炎进程产生影响,增加了实验结果异常的风险。
从大体和组织结果看来,MIA造成的膝关节破坏主要聚集在注射区域周围,在注射过程中,可控性较差,手术法获得的组织损伤,多体现为关节力学轴线的破坏,关节最大承重面从外侧胫骨平台变为内侧胫骨平台和股骨内上髁,破坏范围较为确定可控[15]。
3.2 M IA剂量的选择
3.2.1 膝关节宽度与MIA剂量的关系:从膝关节宽度研究结果可以发现,第1周是关节宽度变化最大的时期,较大剂量组(≥0.1 mg)明显更加严重,由此可知这是由于膝关节周围软组织受MIA不同剂量刺激可产生不同程度的炎症肿胀。0.5 mg组在第1天时肿胀明显,在7 d时明显回落,在下降后与PBS组相比差异仍然显著(P<0.05),0.1 mg与0.2 mg也在4~7 d时迅速下降,0.05 mg与0.025 mg组本身肿胀在4 d时才显现,但于1周时也开始下降,各个组的宽度变化在3周内不再明显,这说明周围软组织水肿和消退与时间和剂量相关,虽然高剂量MIA对组织刺激更大,但机体的反应速度也更加迅速,而当其到达一个相对“平台期”后,变化不再明显。由此可知,在一定剂量范围内注射M IA引起的OA滑膜炎可以在1周左右到达平台期,而在平台期之前,较大的剂量产生的滑膜炎也更加严重。
而在2周之后,PBS组、0.05 mg组与0.025 mg组出现了膝关节宽度上升,考虑到小鼠本身的体质量与体型的变化,可以暂时把这些程度较小的宽度增加归因于机体的生长。
3.2.2 大体评分与MIA剂量的关系:在大体观察中可以发现,PBS组评分均为0~1分,而注射 MIA的胫骨平台均出现细小的凹陷,这表明即使是少量的MIA也可在无骨组织结构破坏的情况下产生软骨退变,这与OA早期病L过程相似,可以通过细化低剂量M IA来开发更贴近慢性OA的动物模型。
在2周之前,除PBS组以外各组均出现评分的上升,2周时1~2分处有 0.1 mg组,0.05 mg组与0.2 mg组,而当 4周 后0.2 mg组平均分达到2.5分,而 0.1 mg组,0.05 mg组平均分仍为1~2分。0.5 mg组在2周和4周均达到了2分以上的平均分。从评分的标准可以看出,2分以上的破坏存在片状的软骨损害,而非细小空洞,说明软骨损伤更为明显,但若需要通过MIA注射产生软骨较大面积损害,应选择 0.2 mg以上的剂量。若需要模拟晚期OA产生的骨质破坏,还需更高剂量的MIA进行实验认证。
3.2.3 组织学分析:OARSI评分在0.5 mg注射4周后达到最大值6分[10],而本实验0.5 mg组在4周时最高仅达到4分,这应该与小鼠品种和体质量不同有关。达4分之后,小鼠开始出现骨组织损伤,不宜再用软骨损伤评估来评价OA严重程度,故本实验推荐在大于4周以上通过组织学评价评估OA损伤的实验中MIA剂量小于0.5 mg。
通过观察各个时间点的组织学评分不难发现,在1周之后较大剂量组(≥0.1 mg)评分出现了一个急剧的上升,而较小剂量组(<0.1 mg)上升较为平缓,0.025 mg组几乎与PBS组相同,这说明较大剂量组(≥0.1 mg)MIA对于骨组织的损伤更加明显,更适合用于短期内获得满意软骨组织的损伤。而其中0.1 mg、0.2 mg、0.5 mg三组之间差距不大,没有太大的统计学意义。
通过本实验可以发现,注射MIA产生的小鼠膝关节损伤与时间和剂量有关,较大剂量组(≥0.1 mg)的表现为短时间内的软骨组织的破坏和剧烈的炎症反应,较小剂量组(<0.1 mg)表现出轻度软骨组织的破坏和可逆性炎症反应。本实验推荐0.1 mg剂量作为较大剂量组的代表剂量,0.05 mg剂量为较小计量组的代表剂量,但在大体观察中可以发现0.2 mg组症状优于0.1 mg组,故在OA模型特定研究中,应详细考虑MIA的剂量和作用时间,以满足实验行为学和组织学需要。与此同时,仍然需要更为细化的浓度实验和长期实验来研究较大剂量组和较小剂量组的组内差异。选择合适的MIA剂量来快速构建小鼠OA模型,对于之后的骨关节治疗研究大有裨益。
