Hartley豚鼠生物净化群体建立及微卫星遗传质量分析
2020-12-31武卫国刘佐民柳全明
范 涛 武卫国 冯 宾 刘佐民 柳全明
(中国食品药品检定研究院,北京 102629)
剖腹产净化是实验动物常用生物净化手段之一。对于封闭群品系,剖腹产净化会产生“奠基者”效应而影响群体的遗传特性[1]。通过人为选择,群体中仅有部分个体进入到了下个阶段的繁育体系中,从而降低群体的多态性,同时,群体有效含量的减少,会加速近交系数上升速率,降低群体杂合度。然而,种群的净化又是维持微生物等级(SPF级)必不可少的环节,因此,在每次净化建群后,必须对遗传质量进行监测。
微卫星DNA(microsatellite DNA)具有基因组分布广、多态性高、重复性好等优点,用于实验动物遗传检测的研究已开展多年[2-6]。近几年,实验大、小鼠微卫星DNA遗传检测方法正在制定相应的国家标准,以弥补我国实验动物分子遗传检测方面的空白[7]。豚鼠是常用的实验动物之一,大量研究表明[8-13],微卫星DNA方法同样适用于封闭群豚鼠的遗传质量评价。本实验旨在通过剖腹产净化获得SPF级Harley豚鼠种群,通过遗传检测,了解净化后种群的遗传质量,为日后该种群的管L与应用提供基础数据支持。
1 材料与方法
1.1 豚鼠剖腹产净化
1.1.1 种鼠选择:原生产群采用4组循环交配方案,每组包含15~20个繁殖单元,每个繁殖单元雌雄比例1∶5。分别从各组选择7~8个繁殖单元,挑选其中的雌、雄个体(共计30个繁殖单元)作为种鼠(雄鼠确认可育,雌鼠为经产个体),按1∶1合笼一周后,雌、雄分开饲养。
1.1.2 剖腹产手术:从合笼开始计算,于65~70 d,用“综合判断法”(耻骨测量法+观察法)[14]对受孕母鼠进行临产期判断,对临产的孕鼠进行剖腹产手术。手术过程:孕鼠全身药浴,CO2安乐死,仰卧保定,术部75%酒精消毒,盖创巾,依次剪开孕鼠皮肤和腹壁,暴露子宫,用剪刀、镊子分离子宫,止血钳封闭双侧子宫角与宫颈,剪断,将整个子宫摘下,通过渡槽传入无菌隔离器中,在隔离器内,剪开子宫壁,暴露胎儿。胎儿取出后迅速擦拭口鼻,促进其自主呼吸,随后剪断脐带,从剖腹产到仔鼠取出,控制在3 m in内完成。成活仔鼠在隔离器内分笼饲养,编号,温度控制在28~30℃,用人工乳饲喂3~4次/d,饲喂至7日龄,随后逐步改喂全价颗粒饲料。
育成的个体作为种鼠,分为 4组,按照 GB 14923—2010中封闭群循环交配方法进行组合,交配繁殖,获得F1代。
1.2 豚鼠微卫星遗传检测
根据文献[10-11],选择豚鼠基因组中18个具有较高多态性的微卫星位点(表1),合成引物,引物由北京擎科新业生物技术有限公司合成并进行荧光标记。已建立的SPF豚鼠群中,选取不同繁殖单元的25只个体,采集耳郭组织样本,酚/氯仿法提取全基因组DNA,稀释至50~100 ng/μL,分别对每个样本进行18个位点的PCR扩增。产物进行微卫星STR扫描。
数据统计分析:使用Gene Marker 2.2读取STR扫描结果,判断等位基因大小,通过 PopGene 1.32计算各位点观察等位基因数、有效等位基因数、Shannon信息指数、观测杂合度、期待杂合度等指标,用PIC_CALC分析计算每个位点多态性信息含量(PIC)。对各位点进行Hardy-Weinberg遗传平衡检验(P值)。

表1 18个豚鼠微卫星位点相关信息Table 1 Characteristics of 18 microsatellite loci from guinea pig
2 结果
2.1 剖腹产结果
通过剖腹产,共获得仔鼠85只,成活56只,离乳 47只(23雄、24雌),成活率 65.9%,离乳率83.9%(表 2)。
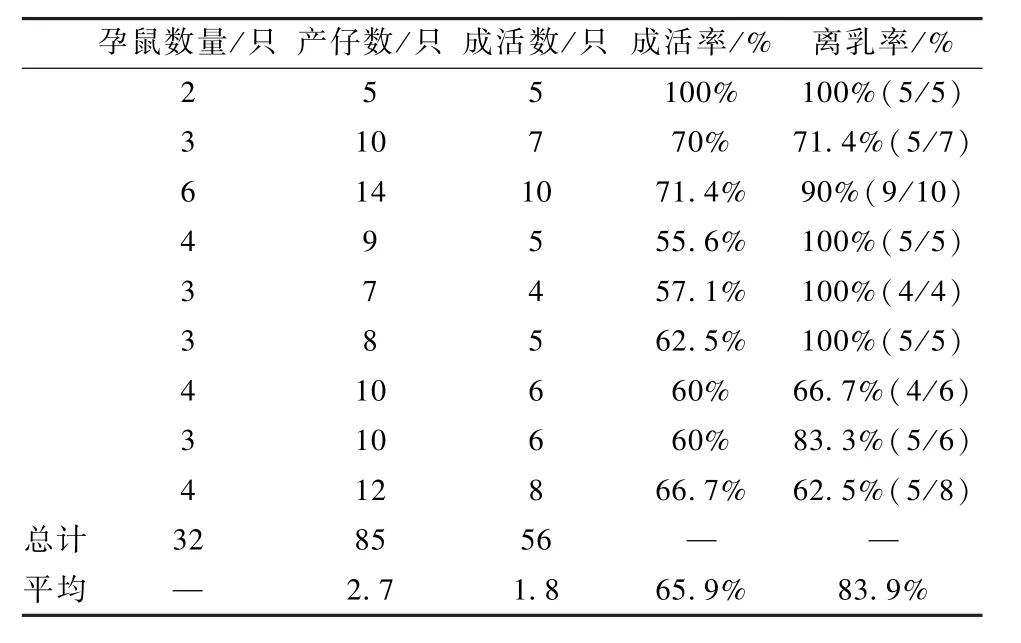
表2 豚鼠剖腹产结果Table 2 The results of cesarean section of guinea pigs
2.2 微卫星遗传检测结果
实验结果中,除1个样本未扩增出的位点较多,未纳入统计(实际统计24个样本),其余样本在18个位点上均得到扩增产物,经STR扫描后,确定产物大小并进行分型,计算等位基因数、杂合度、多态信息含量等参数(表3)。
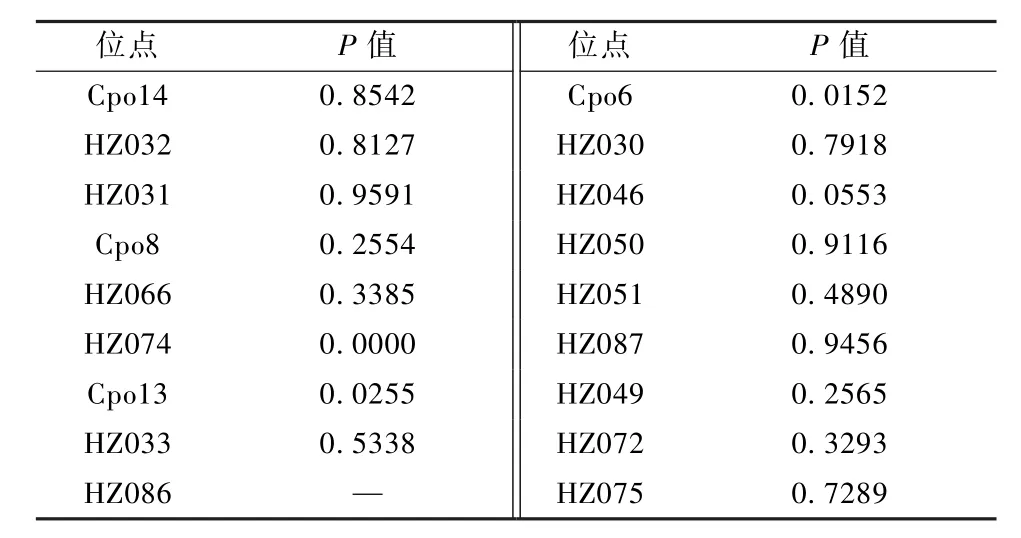
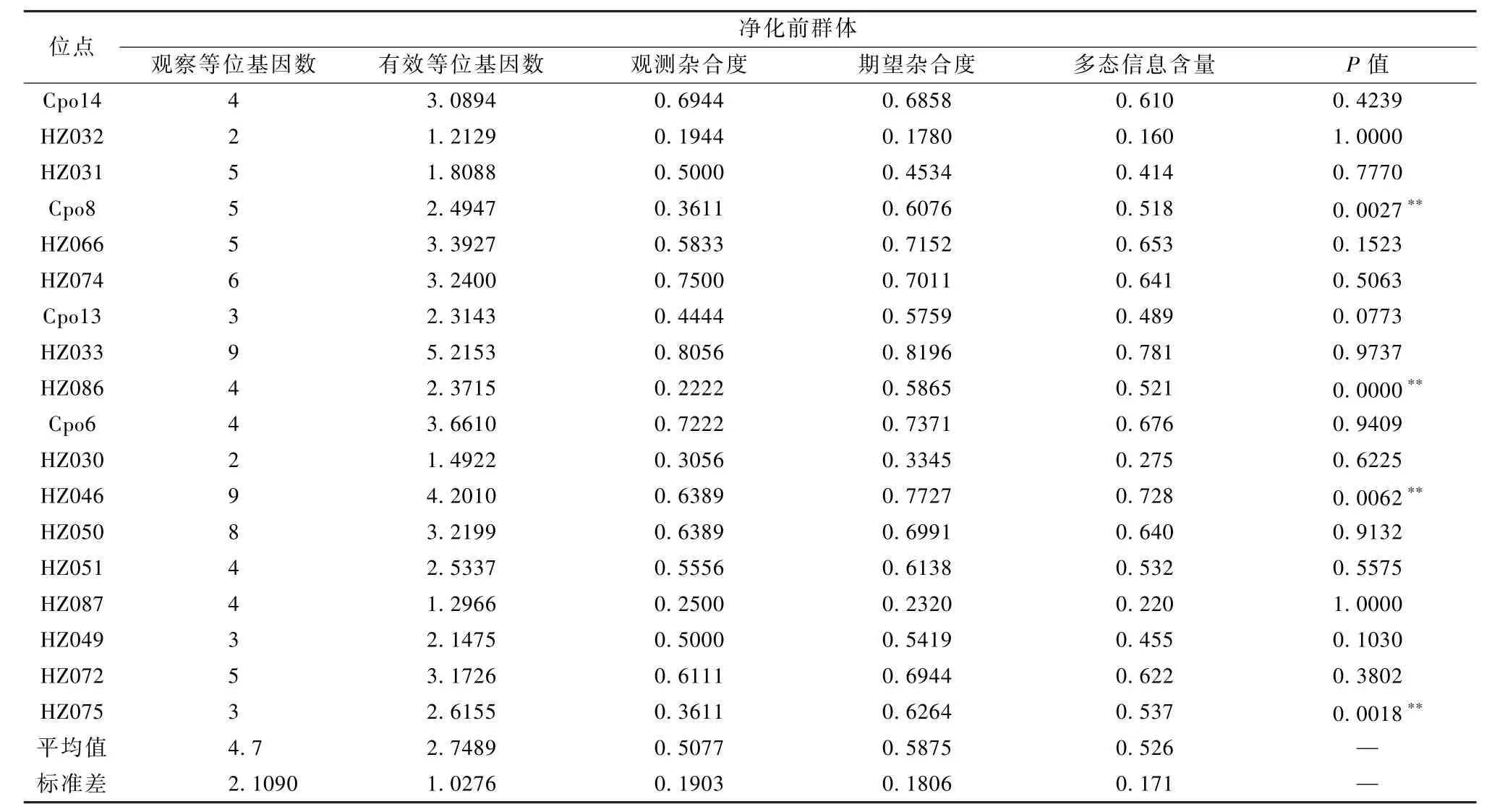
本豚鼠群共检测到 81个等位基因,平均 4.5个,平均观测杂合度 0.5694,平均期望杂合度0.5869,平均杂合度0.5747,该群具备较L想杂合度。多态性信息含量是表示位点多态性高低的一个指标,18个微卫星位点中,12个位点呈高度多态性(PIC>0.5),4个位点呈中度多态性(0.25 根据 Hardy-Weinberg遗传平衡检测结果(表4),18个位点中有14个位点符合H-W遗传平衡,位点 HZ086呈现纯合状态,HZ074、Cpo13、Cpo6 3个位点显著偏离H-W遗传平衡(P<0.05)。 表3 Har tley豚鼠封闭群在18个微卫星位点上的遗传多样性Table 3 Genetic variation for 18 microsatellite loci in Hartley outbred colony 表4 Hartley豚鼠封闭群Hardy-Weinberg遗传平衡检验Table 4 Exact test probability of Hardy-Weinberg genetic equilibrium of Hartley outbred colony 对比2014年相同遗传位点检测数据[11](表5),剖腹产前、后的群体,分别检测到 85个(平均4.7个)和81个(平均4.5个)等位基因,平均观测杂合度为 0.5077和0.5694,平均期望杂合度为0.5875和0.5869;平均多态信息含量(PIC)分别为0.526和0.522,剖腹产前、后群体均具备较L想的杂合度,维持着高度多态性。Hardy-Weinberg遗传平衡检测结果对比,原种群在18个位点中有4个显著偏离H-W遗传平衡,而净化后的群体有3个位点显著偏离,1个位点呈现纯合状态(位点HZ086)。 表5 净化前群体遗传多样性与H-W平衡检验Table 5 Genetic diversity and HWE test of the colony beforedecontamination 豚鼠孕期较长,妊娠期60~70 d,剖腹产手术实施越接近临产期成功率越高,同时,手术操作过程也是影响成活率的主要因素之一。本次实验采取观察与耻骨测量相结合来的方法综合判断临产期,剖腹产成活率达为65.9%,低于有关文献报道[14-15],这可能与经验积累与技术熟练程度有关。在本实验过程中还发现,头胎母鼠剖产得到的仔鼠活力较低,很难有自主呼吸,而使用经产母鼠,后代活力有较大改善,这也是影响剖腹产成活率的又一因素,具体差异还需进一步研究。 Hartley豚鼠属于封闭群实验动物。封闭群是指不从外部引入新个体的条件下,以非近交方式繁殖生产的实验动物种群。对于封闭群动物遗传质量控制,主要表现在保持其遗传组成具有较高的杂合性,同时所有基因的相对频率保持稳定。影响群体遗传多样性评价可靠性主要有两个方面,一个是选择的样本对总体的代表性,另一个是遗传标记对基因组的代表性。朱亮等[8]应用8个微卫星位点对群体中72个个体进行遗传,以评价其封闭群遗传质量;李芳芳等[11]通过25个微卫星位点检测比较了两个封闭群豚鼠间的遗传差异;刘迪文等[13]应用45个微卫星位点评估了三个远交系豚鼠的遗传结构,同时筛选出性状基因定位有关位点,为豚鼠育种提供基础数据。本实验从群体中每个繁殖单元都选取了动物个体(共25只),同时通过文献选择了18个多态性较高的微卫星位点,用于反应群体的遗传概况,较为合L。通过与剖腹产前种群遗传检测结果进行对比,种群遗传多样性保持较好,但随着代次的增加,部分位点已出现纯合状态,这提示出饲养过程仍存在未实现随机交配与近交的状况发生,这是封闭群经常出现的问题。封闭群实验动物在保种繁殖的过程中,为了避免近交系数上升过快,要维持足够的有效群体含量,而保证群体有效含量的方法就是在封闭群中各家系内广泛选留种用个体。剖腹产净化建群的过程,即一次留种过程,选种需要在原群体中广泛选育,才能尽可能地保持原群体的遗传多样性,同时,定期的遗传监测与严格的避免近交操作在封闭群饲养管L中是必要的。根据遗传检测结果,此次净化后的豚鼠种群在遗传上符合封闭群实验动物遗传特征。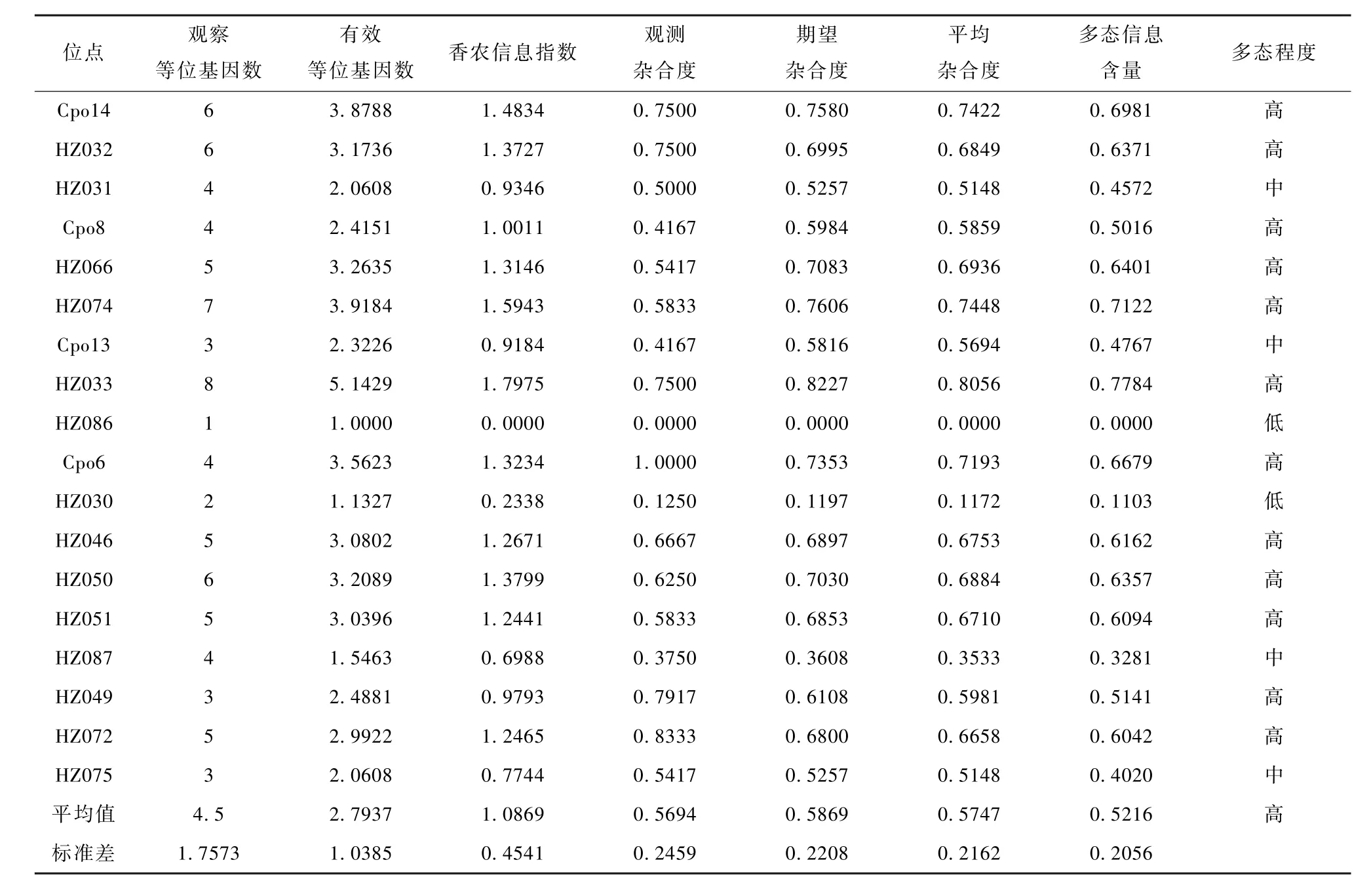
3 讨论
