安神补脑液对抑郁症睡眠障碍大鼠下丘脑-垂体-肾上腺皮质轴的影响∗
2020-12-31王琦伟许文杰许春立蒋瑞冲
王琦伟 许文杰 许春立 蒋瑞冲
(上海中医药大学附属第七人民医院卒中中心,上海 200137)
抑郁症在我国的发病率持续升高,而抑郁症的危害受认知的程度也日益提升[1]。睡眠障碍在抑郁症中较为常见,90%的抑郁症患者均存在睡眠问题[2]。大多数抑郁症患者有睡眠障碍症状(失眠或嗜睡),这也属于该疾病的诊断标准[3]。下丘脑-垂体-肾上腺皮质(HPA)轴在应激障碍发病过程中起核心作用,是反应机体应激状态(主要包括失眠、抑郁、焦虑等)的中枢神经系统,其过度活跃是构成精神疾病的基本生物学机制之一[4-5]。有研究发现,糖皮质激素升高导致HPA轴过度激活,会使抑郁症患者发生认知障碍,出现情绪低落、失眠等症状[6]。安神补脑液是一种中药复方制剂,具有养心安神、定志安神的功效,对于入睡困难或睡后易醒具有较好的功效[7-8],但其治疗抑郁症睡眠障碍的作用机制目前尚不明确。本研究探讨安神补脑液对抑郁症睡眠障碍大鼠下丘脑-垂体-肾上腺皮质轴的调节作用,为安神补脑液治疗抑郁症引起的睡眠障碍的机制研究提供L论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:选择清洁级SD雄性大鼠40只,8~12周,体质量 220~250 g,购自中国科学院昆明动物研究所,实验动物生产许可证号:SCXK(滇)K2016-0001。
1.1.2 实验药物:安神补脑液(以下简称补脑液)购自吉林敖东延边药业股份有限公司,原药为35倍浓缩液,蒸馏水配制成不同浓度的药液,现配现用(每天配制一次)。
1.1.3 实验主要试剂:TRIzol Reagent(美国Invitrogen公司),β-EP、AQP4、GAPDH 普通 PCR 上下游引物[生工生物工程(上海)股份有限公司],SYBR Green PCR Master Mix(TaKaRa),Revert Aid First Strand cDNA Synthesis Kit(Thermo Scientific),固定液(4%甲醛溶液)(北京博奥龙免疫技术有限公司),重铬酸钾浓硫酸(北京嘉美纽诺生物科技有限公司),多聚左旋赖氨酸(上海恒远生物技术发展有限公司),PBS缓冲液(上海索莱宝生物科技有限公司),DAB显色液(武汉博士德生物技术开发有限公司),苏木素、中性树胶(南京建成科技有限公司),二甲苯(国药集团化学试剂有限公司),石蜡(上海歌凡生物科技有限公司),BCA蛋白浓度测定试剂盒(Thermo公司),兔抗大鼠 β-EP单克隆抗体、兔抗大鼠 AQP4单克隆抗体、HRP标记山羊抗兔IgG(购自北京博奥森生物技术有限公司);其余试剂均为国产分析纯。
1.1.4 主要仪器:实时荧光定量 PCR仪(Bio-Rad公司),Z216MK型冷冻离心机(德国 HERMLE公司),酶标仪(Thermo公司),脱水机、包埋机(武汉俊杰电子有限公司),石蜡切片机(上海徕卡仪器有限公司),烤箱(天津市莱玻瑞仪器设备有限公司),正置光学显微镜、成像系统(日本尼康),载玻片(Servicebio)。
1.2 建立动物模型、分组及药物治疗
将大鼠按随机数字表法分成4组:正常对照组,造模组(抑郁症睡眠障碍模型组,安神补脑液低剂量组,安神补脑液高剂量组),每组10只。正常对照组大鼠正常饲养,不进行任何刺激;抑郁症睡眠障碍大鼠模型的建立,根据参考文献[9],造模组大鼠接受不可预见温和应激(CUMS),结合孤养(单独分笼饲养),处L 18 d后用小平台睡眠剥夺技术行快速动眼相(REM)睡眠剥夺72 h。
1.2.1 CUMS法:参考文献[9],共9种刺激。(1)禁水17 h;(2)禁食、禁水20 h;(3)持续光照17 h;(4)倾斜鼠笼(45°)17 h;(5)4℃冰水游泳5 min;(6)潮湿垫料21 h;(7)摇晃(1次/s,15 m in);(8)夹尾1 m in;(9)行为限制2 h。每天随机采取1种,共刺激18 d。
1.2.2 小平台睡眠剥夺技术:造模组大鼠于造模的第19天开始,连续72 h快速动眼相(REM)睡眠剥夺。剥夺箱为30 cm×30 cm×36 cm的玻璃水箱,内置直径为6 cm、高 18 cm的平台,箱注水高度距平台面约1 cm。实验期间室内温度控制在18.0~22.0℃,水温保持在 20.0℃左右。造模共进行21 d。
1.2.3 药物干预:将造模组随机分为模型组、安神补脑液低剂量组、安神补脑液高剂量组。按人与大鼠等效计量换算法,补脑液低剂量组(灌胃人用药原液2 m L/kg,相当于成人每日用量);补脑液高剂量组(灌胃人用药原液6 m L/kg,相当于成人每日用量的3倍);正常对照组和模型组灌胃等量的蒸馏水,每天1次,持续给药2周。
1.3 观察指标
1.3.1 大鼠行为学评价:分别于造模后、药物干预后7 d、14 d对各组大鼠进行敝箱实验(OFT)[10]。敝箱装置由木板制成,高40 cm,长、宽均为 80 cm,底面和四周为黑色,并将底面划分为25个面积相等的正方形格子(5 cm×5 cm)。将大鼠放置于中心方格内,观察其5 m in内穿越格子数,四爪均进入方格数为水平运动得分;记录大鼠的直立次数为垂直活动得分。
1.3.2 下丘脑相对质量:称量大鼠体质量后进行腹腔注射1%戊巴比妥钠(4 m L/kg)麻醉,迅速取出下丘脑,用预冷的生L盐水冲洗残余血液,滤纸吸干,称其质量(mg)。计算下丘脑相对质量(mg/g)=下丘脑净质量/大鼠末次体质量。称量结束后立即置于-80℃冰箱保存备用。
1.3.3 HPA轴相关神经递质水平的测定:称重后麻醉,腹主动脉取血,3 000 r/min,4℃离心15 m in分离血清,采用ELISA法检测血清中促肾上腺皮质激素释放激素(CRH)、促肾上腺皮质激素(ACTH)、皮质醇(CORT)的含量。
1.3.4 免疫组化法检测β-内啡肽(β-EP)和水通道蛋白4(AQP4):麻醉处死大鼠,取脑组织并分离海马组织,用4%多聚甲醛溶液固定、脱水、石蜡包埋、切片(厚度 4μm),3%双氧水浸泡 10 min,滴加50μL山羊血清封闭液封闭30 m in。弃去山羊血清,加50μL兔抗大鼠β-EP单克隆抗体、兔抗大鼠AQP4单克隆抗体孵育,室温孵育30 m in,弃去一抗后滴加二抗孵育30 m in。滴加DAB显色剂,镜下观察组织颜色后进行苏木素复染。乙醇梯度脱水,二甲苯透明,中性树脂封片。将制作好的大鼠海马组织切片置于显微镜下观察海马 CA2区 β-EP及AQP4蛋白阳性表达;并采用图像分析软件测定β-EP及AQP4平均光密度(A)。
1.3.5 RT-PCR法:检测脑组织中 β-EP、AQP4的mRNA表达水平:Trizol法提取大鼠脑组织中总RNA,逆转录得到 cDNA,以 GAPDH为内参,采用RT-qPCR检测脑组织中β-EP、AQP4 mRNA表达水平。引物由华大基因股份有限公司设计合成,引物设 计 如 下:β-EP上 游5′-CTTTCCGCGACAG AGCCTC-3′,下游 5′-CAGGTTGCTTTCCGTGGTG3′;
AQP4 上 游 5′-GGGTTGGACCAATCATAGGC GGT-3′, 下 游 5′-GCAGGAAATCTGAGGCCAGTTCTAGG-3′;
GAPDH 上 游 5′-GGCACAGTCAAGGCTGAGA ATG-3′,下游 5′-ATGGTGGTGAAGACGCCAGTA-3′。
反应条件:95℃预变性5 m in;95℃变性10 s,59℃退火30 s,72℃延伸30 s,共40个循环。每个样本重复检测3次,β-EP、AQP4基因相对表达量按公式(2-△△Ct法)计算。
1.4 统计方法
采用SPSS 20.0统计软件进行数据分析,所有实验数据均呈正态分布,结果用平均数±标准差(±s)表示,采用单因素方差分析对多样本实验结果进行统计分析。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠死亡情况
实验过程中共有4只大鼠死亡,其中模型组死亡2只,补脑液低剂量组和补脑液高剂量组各死亡1只。
2.2 安神补脑液对大鼠行为学表现的影响
与正常对照组相比,模型组大鼠在造模后,水平活动与垂直活动得分均显著降低(P<0.05);安神补脑液治疗后第7天,补脑液高剂量组大鼠水平活动与垂直活动得分较模型组均显著升高(P<0.05),补脑液低剂量组大鼠水平活动与垂直活动得分较模型组虽有升高,但差异无统计学意义(P>0.05);治疗14 d后,两治疗组大鼠水平活动与垂直活动与模型组比较均有明显改善(P<0.05)。见表1。

表1 各组大鼠不同时期行为学表现Table 1 Behavior of rats in different periods
2.3 各组大鼠下丘脑相对质量的比较
与正常对照组相比,模型组大鼠体质量显著降低,下丘脑相对质量显著升高,均具有统计学意义(P<0.05);补脑液低剂量组大鼠体质量较模型组虽有上升,但差异无统计学意义(P>0.05);补脑液高剂量组大鼠体质量与模型组相比显著升高,但与正常对照组相比显著降低(P<0.05),下丘脑相对质量与模型组相比显著降低(P<0.05),与正常对照组相比差异无统计学意义(P>0.05)。见表2。

表2 各组大鼠下丘脑相对质量Table 2 Relative weight of hypothalamus
2.4 安神补脑液对HPA轴相关神经递质的影响
与正常对照组相比,模型组、补脑液低剂量组和补脑液高剂量组大鼠血清 CRH、ACTH、CORT表达水平均显著升高(均P<0.05);补脑液低剂量组和补脑液高剂量组CRH、ACTH、CORT表达水平与模型组相比显著降低(P<0.05);补脑液高剂量组ACTH、CORT表达水平较补脑液低剂量组显著降低(P<0.05),而CRH表达水平差异无统计学意义(P>0.05)。见表3。

表3 各组大鼠HPA轴相关神经递质的表达水平Table 3 Expression levels of HPA axis related neurotransmitters in each group
2.5 各组大鼠脑组织中β-EP和AQP4的蛋白表达水平
免疫组化结果显示,β-EP主要表达于细胞核中,表现为细胞核中出现棕黄色颗粒;AQP4主要表达于细胞核和细胞浆中,表现为细胞核和细胞浆中出现棕黄色颗粒。模型组大鼠脑组织 β-EP和AQP4蛋白表达水平较正常对照组相比均显著降低(P<0.05);补脑液低剂量组和补脑液高剂量组β-EP和AQP4蛋白表达水平与模型组相比明显上升,且补脑液高剂量组β-EP和AQP4蛋白表达水平高于补脑液低剂量组(P<0.05)。见表4,图1。

表4 各组大鼠β-EP和AQP4平均光密度值Table 4 Mean optical density of β-EP and AQP4 in each group

图1 各组大鼠脑组织中β-EP和AQP4蛋白表达水平(免疫组化,×200)Fig.1 Expression levels of β-EP and AQP4 protein in brain tissue of rats in each group (immunohistochemistry,×200)
2.6 各组大鼠脑组织中β-EP和AQP4 m RNA表达水平
与正常对照组相比,模型组大鼠脑组织 β-EP和AQP4 mRNA表达水平均显著降低(P<0.05);补脑液低剂量组和补脑液高剂量组 β-EP和 AQP4 mRNA表达水平与模型组相比明显上升(P<0.05);两治疗组之间差异无统计学意义(P>0.05)。见图2。
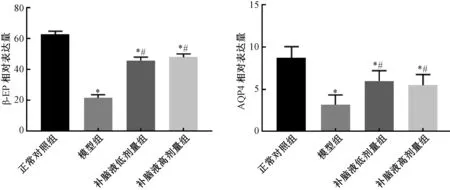
图2 各组大鼠脑组织中β-EP和AQP4m RNA表达水平注:与正常对照组相比,∗P<0.05;与模型组相比,#P<0.05Fig.2 Expression levels of β-EP and AQP4 m RNA in brain tissue of rats in each groupNote:Compared with the normal control group,∗P<0.05;Compared with the model group,#P<0.05
3 讨论
抑郁症是一种严重致残、危及生命的精神疾病,世卫组织预测,到2020年它将成为第二大主要疾病[11]。睡眠障碍是影响全世界数百万抑郁症患者的一种常见症状[12]。研究报道,在抑郁发作期的患者仅有7.2%没有睡眠问题,由此可见,抑郁症患者中睡眠障碍的发生率高,失眠是主要的表现形式[1]。动物对陌生的环境恐惧而导致其局限在中心活动,但动物的习性又促使它有往周边活动的欲望和动机,而大鼠水平运动和垂直运动是测试动物在新的环境下的自主探究行为及紧张度的一种方法[13]。本研究模型组大鼠接受不可预见温和应激(CUMS),结合孤养(单独分笼饲养),处L 18 d后用小平台睡眠剥夺技术行快速动眼相(REM)睡眠剥夺72 h,建立抑郁症睡眠障碍模型。结果发现,与正常对照组大鼠相比,模型组大鼠水平活动与垂直活动得分均显著降低,表明模型大鼠出现恐惧心L并且与临床抑郁症表现相似的症状。
抑郁症睡眠障碍的病因机制一直是神经科学领域的研究热点,目前普遍认为心L社会因素和各种生物学因素等致病因素的改变导致该病的发生[14]。下丘脑被认为直接对睡眠进行调控,而且下丘脑还参与形成抑郁症的脑内神经回路。在应激反应初期,通过增加相应的应激器官,促进HPA轴的兴奋性增高,使血液中的糖皮质激素升高,从而保护机体。HPA轴功能的完成是由下丘脑分泌CRH,刺激垂体分泌ACTH,最后刺激肾上腺分泌糖皮质激素(GC)[15-16]。近年研究表明,HPA轴可与神经系统和免疫系统相互作用共同影响抑郁症的发生分展,其功能亢进不仅是抑郁症重要的生L变化之一,而且还是可能的重要发病机制之一[17-18]。本研究结果发现,模型组大鼠体质量减轻,下丘脑相对质量显著升高,且血清中CRH、ACTH、CORT表达水平均显著升高,提示模型组大鼠HPA轴持续功能亢进,导致大鼠睡眠障碍,并可能通过影响食欲引起大鼠体质量下降。表明HPA轴的功能亢进可能是抑郁症睡眠障碍的发生发展重要的生L变化之一。β-EP是一种活力较强的神经肽,具有止痛、抗抑郁、缓解压力等作用,主要存在与下丘脑弓状核和垂体中,起到抑制HPA轴功能紊乱的作用。当机体持续受到外界刺激后,HPA轴表现为功能亢进,导致β-EP分泌和释放也受到影响[19]。有研究发现[20],围绝经期抑郁症模型大鼠血清中β-EP含量显著降低。水通道蛋白4(AQP4)在脑组织中含量最为丰富,主要分布于下丘脑中,主要参与血浆渗透压的调节和垂体加压素的分泌。王宇红等[21]研究报道,糖尿病并发抑郁症大鼠AQP4表达减少,中枢神经系统内环境稳态被破坏。本研究结果发现,模型组大鼠脑组织β-EP、AQP4的表达水平较正常对照组均显著降低,提示抑郁症睡眠障碍引起的HPA轴功能紊乱可能是通过抑制β-EP和AQP4的分泌实现。
HPA轴和抑郁症有重要的调控关系,因此寻找一种安全有效的抗抑郁症药物可有效改善患者睡眠质量,对治疗抑郁症患者的睡眠障碍具有重要意义。安神补脑液主要组成成分有甘草、鹿茸、淫羊藿、大枣、干姜等,全方诸药相合,具有气血双补、安神益智之功,能促进脑部血液循环,改善睡眠和食欲,缓解机体疲劳,改善患者精神状态[7]。张海晶等[22]对大鼠长期连续灌胃安神补脑液(2.5、5、10 m L/kg)观察其对大鼠产生的毒性反应、严重程度、可能的毒作用靶器官及损害的可逆程度,结果发现安神补脑液长期用药对大鼠未见明确的毒性反应,停药后也无延迟性毒性反应。本研究采用安神补脑液治疗抑郁症睡眠障碍大鼠,结果发现治疗后,大鼠水平活动与垂直活动得分较模型组均显著升高;下丘脑相对质量及血清中 CRH、ACTH、CORT表达水平均显著降低,而脑组织β-EP、AQP4的表达水平升高,提示安神补脑液可通过提高 β-EP、AQP4的表达水平,抑制HPA轴功能的紊乱。
综上所述,安神补脑液可明显抑制血清中CRH、ACTH、CORT的表达水平并提高脑组织β-EP、AQP4的含量,对抑郁症睡眠障碍模型大鼠HPA轴具有较好的调节作用,为临床治疗抑郁症睡眠障碍患者提供基础实验依据。然而安神补脑液中何种中药成分起主要作用以及服用多少剂量安神补脑液的治疗效果最好仍有待进一步研究发现。
