参附注射液对内毒素休克大鼠肺组织表达PPARγ和TNFα的干预作用∗
2020-12-31褚春薇陈向云郭俊峰
褚春薇 艾 飞 陈向云 郭俊峰 杨 毅 刘 霞
(1.贵州中医药大学基础医学院,贵阳 550025)(2.贵州中医药大学第二临床医学院,贵阳 550025)
内毒素休克是临床常见的感染性急危重症,内毒素休克患者免疫系统被过度激活,释放大量炎性介质,尽管运用抗生素和糖皮质激素治疗取得一定疗效,但其致死率仍居高不下,且抗生素耐药问题也越来越严峻[1]。内毒素休克患者中,约50%伴随着急性肺损伤(ALI),甚至发展为急性呼吸窘迫综合征(ARDS),这也是内毒素休克的关键致死性因素,因此治疗内毒素休克过程中,缓解急性肺损伤也极为重要[2]。
过氧化物酶体增殖物激活受体(PPARγ),属Ⅱ型核受体超家族成员,可参与脂类代谢、糖代谢、细胞分化和凋亡等多种生L和病L反应的调节[3]。研究证实,LPS所致的ALI通常伴随着PPARγ的表达减少,核转录因子 κB(NF-κB)信号通路活化及TNFα和白细胞介素1β(IL-1β)等炎症介质过度释放[4];激活PPARγ可抑制 NF-κB通路活化,进一步抑制其下游炎症介质的释放,故PPARγ也成为治疗炎症的一个重要靶标,如PPARγ激动剂(如罗格列酮)用于治疗ALI具有良好疗效[5-6]。
内毒素休克属中医外感病“厥脱”范畴,参附注射液具有扶阳固脱的功效,临床上广泛用于治疗内毒素休克,且疗效确切,但其抗炎症机制还有待深入探究和补充[7-9]。参附注射液是否通过上调PPARγ的表达而发挥其抗炎作用,目前尚无确切报道。本实验通过建立内毒素休克大鼠模型,观察参附注射液对肺组织中PPARγ和TNFα的表达及血浆中炎症介质 TNFα和 IL-1β的影响,补充和完善参附注射液治疗内毒素休克ALI的机制。
1 材料与方法
1.1 实验动物
SPF级健康雄性 SD大鼠48只,体质量(200±20)g,购自广州中医药大学实验动物中心,实验动物生产许可证号:SCXK(粤)2013-0020。实验动物的饲养及实验方案经广州中医药大学实验动物伦L委员会批准。
1.2 主要药品与试剂
LPS,美国 Sigma公司,批号:20160920;参附注射液,雅安三九药业有限公司,批号:51020664;地塞米松,武汉艾美捷科技,批号:100129-201704;肝素,海通药业有限公司,批号:170212136;兔抗PPARγ、兔抗 TNFα,美国 CST 公司,批号:2435s、11948s;兔抗 GAPDH,美国 Abclone公司,批号:9100002004;羊抗 兔 IGg-HRP,美 国 Abcam 公 司,批 号:GR313248-1;BCA蛋白定量试剂盒,上海贝博生物试剂公司,批号:BB18121;大鼠 IL-1β、TNFα免疫酶联试剂盒,华美生物工程公司,批号:P002831、P005670;逆转录试剂盒,美国 Thermo Fisher公司,批号:AK6501;qPCR扩增试剂盒,天根生物有限公司,批号:FP209-02;ECL化学发光试剂盒,美国Millipore公司,批号:1801501;Trizol、蛋白酶抑制剂PMSF,上海碧云天生物技术公司,批号:101006、410051;戊巴比妥钠、多聚甲醛、甲醇和脱脂奶粉等购自深圳市建阳生物医药科技有限公司。
1.3 主要仪器设备
力康Neofuge1600R台式高速冷冻离心机;英国Astell Ama240高压灭菌锅;美国 EnSpire国多功能酶标仪;DHP-9012恒温培养箱;美国 PowerPac300电泳仪;美国BIO-RAD转膜仪、美国BIO-RAD荧光定量PCR仪;Tanon 5200全自动化学发光图像分析仪。
1.4 实验动物分组及处理
48只大鼠随机分为对照组(Con)、内毒素休克组(LPS)、参附注射液低剂量组(SFL,5 m L/kg)、参附注射液中剂量组(SFM,10 m L/kg)、参附注射液高剂量组(SFH,15 mL/kg)、地塞米松组(DXM,1 mg/kg),每组8只。腹腔注射35 mg/kg戊巴比妥钠麻醉后,暴露右颈总动脉,插管连接生物技能系统(BL-420)以检测血压。待血压稳定后,腹腔注射LPS 15 mg/kg,观察大鼠动脉压直至大鼠达到休克状态(以血压下降至基础血压的2/3为判断大鼠休克的指标)[10],对照组给予等量的生L盐水。动物休克后,立即对大鼠进行分组,腹腔注射药物,LPS组给予与药物组等体积的生L盐水。24 h后,心脏取血后处死动物,并迅速取出肺组织,生L盐水洗净,左肺用于 Western blot及 PCR分析,4%多聚甲醛固定右肺,用于形态学观察。血液静置1 h后4℃离心,收集上清(即血浆)于-80℃保存备用。
1.5 组织切片制作及观察
肺组织常规制备4μm厚的石蜡切片,经苏木精-伊红(HE)染色后镜下观察,每组随机观察3例大鼠,每张切片随机选5个高倍视野,观察肺泡充血、出血、肺泡间隔水肿及中性粒细胞浸润情况。
1.6 qPCR法检测肺组织PPARγm RNA水平
每只大鼠取肺组织20 mg,提取样品总 RNA,根据逆转录试剂盒说明书进行操作获取 cDNA。以cDNA为模板,按PCR扩增试剂盒操作,获取扩增产物。引物由上海生工设计合成,具体序列见表 1。反应程序为95℃反应5 s,60℃反应30 s,95℃反应15 s,收集荧光信号,共40个循环。每个样品重复检测三次,采用 2-ΔΔCt相对定量法(目的基因 Ct值/内参基因Ct值)对 PPARγmRNA表达进行相对定量,并将获得数据进行统计。

表1 PCR引物序列Table 1 Prim er sequence of PCR
1.7 W estern b lot法检测肺组织 PPARγ和 TNFα蛋白水平
每只大鼠取50 mg肺组织,加液氮研磨成粉末状,加含有蛋白酶抑制剂的RIPA裂解液冰上裂解30 m in,4℃离心,12 000 r/min 15 m in,取上清即为总蛋白。测定蛋白浓度后煮沸变性,按每条泳道30μg蛋白质量上样,经 SDS-PAGE凝胶电泳后转移至PVDF膜,5%脱脂奶粉封闭后对照Maker剪切目的条带,分别以兔抗 PPARγ(1∶1 000)、TNFα(1∶1 000)和兔抗 GAPDH(1∶5 000)4℃孵育过夜。次日用羊抗兔IgG室温孵育1 h后,滴加 ECL化学发光液,于全自动化学发光图像分析仪显影。实验重复三次,采用Image J软件将测得的各组灰度值与对应的内参值比较得出蛋白相对表达量。
1.8 血浆中TNFα和L-1β含量测定
用ELISA法对大鼠血浆中所含 TNFα和 IL-1β水平进行测定,每例样品设置三个平行复孔,测定方法严格按照试剂盒操作说明步骤进行。将所得A值减去0浓度对照孔后,以标准品的A值绘制标准曲线图,获得浓度计算公式,根据公式与样品A值计算样品浓度。
1.9 统计方法
用Graphpad Prism 5.0软件包对所得结果进行统计,统计结果用均数±标准差(±s)表示。多组间比较采用单因素方差分析,两两比较用t检验,采用Graphpad Prism 5.0对统计结果作柱状图,P<0.05表示差异具有统计学意义。
2 结果
2.1 各组大鼠肺损伤情况
镜下观察,正常组大鼠肺组织结构清晰,肺泡间隔薄,无明显充血、出血和炎性细胞浸润(图 1A)。模型组大鼠肺组织(图1B),可见肺泡隔明显水肿、充血(箭头),肺间质内见大量中性粒细胞浸润(□)。与模型组比较,地塞米松组(图1C)、参附注射液中剂量组(图1E)及参附注射液高剂量组(图1F)均能明显改善水肿、充血及炎性细胞浸润程度,参附注射液低剂量组(图1D)对肺组织的改善不如中、高剂量组,提示参附注射液中、高剂量均可减轻LPS所致的肺组织损伤及肺部炎症反应,三种剂量不完全呈剂量效应关系,以中剂量效果最优。

图1 各组大鼠肺组织结构(HE)注:□表示炎性细胞,→表示充血Fig.1 Lung tissue structure of rats in different groups(HE)Note:□point inflammatory cells and (→)point congestion
2.2 各组大鼠肺组织中PPARγm RNA水平检测
经qPCR对内毒素休克大鼠肺组织中PPARγ mRNA水平进行检测,结果见表2,LPS的刺激使PPARγmRNA水平显著降低(P<0.01),参附注射液呈剂量依赖性增加PPARγmRNA转录水平。

表2 各组大鼠肺组织中PPARγm RNA 水平检测结果Table 2 Detection of PPARγm RNA in lung tissue of rats in different groups
2.3 各组大鼠肺组织 PPARγ和 TNFα表达量检测
经Western blot方法对内毒素休克大鼠肺组织中PPARγ和 TNFα蛋白进行半定量检测,结果见图2和表3,与正常组比较,LPS抑制 PPARγ表达(P<0.01),同时促进TNFα表达(P<0.01)。与LPS组相比,参附注射液呈剂量依赖性上调PPARγ的表达,同时显著抑制TNFα的表达(P<0.01)。

图2 各组大鼠肺组织PPARγ和TNFα蛋白电泳图Fig.2 Electrophoretic map of PPARγ and TNFα protein expression in lung tissue of rats in different groups

表3 各组大鼠肺组织PPARγ和TNFα蛋白表达检测结果Table 3 Expression of PPARγ and TNFα in lung tissue of rats in different groups
2.4 各组大鼠血浆中TNFα和IL-1β水平检测
经Elisa法检测内毒素休克大鼠血浆中TNFα和IL-1β分泌水平,结果见表4,LPS的刺激使血浆中TNFα和IL-1β水平均显著增加(P<0.01),地塞米松组与参附注射液各剂量组血浆 TNFα和 IL-1β水平较LPS组显著降低(P<0.01)。
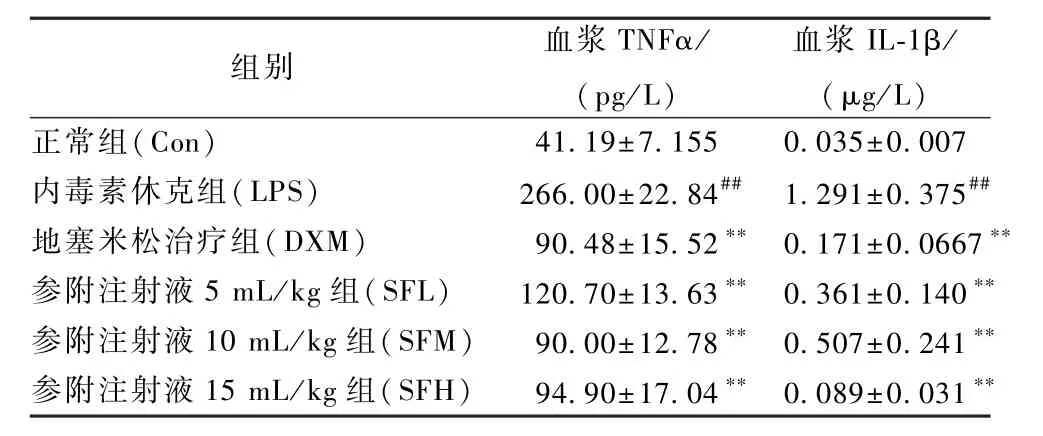
表4 各组大鼠血浆TNFα和IL-1β浓度Table 4 Plasm a concentrations of TNFα and IL-1β in rats
3 讨论
流行病学调查显示,约1/2内毒素休克患者伴有急性肺损伤,其病L特征是毛细血管通透性增加和肺组织过度炎症,内毒素血症患者由早期的急性肺损伤(ALI)进一步引起严重急性呼吸窘迫综合征(ARDS),这是导致内毒素休克高死亡率的主要原因之一[2]。目前认为,ALI/ARDS为多器官功能不全的肺部表现,其实质就是一种炎症反应,多种炎症介质和细胞因子如 TNFα、IL-1、IL-6、IL-8、趋化因子、黏附分子和前列腺素等参与发病过程,控制炎症介质的级联放大效应也成为治疗感染性休克的重要手段[11]。
PPAR是核激素受体家族成员,包括 PPARα、PPARβ和PPARγ三种亚型,其分布和功能不尽相同。其中,PPARγ广泛表达于脂肪组织、结肠、成纤维细胞、乳腺细胞、T淋巴细胞和单核巨噬细胞,作为一个配体激活转录因子,PPARγ除参与机体脂肪代谢、细胞生长与分化外,还参与调节机体免疫和炎症反应[12-13]。人类的 PPARγ具有抗感染特性,它们对炎症介质具有负反馈调节作用,可抑制炎症介质的产生[14]。研究发现,LPS的刺激可使肺组织中PPARγ表达降低,可能促进肺部炎症反应和组织损伤,且PPARγ的激活有利于肺组织损伤的转归,可见PPARγ可作为治疗肺损伤的重要靶标[15]。
参附注射液组方源自《伤寒论》四逆加人参汤,此方以红参为君药,可补阳固脱、益气回阳,为健脾补肺、扶正补虚之要药;附片益火补阳,温通十二经之阳气,助君相之火破寒结之痹,是为臣药;两药合用,可救人于濒危之中,回阳于阴厥之时,故常用于感染性、失血性休克等亡阳之症[7-9]。前期已有不少关于参附注射液治疗 ALI的实验研究,大多以NF-κB信号通路为研究对象,认为参附注射液可通过抑制NF-κB信号通路蛋白,从而抑制其下游炎症介质的产生[16-19]。参附注射液对 ALI的治疗作用是否与其对 PPARγ的调控有关,目前未见相关报道。
本研究首先从组织学角度观察了参附注射液对内毒素所致肺损伤的保护作用:参附注射液可减轻LPS所致的肺泡隔水肿、充血和炎性细胞浸润,为参附注射液保护内毒素急性肺损伤提供了很直观的组织学依据。其次本研究关注PPARγ在内毒素休克肺组织中的转录和表达及参附注射液对其的干预作用:LPS使得大鼠肺组织中PPARγ转录和表达均下调,而参附注射液呈剂量依赖性上调其转录和表达;随着PPARγ的上调,肺组织中的TNFα和血浆中两种促炎因子分泌均显著下降;提示参附注射液对ALI的治疗作用及其对炎症介质的抑制作用至少部分依赖于上调PPARγ的表达。本研究对参附注射液治疗ALI的分子机制进行探索,丰富了其抗炎机制的L论依据。
