二次回归正交旋转组合设计优化富含γ-氨基丁酸豆酱制曲工艺
2020-12-31李冬龙李拂晓葛艳静谢彩锋刘继栋杭方学
李冬龙,李拂晓,葛艳静,谢彩锋,刘继栋,杭方学*
1(广西大学 轻工与食品工程学院,广西壮族自治区 南宁,530004)2(蔗糖产业省部共建协同创新中心,广西大学, 广西壮族自治区 南宁,530004)
豆酱是一类以豆类为主要原料,利用微生物发酵制得的调味品,具有适口的咸、鲜等滋味,广泛流传于中国、日本、韩国等东亚国家和地区[1]。豆酱生产可分为制曲及制酱两部分,其中制曲阶段主要通过微生物代谢活动产生蛋白酶[2]、淀粉酶[3]等以降解基质,制酱阶段通过长时间发酵形成豆酱的特有风味[4]。当前,豆酱生产多以自然发酵为主,难以满足工业化生产所需的高效、快捷及品质稳定等要求。针对此问题,学者在豆酱发酵工艺控制[5]、发酵菌种选育[6]进行了诸多研究。然而,对功能性豆酱制品的研发尚处于初级阶段。
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种中枢神经的抑制性神经递质,具有降血压[7]、抗抑郁[8]、缓解体力疲劳[9]、防老年痴呆[10]、改善睡眠[11]等诸多作用,其食品安全性已得到广泛验证。在生物体内,GABA主要由谷氨酸经谷氨酸脱羧酶脱羧所得[12],其产量受限于基质中的游离氨基酸含量。而豆酱制曲通过酱曲中的米曲霉等微生物活动分泌蛋白酶降解酱曲中的蛋白质,为微生物活动及产品提供氨基酸态氮,蛋白酶活性的高低很大程度决定了产品的品质。在常规工艺条件下,豆酱中可检测到痕量的GABA[13],制曲工艺的差异也会导致GABA含量波动性变化。研究还表明,基质中的碳源种类对豆酱风味形成[5]和GABA积累[14]有一定影响,如HAJAR-AZHARI等[15]和WAN-MOHTAR等[16]发现添加外源天然糖对米曲霉富集GABA有促进作用。因此,本实验拟通过制曲工艺及基质成分优化实现GABA在豆酱制品中的参数可控调节。基于此,本研究拟通过豆酱制曲工艺及培养基质中碳源优化,考察对蛋白酶酶活、GABA含量及谷氨酸含量的影响。在此基础上,使用二次回归正交旋转组合设计分析各因素及其交互作用获得最优的制曲条件,实现高蛋白酶活力酱曲中GABA的过量积累。
1 材料与方法
1.1 材料与试剂
大豆、糙米、香满园特一级小麦粉,广西南宁市冠超市;米曲霉孢子粉(Aspergillusoryzae3.042),上海佳民酿造食品有限公司。
L-酪氨酸、酪蛋白、Na2CO3、浓HCl、NaOH、三氯乙酸、蔗糖、NaH2PO4、Na2HPO4(均为分析纯);乙酸钠、硼酸(优级纯);福林酚试剂,北京索莱宝科技有限公司;谷氨酸标准品、γ-氨基丁酸标准品、邻苯二甲醛、β-巯基乙醇(纯度均>99%),上海麦克林生化科技有限公司;乙腈、甲醇(色谱纯),广东光华科技股份有限公司。
1.2 仪器与设备
SHZ-82A水浴恒温振荡器,金坛市医疗仪器厂;UV-1000紫外分光光度计,上海美谱达仪器有限公司;Cenlee 16R高速冷冻离心机,湖南湘立科学仪器有限公司;WK-800A高速药物粉碎机,青州市精诚机械有限公司;安捷伦1100高效液相色谱仪,安捷伦科技有限公司;BMJ-160C霉菌培养箱,上海博迅实业有限公司;电热恒温鼓风干燥箱,上海精宏实验设备有限公司;STARTER-3100酸度计、PWN124ZH电子天平,奥豪斯仪器有限公司;KQ-数控超声波清洗器,昆山市超声仪器有限公司。
1.3 实验方法
1.3.1 豆酱制曲工艺
将黄豆清净,去除较差外观黄豆,浸泡处理12 h去除豆腥味[17]。将浸泡后的黄豆蒸煮30 min,冷却至40 ℃后与一定比例小麦粉混合,接种0.1%米曲霉孢子粉于霉菌培养箱制曲,湿度设置为95%,温度控制为28~30 ℃,挑选最优小麦粉与黄豆配比发酵基质。优化试验则在最优小麦粉配比酱坯的基础上,依次添加不同比例糙米粉、蔗糖后制曲。
1.3.2 豆酱酱曲水分含量的测定
使用直接干燥法,参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》。
1.3.3 蛋白酶酶活测定
称取酱曲5 g,充分研磨后使用pH 7.2的10 mmol/L H3PO4缓冲溶液稀释至100 mL静置30 min,各取1 mL上清液置于40 ℃水浴中预热后测定酶活(以干曲重计算酶活)。蛋白酶活力测定依照国家标准GB/T 23527—2009 《食品安全国家标准 蛋白酶制剂》。蛋白酶活U定义:在40 ℃条件下,1 min水解酪蛋白生成1 μg酪氨酸定义为一个U。
1.3.4 酱曲中GABA与谷氨酸提取及测定
称取GABA、谷氨酸标准品各0.100 g,使用超纯水溶解至100 mL得1.0 mg/mL的GABA、谷氨酸混合标准储备液。使用标准储备液依次配制0.005、0.010、0.020、0.040、0.080、0.160、0.320 mg/mL的GABA、谷氨酸混合标准使用液。样品中GABA与谷氨酸提取方法在任佳秀等[18]的研究上改进,称取酱曲0.5 g,加入5 mL三氯乙酸溶液,超声提取30 min 2次,提取液经离心(10 000 r/min、10 min、24 ℃)后,取上清液经0.22 μm滤膜过滤至进样瓶,置于4 ℃冰箱待测。
衍生化试剂与衍生条件在王嘉怡等[9]的研究上改进,使用邻苯二甲醛(O-phthalaldehyde,OPA)柱前在线衍生法。OPA衍生剂配制:称取120.0 mg OPA,依次加入2 mL甲醇(色谱纯)、300 μL β-巯基乙醇及4 mL硼酸溶液(0.4 mol/L,pH 9.5)后经0.22 μm滤膜过滤于样品瓶中待用。使用安捷伦自动进样器实现在线衍生,程序进样在现有研究[19]上改进:吸取样品5 μL;不吸取清洗瓶超纯水;吸取OPA衍生剂5 μL;吸取清洗瓶超纯水;在空气中最大速度混合10 μL,不混合10次;等待2 min;进样。
色谱条件:色谱柱Agilent HC-C18(250 mm×4.6 mm,5 μm);流动相A为25 mmol/L乙酸钠溶液,流动相B为乙腈,梯度洗脱程序:0~5 min,流动相为90%A和10%B;5~20 min,B相由10%上升至35%;20~28 min,流动相保持65%A和35%B;在28~30 min,B相由35%降低至10%。检测条件:安捷伦VWD检测器,检测波长338 nm;柱温40 ℃;总进样量10 μL。
1.3.5 单因素试验
按照1.3.1进行制曲。糙米添加量对酱曲品质的影响试验为:蔗糖添加量固定为6%(质量分数),制曲时间固定为60 h,糙米添加量设定为黄豆质量的0%、8%、16%、24%和32%;蔗糖添加量对酱曲品质的影响试验:糙米添加量固定为16%(质量分数),制曲时间固定为60 h,蔗糖添加量设定为总质量的0%、3%、6%、9%及12%;制曲时间对酱曲品质的影响试验:糙米添加量固定为16%,蔗糖添加量固定为6%,制曲时间设定为36、48、60、72、84 h。以蛋白酶酶活、GABA含量及谷氨酸含量为指标,判定最佳单因素条件。
1.3.6 二次回归正交旋转组合设计试验
根据单因素实验研究结果确定糙米粉添加量、蔗糖添加量及制曲时间3个因素的水平编码范围,以蛋白酶酶活、GABA含量和谷氨酸含量为响应值,试验因素与水平设计见表1。

表1 因素水平编码表Table 1 Coded levels for independent variables
1.4 数据统计分析
所有数据均为3次平行,使用SPSS 26.0和Origin 9.5对数据进行处理及显著性分析,使用Design Expert 10设计二次回归正交旋转组合设计试验,使用Illustrator 23.0.2软件制图。
2 结果与分析
2.1 基础发酵基质选择
酱坯提供了微生物增殖及产酶所需的营养成分,通常情况下,酱坯由黄豆与淀粉按一定比例复配而成。已有的报道证明,淀粉来源及其与黄豆的复配比例对制曲效果有较大的影响[3]。本研究选择小麦粉为基础碳源,结果表明,随小麦粉添加量的增加,酱曲蛋白酶活性呈现明显下降的趋势,且制曲时间表现出一定程度延长。如m(黄豆)∶m(小麦粉)=10∶2时,制曲48 h时达到最大酶活522.86 U/g,当m(黄豆)∶m(小麦粉)=10∶6 时,制曲60 h时达到最大酶活仅为213.91 U/g (P=0.000 01<0.01)(图1-a)。小麦粉持续补充导致蛋白酶活性下降可能是由于基质中碳氮源比例失衡,影响微生物的繁殖代谢过程。同时,小麦粉的颗粒细小,较大比例加入可能使酱曲表面过于紧实而不易透气,影响米曲霉的生长,从而导致蛋白酶分泌不足[20]。本研究同时跟踪检测了制曲过程中基质的含水量变化,不同复配比例下,基质含水量的变化差异较小。随制曲时间的增加,基质含水量因菌体利用和生物热蒸发等原因而迅速下降,制曲至60~72 h时,酱曲水分含量均降低至25%(质量分数)以下,此现象与刘颖等[21]制备高活性酱曲水分含量变化相似。此外,制曲后期蛋白酶活性呈现下降趋势,可能为水分含量下降影响了菌体的生命活动所致。由于米曲霉产酶最适水分含量在40%~50%[22],故综合考虑后本研究选择m(黄豆)∶m(小麦粉)=10∶2的坯制备基础酱坯。
2.2 单因素试验结果
2.2.1 糙米对酱曲中蛋白酶酶活、GABA含量及谷氨酸含量的影响
通常情况下,小麦粉是酱曲中的主要碳源,而碳氮源种类是影响米曲霉生长及富集GABA的重要因素。在本研究中,把富集GABA常用的糙米作为额外碳源,为制曲过程实现高GABA积累提供便利。研究结果表明,未添加糙米组酱曲酶活最高722.82 U/g,其余组酶活随糙米添加量增加不断降低,当添加32%(质量分数)糙米时,制曲结束时酱曲酶活最低仅为386.45 U/g(P=0.000 1<0.01) (图2-a)。糙米加入导致蛋白酶活性下降可能为糙米以粉末状加入基质,使酱曲表面不易透气,抑制微生物生长导致酶活降低。同时对GABA含量的观测发现,虽然未添加糙米组酱曲酶活较高,但GABA含量相对较低,为0.105 mg/g,当添加8%、16%糙米时GABA含量差异较小,达到最大值0.146 mg/g (P<0.01)。本研究还发现,糙米添加量的改变对谷氨酸含量影响较小。故综合考虑后选择添加8%糙米为优化试验中心点。

a-蛋白酶酶活变化;b-水分含量变化图1 不同黄豆与小麦粉比例酱坯制曲中蛋白酶酶活及水分变化Fig.1 Protease activity and water content changes in different proportion of soybean and wheat flour
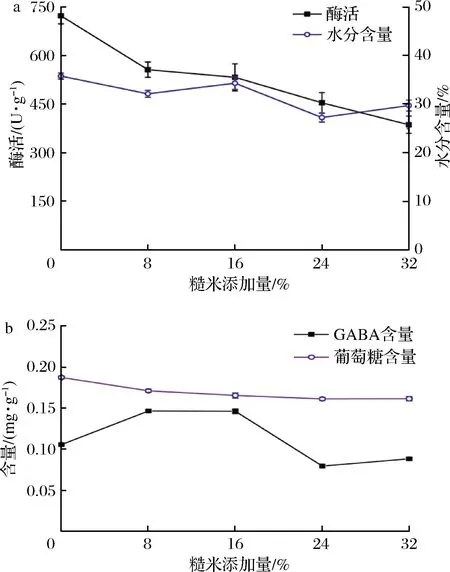
a-蛋白酶酶活变化;b-GABA、谷氨酸含量变化图2 糙米添加量对酱曲品质的影响Fig.2 The effect of the amount of brown rice on the quality of soybean koji
2.2.2 蔗糖对酱曲中蛋白酶酶活、GABA及谷氨酸含量的影响
传统制曲通常采用淀粉为碳源,米曲霉等制曲微生物需合成淀粉酶以降解淀粉为可利用糖,一定程度上增加了菌体负荷。在酱坯中添加适量蔗糖可为微生物生长提供速效碳源,方便微生物的快速增殖。研究结果显示,酱曲酶活随蔗糖添加量的增加呈现先上升后下降的趋势,并在添加6%(质量分数)蔗糖时达到最大536.18 U/g (P<0.01) (图3-a)。对GABA含量的检测发现,在添加0~12%蔗糖,GABA含量随蔗糖增加呈现先上升后下降的趋势,在添加6%蔗糖时GABA含量达到最大0.151 mg/g且酶活力最高(P<0.01) (图3-b)。添加少量蔗糖促进米曲霉生长使酶活上升,可能是增加了易代谢碳源,促进了微生物生长,而添加高比例蔗糖后导致渗透压上升,不利于微生物生长导致酶活降低。添加3%蔗糖时,出现酶活较低但GABA含量较高的原因可能为易代谢碳源的加入导致微生物过量增殖,菌体的氮代谢通路较旺盛但胞外酶分泌量减少。谷氨酸含量在添加3%蔗糖时达到最大,随后随蔗糖添加量的增加而不断降低(P<0.01)。故综合考虑后选择添加6%蔗糖为优化试验中心点。
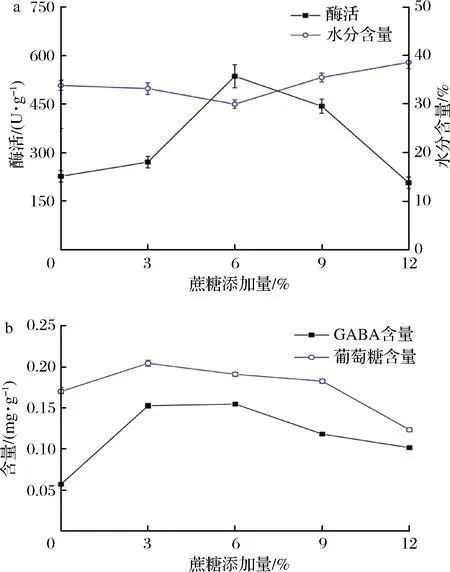
a-蛋白酶酶活变化;b-GABA、谷氨酸含量变化图3 蔗糖添加量对酱曲品质的影响Fig.3 The effect of the amount of sucrose on the quality of soybean koji
2.2.3 制曲时间对酱曲中蛋白酶酶活、GABA含量及谷氨酸含量的影响
制曲时间长短决定酱曲的品质,通常酱曲的最大酶活出现在制曲48 h后[23],同时,在最大酶活点后,因菌体数量增多且酱坯中营养物质出现短缺,不利于微生物生长而导致酶活呈现下降趋势。在本研究中,酶活随着制曲时间延长呈现先上升后下降趋势,在60 h达到最大酶活605.79 U/g,在36 h时最小仅为433.84 U/g (P=0.003 22<0.01) (图4-a)。而制曲过程中酱曲的水分含量变化也与现有研究相似,呈现不断下降趋势[21]。此外,随着制曲时间延长,GABA含量呈现先上升后下降趋势,在制曲60 h时达到最大值0.165 mg/g (P<0.01)。GABA含量呈现与酶活相似的变化趋势,可能是蛋白酶降解的部分游离氨基酸参与了GABA的代谢通路[24]。此时酱曲中的GABA含量与XU等[13]豆酱成品中0.260~3.010 mg/g相比仍较低。但与CAI等[14]发现利用米曲霉的制曲过程可提升发酵基质的GABA含量相吻合。此外,制曲时间对谷氨酸含量影响相对较小,由36 h的0.130 mg/g上升至48 h的0.138 mg/g后降低至0.125 mg/g。在综合考虑GABA含量及酶活后,选择制曲时间60 h为优化试验中心点。
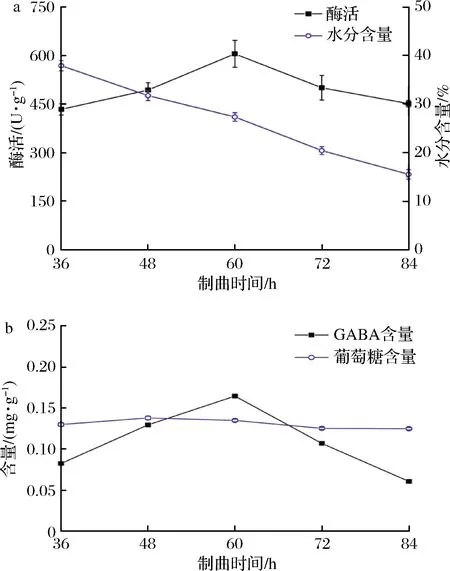
a-蛋白酶酶活变化;b-GABA、谷氨酸含量变化图4 制曲时间对酱曲品质的影响Fig.4 The effect of the amount of making koji time on the quality of soybean koji
2.3 二次回归正交旋转组合设计试验结果
2.3.1 二次回归正交旋转组合设计试验结果
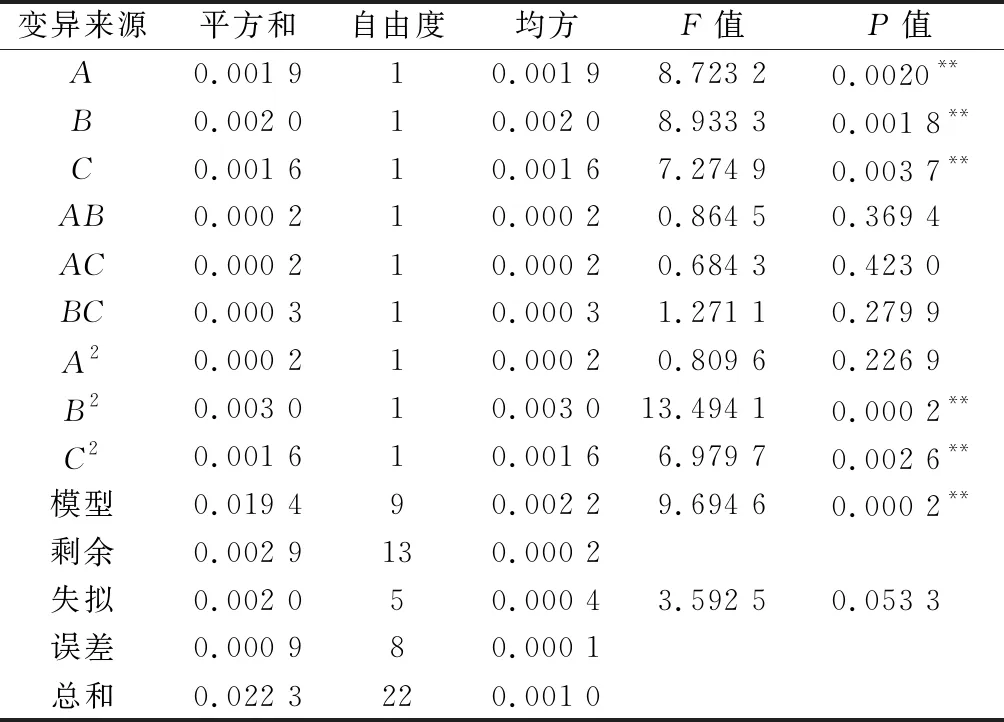
根据图2~图4的单因素试验结果,选取糙米添加量(A)、蔗糖添加量(B)、制曲时间(C)作为3因素,以蛋白酶酶活(Y1)、GABA含量(Y2)、谷氨酸含量(Y3)为响应值,试验方案及结果见表2。

表2 二次回归正交旋转组合设计试验Table 2 Quadratic regression orthogonal rotation combination design with experimental results
2.3.2 以蛋白酶酶活为指标的回归模型方差分析及交互作用影响
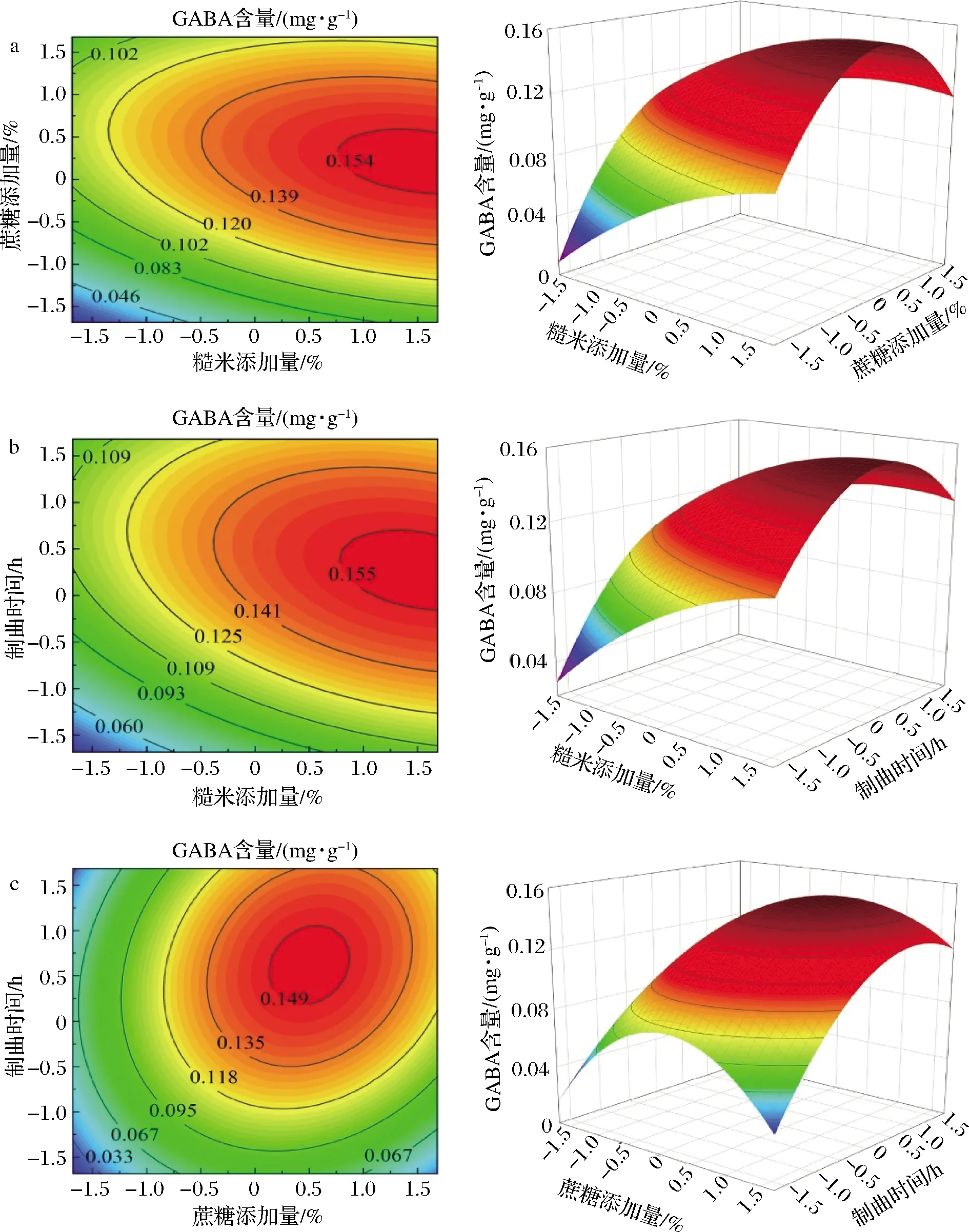
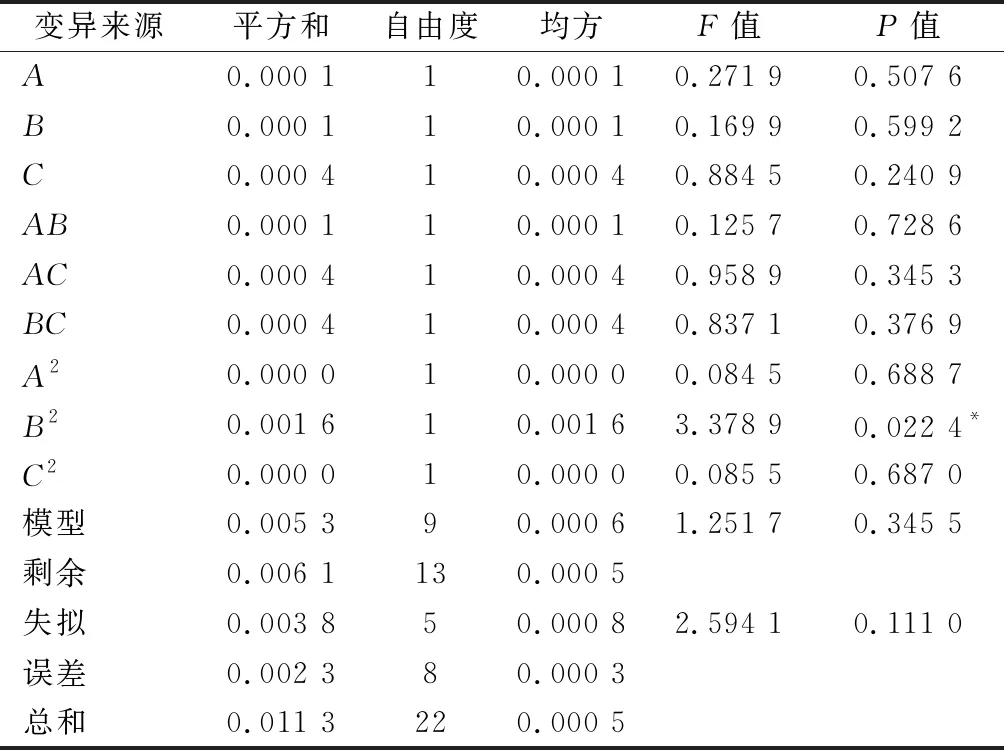
对所得数据进行整理分析得表3,拟合蛋白酶酶活(Y1)的二次回归方程为:Y1=628.66-21.54A-12.96B+56.20C-12.72AB+2.05AC-13.16BC-32.71A2-67.30B2-46.57C2。表3表明该模型极显著(P<0.01),无失拟性因素存在(P=0.134 1>0.05),方差分析显示,C、A2、B2、C2对回归方程影响较大(P<0.01),A对回归方程影响显著(0.01 表3 以蛋白酶酶活为评价指标的回归模型方差分析Table 3 Variance analysis results of regression model using protease activity as evaluation index 如图5-a所示,随着蔗糖添加量与糙米添加量的增加,酶活呈现先增加后降低趋势,通过二维等高线图可知两因素之间存在一定交互作用。如图5-b所示,随着糙米添加量与制曲时间的增加,酶活呈现先增加后降低趋势,通过二维等高线图可知,两因素之间不存在交互作用。由图5-c可知,随着蔗糖添加量与制曲时间的增加,酶活呈现先增加后降低趋势,通过二维等高线图可知两因素之间存在一定交互作用。综合图5和表3,3因素对酶活的影响力为:制曲时间>蔗糖添加量>糙米添加量。 a-蔗糖添加量与糙米添加量;b-糙米添加量与制曲时间; c-蔗糖添加量与制曲时间图5 糙米添加量、蔗糖添加量及制曲时间交互作用对 豆酱曲蛋白酶酶活的影响Fig.5 Effects of brown rice content, sucrose content and koji-making time on protease activity of soybean koji 2.3.3 以GABA含量为指标的回归模型方差分析及交互作用影响 同理由表4可知,GABA含量(Y2)二次回归方程为:Y2=-0.143+0.016A+0.016B+0.014C-0.005AB-0.004AC+0.006BC-0.005A2-0.019B2-0.014C2。由表4可知,该回归模型极显著(P=0.000 2<0.01),无失拟性因素存在(P=0.053 3>0.05),方差分析显示,A、B、C、B2、C2对回归方程影响十分显著(P<0.01),简化回归方程为:Y2=-0.143+0.016A+0.016B+0.014C-0.019B2-0.014C2。其中A、B、C、B2、C2的相关系数和与总系数和比例R=92.60%,其他因素影响系数占7.40%,简化方程仍有较好拟合性。 表4 以GABA含量为评价指标的回归模型方差分析Table 4 Variance analysis results of regression model using GABA content as evaluation index 如图6-a所示,随着蔗糖添加量与糙米添加量的增加,GABA含量呈现先增加后降低趋势,通过二维等高线图可知两因素之间存在一定交互作用。如图6-b所示,随着糙米添加量与制曲时间的增加,GABA含量呈现先增加后降低的趋势,通过二维等高线图可知两因素之间存在一定交互作用。如图6-c所示,随着蔗糖添加量与制曲时间的增加,GABA含量呈现先增加后降低趋势,通过二维等高线图可知两因素之间存在一定交互作用。综合图6和表4,3因素对GABA含量的影响力为蔗糖添加量>糙米添加量>制曲时间。 a-蔗糖添加量与糙米添加量;b-糙米添加量与制曲时间; c-蔗糖添加量与制曲时间图6 糙米添加量、蔗糖添加量及制曲时间交互作用 对豆酱曲GABA含量的影响Fig.6 Effects of brown rice content, sucrose content and koji-making time on GABA content of soybean koji 2.3.4 以谷氨酸含量为指标的回归模型性方差分析及交互作用影响 同理由表5可知,谷氨酸含量(Y3)二次回归方程为:Y3=0.232+0.004A-0.003B-0.007C+0.003AB+0.008AC+0.007BC+0.002A2-0.014B2+0.002C2。由表5可知,该回归方程模型不显著(P=0.345 5>0.05),其中有显著性影响误差来源B2的相关系数总和与总系数和的比例R=回归平方和/总平方和=49.71%,回归模型的拟合度较差,故不用此模型预测最佳工艺点。 表5 以谷氨酸含量为评价指标的回归模型方差分析Table 5 Variance analysis results of regression model using Glutamate content as evaluation index 2.3.5 最佳工艺点验证性实验 根据蛋白酶酶活和GABA含量回归模型分别可得出最优组合:糙米添加量7.4%、蔗糖添加量5.9%及制曲时间66.2 h,预测酶活达最大649.86 U/g,预测GABA含量0.140 mg/g,谷氨酸含量0.226 mg/g;糙米添加量10.6%、蔗糖添加量6.3%及制曲时间63.7 h,GABA含量达最大0.159 mg/g,预测酶活542.50 U/g,谷氨酸含量0.242 mg/g。 综合考虑后选择糙米粉添加量9.0%、蔗糖添加量6.1%及制曲时间65 h为优选条件,预测蛋白酶酶活622.08 U/g、GABA含量0.152 mg/g和谷氨酸含量0.233 mg/g。验证性实验得,蛋白酶酶活(592.13±25.01) U/g、GABA含量(0.148±0.012) mg/g及谷氨酸含量(0.241±0.010) mg/g,与回归模型预测值基本一致。优化后的豆酱曲与LEE等[6]使用米曲霉和芽孢杆菌混合制曲相比,与最低组蛋白酶酶活(458.5±18.0) U/g相比较高,略低于酶活最高组(627.8±17.9) U/g,证明此法制得的富含GABA酱曲有较高酶活。制曲结束时,酱曲表面菌丝生长均匀,外观呈黄绿色且未出现烧曲现象,呈现浓郁曲香并无不良风味,为豆酱的制酱工艺提供良好的风味基础。 通过实验建立3种影响因素(糙米粉添加量、蔗糖添加量、制曲时间)与3个响应值(蛋白酶酶活、GABA含量、谷氨酸含量)相互作用模型,得出添加9.0%糙米粉及6.1%蔗糖,制曲时间65 h时酱曲品质最佳,蛋白酶酶活为(592.13±25.01) U/g、GABA含量为(0.148±0.012) mg/g、谷氨酸含量为(0.241±0.010) mg/g,与回归模型预测值基本一致。通过本实验开发出一种提供高酶活且有较高GABA含量的制曲方法,为后续开发富含GABA豆酱提供了一定的理论参考。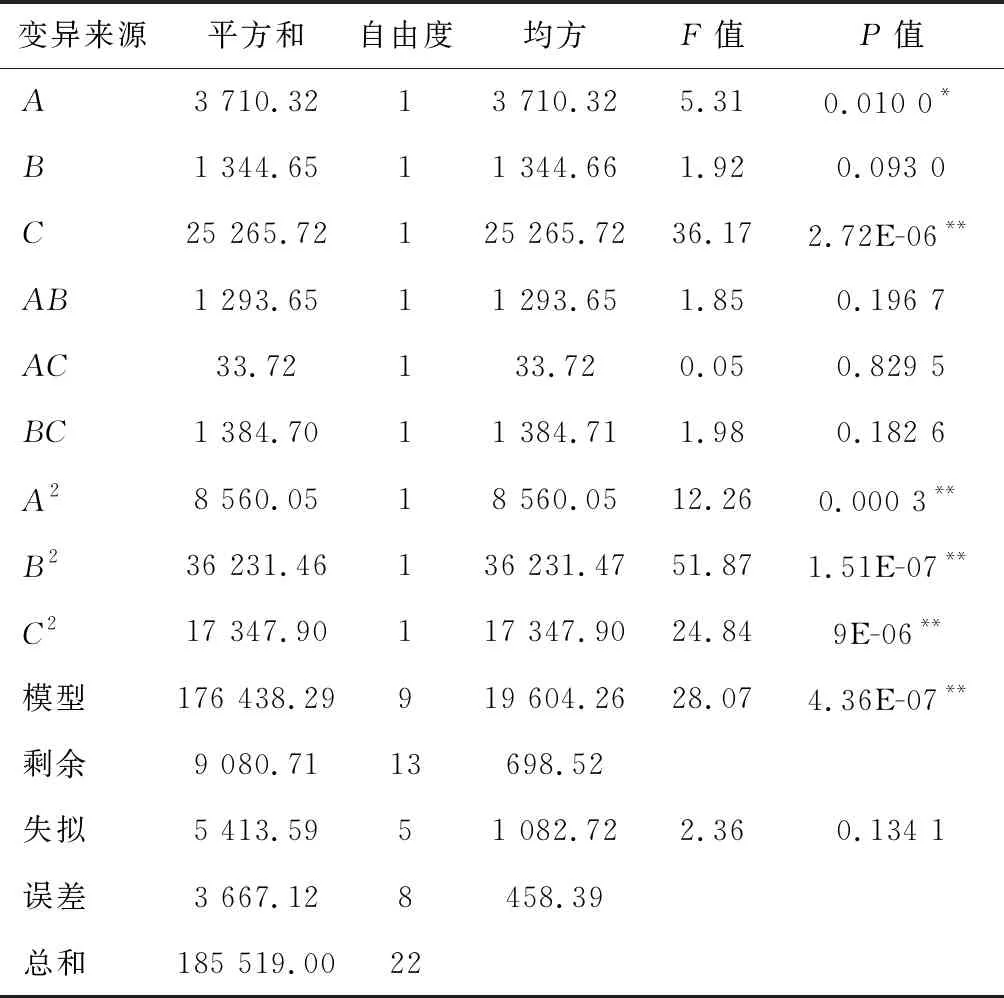

3 结论
