一种新西兰兔颈椎椎间融合模型的建立及评价
2020-12-31索世琪李成立李佳奇
陈 松,索世琪,李成立,张 飞,李佳奇,张 为*
(1.河北工程大学附属医院脊柱外科,河北 邯郸 056002;2.河北医科大学第三医院脊柱外科,河北 石家庄 050051)
颈椎前路椎间盘切除融合术(anterior cervical discectomy and fusion,ACDF)是目前治疗颈椎退行性疾病最常用的手术方法之一。目前对于脊柱融合动物模型的研究多以胸腰椎为主。颈椎椎间融合动物模型多见于大型动物,但大型动物围手术期管理复杂,因场地及经费原因饲养大量的大型动物进行研究是困难的。而小型动物又因椎体及附件过小不便于固定,术后X线难以观察。目前国内外研究缺乏成功的能很好模拟临床颈椎椎间植骨融合后状态的小型动物模型。本研究通过测量兔颈椎骨性结构的数据,在此基础上应用钢板螺钉系统进行兔颈椎椎体间植骨融合内固定,并通过大体观察、手触检查、X线检查、微型计算机断层扫描(micro computed tomography,Micro-CT)等检查验证该模型的可行性及安全性,为颈椎融合相关基础研究提供一种可靠的动物模型。
1 材料与方法
1.1实验动物 选用体重2.0~2.5 kg的健康雄性新西兰白兔36只(河北医科大学第三医院实验动物中心提供),随机分为A、B、C、D 4组,每组9只。A组用于解剖测量兔颈椎椎体结构;B组(造模4周组)、C组(造模8周组)、D组(造模12周组)行颈椎椎间植骨融合内固定。医学实验动物生产许可证编号SCXK(冀)2016-002;合格证编号181104。所有动物饲养条件相同,分笼饲养。本研究遵守动物伦理学要求,并经伦理委员会批准。
1.2动物模型制作
1.2.1术前准备 测量观察兔颈椎解剖结构并定制合适的钢板螺钉(天津正天医疗器械有限公司,批号1800052159),手术器械常规高压消毒。术前6 h禁食水,称重并记录,配制麻药。
1.2.2麻醉方法 采用20%乌拉坦(BOSF,W001)按3.5 mL/kg的剂量经耳缘静脉注射进行全身麻醉。
1.2.3手术过程 麻醉成功后,兔侧卧位于手术台上,术区常规备皮、消毒、铺巾。取髂嵴处切口,长约2 cm,逐层暴露髂骨外板,钝性分离周围软组织,取约3 mm×4 mm大小髂骨块备用,创面止血处理,待骨面无渗血后逐层缝合包扎。取仰卧位将兔固定于手术台上,术区常规备皮、消毒、铺巾,在显微镜辅助下行颈椎椎间植骨融合内固定术。取颈前正中偏右切口,长约4 cm,由颈动脉鞘与气管、食管鞘间隙钝性分离至椎体前,C臂定位C2/3椎体间隙,注意保护血管神经。仔细剥离颈长肌及前纵韧带,在自制骨膜剥离子的辅助下显露C2/3椎体间隙及上下椎体,用自制铰刀去除C2/3椎间盘和终板,并在其辅助下将备用的髂骨块植入C2/3椎体间隙。于上椎体的近下终板和下椎体近上终板处放置颈椎钢板,使用钻孔器钻孔并置入螺钉。其他椎体操作同上。术区采用生理盐水反复冲洗止血后逐层缝合包扎,造模完成。
1.3术后处理 术后分笼饲养,观察其精神状态、双下肢运动、切口情况及营养状况。切口处常规换药并连续3 d给予青霉素5万U肌肉注射。
1.4观察手术并发症发生情况 并发症包括死亡、食管损伤、神经血管损伤、硬膜囊撕裂、术后切口感染、血肿形成、内固定断裂移位、髂骨供区感染及脊髓损伤等。
1.5评价方法
1.5.1大体观察 观察实验动物术后进食、活动量及对外界刺激的反应。
1.5.2影像学检查 B、C、D组分别于术后4,8,12 周麻醉后行颈椎正侧位X线检查,观察钢板及螺钉位置以及是否存在内固定脱落、松动及椎间融合等情况。取出兔融合节段颈椎标本,剥离周围的肌肉及软组织,保留骨性结构部分后在18 μm分辨率下对各组标本进行Micro-CT检查,以评估新骨生成及脊柱融合情况。使用分析软件测定B、C、D组新生骨体积与植入材料总体积的比值(bone volume/total volume,BV/TV)。采用双盲法由2名未参加实验的医生进行读片,观察颈椎椎间植骨融合情况,根据有无骨形成或融合进行评分,见表1。

表1 放射学评分系统
1.5.3手触检查 X线检查完毕后采用空气栓塞法处死B、C、D组实验动物,取出兔融合节段颈椎标本进行手触检查。去除颈椎软组织及前路钢板、螺钉,采用双盲法由2名未参加实验的医生对标本进行屈伸、侧弯及扭转来检测融合节段的活动度,并且根据有无活动进行评分。无活动:融合;有活动:未融合。
1.6统计学方法 应用SPSS 22.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1兔颈椎解剖结构及钢板螺钉规格 兔颈椎椎体呈细腰鼓状,椎体两端粗大,中间稍细,椎体前面有骨嵴隆起,两侧为平整的斜面,测量颈椎椎体近终板处矢状径、横径、斜径(骨嵴最高点旁开1 mm与矢状径呈45 °)及椎体长度(图1)。自颈2(C2)~颈6(C6)椎体长度、椎体下端矢状径逐渐减小,差异有统计学意义(P<0.01),C2~C6椎体下端横径差异无统计学意义(P>0.05),C2~C6椎体下端斜径变化波动,差异有统计学意义(P<0.01)。见表2。根据兔子椎体解剖结构,选用螺钉和钢板的规格分别为1.7 mm×4 mm和4 mm×11 mm,在兔椎体的侧前方进行钢板固定,螺钉斜向后上方与椎体斜径平行,避免进入椎管损伤脊髓,置入钢板时,根据术中情况可适当调整(图2)。
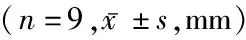
表2 兔颈椎骨性结构测量数据
2.2术后并发症 术中因麻药过量死亡3只,B组1只,C组0只,D组2只;术后感染死亡1只,C组1只;C组术后出现双下肢瘫痪1只,可能因术中损伤脊髓有关,虽加强护理清洁并给与药物治疗,但最终因绝食而死亡。所有死亡动物均及时补齐。
2.3大体观察 实验动物术后当天饮食、活动及对外界刺激反应差,术后第1天对外界刺激反应可,饮食和活动稍差。术后第2天饮食、活动及对外界刺激反应基本恢复正常。
2.4影像学观察 B、C、D组分别于术后4,8,12 周麻醉后行颈椎正侧位X线检查(图3A~C),B组植骨及钢板位置良好,可见明显间隙,其中1例出现螺钉松动退钉,其余无内固定断裂、移位等情况。C组和D组植骨及内固定位置良好,无内固定松动、断裂情况。C组椎间隙已模糊,可见骨痂生长;D组椎间隙已与上下椎体骨性连接。Micro-CT结果显示B组可见椎间有骨痂形成,但仍可见明显间隙;C组见椎间骨痂大量生长,间隙模糊;D组见椎间有连续骨性连接,无明显间隙,已达到临床融合效果。C组BV/TV和X线评分高于B组,D组BV/TV和X线评分高于B组和C组,差异有统计学意义(P<0.01)。见表3。
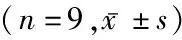
表3 BV/TV和X线评分比较
2.5手触检查结果 手触摸检查,B组椎间融合2例,融合率为22.2%(2/9);C组椎间融合5例,融合率为55.6%(5/9);D组椎间融合8例,融合率为88.9%(8/9)。
3 讨 论
ACDF目前已成为治疗退行性颈椎间盘病变的金标准。自体骨具有骨诱导、骨传导、无免疫排斥反应、安全性高等特点,目前自体骨移植仍是骨移植的“金标准”[1-3]。自体骨作为椎间融合植骨材料在临床上应用广泛[4-5]。但自体骨移植存在一系列问题,如来源有限、术后供区疼痛等。另外,由于骨量的限制及松质骨含量较少,不适合大范围的骨移植。人工植骨替代材料可弥补自体骨移植骨量不足的缺点、减少并发症,近年来已逐渐成为研究热点[6-8]。为了研究不同植骨材料或方式对脊柱融合的影响,研究者设计了一系列脊柱融合实验动物模型[9-15]。然而,山羊、犬、猪等大型动物常因受到经济和规模上的限制,导致研究结果不可避免会产生偏倚,影响其可靠性。而大鼠颈椎椎体及附件过小不便于固定,术后X线也难以观察其融合程度。兔的脊柱解剖结构与人具有一定相似性,其为爬行动物,轴向应力与人在直立状态下不尽相同,尽管两者植骨融合过程存在一定的差异,但是因其价格低廉,耐受性较强,术后进食、抗感染等也相对容易控制,已广泛用于研究脊柱融合[16]。目前兔脊柱融合模型多为腰椎后外侧横突间植骨融合。但该模型无法真实模拟目前临床上应用较多的融合方式即椎间融合。兔颈椎椎间植骨融合模型目前报道较少,本研究根据兔颈椎的解剖特点,设计出一种能真实模拟颈椎ACDF手术路径和融合方式的颈椎植骨融合模型的制作方法。本研究选取2~2.5 kg健康雄性新西兰大白兔9只进行颈椎椎体解剖测量,根据兔颈椎解剖数据,确定钢板及螺钉规格及置入位置。为了保证置入钢板及螺钉的安全性及稳定性,在兔颈椎侧前方进行钢板固定。相较于侧方固定,侧前方固定可避免因术野暴露过大、术中失血过多而致动物死亡。另外,此处较为平整,更利于钢板与椎体贴附、固定。术后X线检查见植骨及钢板位置均良好。置入螺钉的位置选择椎体下端距离终板约2 mm处,此处椎体矢状径、横径、斜径较大,沿斜径方向置入螺钉,根据所测颈椎解剖数据,可避免螺钉进入椎管损伤脊髓。本研究结果显示,B、C、D3组均未发生因螺钉进入椎管内挫伤脊髓致术后瘫痪,仅B组术后发生螺钉松动退钉1例,表明螺钉置入的方法安全可靠。
本研究采用乌拉坦进行麻醉,早期因麻药过量致实验动物死亡3只,随着对麻药剂量的调整和技术的提高,中后期未发生此类情况。尽管乌拉坦对实验动物细胞膜、心血管活动、血液流变学、血糖以及癌基因有明显影响,但其价格便宜、容易配制、麻醉效果稳定、维持时间长、对呼吸与循环抑制力弱、肌肉松弛好等优点,广泛用于实验动物麻醉。因此采用20%乌拉坦按3.5 mL/kg剂量经耳缘静脉缓慢注射进行全身麻醉是安全可靠的。在麻醉时,须精确测量体重,根据体重计算给药剂量,耳缘静脉注射麻药时须遵循先快后慢,匀速推进的原则。先快速推入总药量的1/3,剩下的2/3缓慢匀速推入,给药过程中须密切观察兔子的状态。术后感染死亡1只,可能与术中不慎污染手术器械有关。术后出现双下肢瘫痪1只,分析原因可能是椎间盘摘除植骨融合过程中损伤脊髓所致。兔颈椎椎间隙自前下略斜向后上,有一定角度,摘除椎间盘和去除终板时须提高注意、动作轻柔,沿椎间隙方向进行,避免因不当操作损伤脊髓致使实验动物术后肢体瘫痪或死亡。摘除间盘后去除终板直至渗血,给予充足骨量植骨以及维持椎间稳定是椎间融合的关键。本研究采用自体髂骨作为骨移植材料并采用Micro-CT评估新骨生成及脊柱融合情况。Micro-CT在骨代谢领域应用最为广泛,是评价骨形态和骨微结构的计算机体层成像系统。Micro-CT具有高分辨率、使用方便等特点,可以获得检测骨组织内部三维结构信息,在小动物标本和大型动物离体标本的研究领域扮演着重要的角色。Micro-CT检测BV/TV能够反映不同样本骨小梁的骨量,BV/TV值增高说明骨合成代谢大于分解代谢,骨量增加。BV/TV结果说明在骨量增加方面D组优于B组和C组,C组优于B组(P<0.01)。结合X线、Micro-CT和手触检查,结果表明随着时间的推进,椎间融合程度及新生骨量方面日渐增加。
综上所述,兔颈椎椎间植骨内融合固定动物模型设计合理、容易操作、费用低廉、与临床上椎间融合相符,可为颈椎椎间融合的基础研究提供了一种可靠的动物模型。(本文图见封三)
