鼻腔鼻窦内翻性乳头状瘤组织中E盒结合锌指蛋白2的表达及其与临床病理特征的关系▲
2020-12-30石书婧翟建华胡小兵乔振花范志涛王建国
石书婧 徐 莉 翟建华 胡小兵 乔振花 刘 曼 范志涛 王建国
(河北省眼科医院耳鼻咽喉-头颈外科,邢台市 054000,电子邮箱:shishujing163@163.com)
鼻腔鼻窦内翻性乳头状瘤(sinonasal inverted papilloma,SNIP)是临床上常见的良性肿瘤,其发病率位居鼻腔鼻窦良性肿瘤的首位,具有侵袭性生长、易复发等与恶性肿瘤相似的特点[1]。E盒结合锌指蛋白(zinc finger E-box-binding homeobox,ZEB)2为ZEB家族中的一员,参与鼻咽癌、口腔鳞状细胞癌等多种肿瘤的发生和发展过程[2]。但关于ZEB2在SNIP组织中表达的情况及其与SNIP发生和发展关系的研究较少。本研究检测了SNIP组织中ZEB2的表达,并分析其与SNIP发生和发展的关系,旨在为SNIP的诊断、治疗和改善患者预后提供参考。
1 资料与方法
1.1 临床资料 纳入2016年1月至2018年1月我院收治的51例SNIP患者(病例组),收集其SNIP组织;另纳入20例同期在我院接受鼻中隔偏曲矫正术的鼻窦炎患者(对照组),收集其增生鼻甲组织。所有病例均经病理组织学确诊,所获标本均保存于-80℃环境;相关临床资料记录完整,包括年龄、性别、临床分期、复发情况、病理分化程度。SNIP组中男性31例、女性20例,年龄23~71岁(中位年龄46岁);对照组中男性11例、女性9例,年龄22~70岁(中位年龄42.5岁)。两组性别、年龄差异无统计学意义(均P>0.05)。
1.2 主要试剂和仪器 TRIzol试剂(上海Ambion生物科技有限公司,生产批号:50175111)、反转录试剂盒(美国Thermo 公司,批号:00820439)、PCR反应试剂盒为FastStart Universal SYBR Green Master(Rox)(瑞士Roche公司,批号:21966100);7300型荧光定量PCR仪(美国ABI公司),超微量分光光度计(美国Thermo公司)。
1.3 总RNA提取和反转录 取50 mg组织标本,放入1.5 mL EP管内并置于冰上,加入600 μL预冷(4℃)TRIzol试剂,用眼科剪将组织剪至匀浆状态已充分裂解后,严格按照TRIzol试剂说明书抽提组织中的总RNA;获得组织中的总RNA后,取2 μL,使用超微量分光光度计测定总RNA的质量及浓度,以A260/280处于1.8~2.0为宜。取2 μg总RNA,使用RNA反转录试剂盒将其反转录为cDNA;反应体系:2 μg总RNA、1μL Oligo(dT)18引物、4 μL 5×反应缓冲液、1μL RiboLock RNase抑制剂(20 U/μL)、2 μL 10 mM dDTP混合液、1 μL RevertAid M-MuLV反转录酶(200 U/μL),加入无核酶水至反应体积为20 μL;反应程序:42℃ 60 min,70℃ 5 min。
1.4 检测ZEB2 mRNA的表达量 以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参。采用PCR反应试剂盒扩增ZEB2基因。反应体系:SYBR GreenⅠ10 μL,cDNA 1 μL,上游引物1 μL,下游引物1 μL,双蒸水7 μL。反应条件:95℃预变性10 min;95℃ 变性 15 s,60℃ 退火 30 s,共40个循环。引物序列由广州Invitrogen公司合成,GAPDH上游引物为5′-GACAACTTTGGCATCGTGGA-3′,下游引物为5′-ATGCAGGGATGATGTTCTGG-3′;ZEB2 上游引物为5′-AGTCCTCCCCACACGTGAG-3′,下游引物为5′-TGCGGTCTGGATCGTGGCTTC-3′。反应完成后,记录各样本的Ct值,采用2-△△ct法计算基因的相对表达量。先计算病例组或对照组的△Ct,△Ct =CtZEB2-CtGAPDH;再计算出对照组△Ct的均值△Ct′,分别计算出两组相对于△Ct′的△△Ct,△△Ct病例组=△Ct病例组-△Ct′,△△Ct对照组=△Ct对照组-△Ct′;最后采用2-△△ct公式计算出两组ZEB2的相对表达量[3]。
1.5 统计学分析 采用SPSS 16.0软件对数据进行统计。计量资料以M(P25,P75)表示,组间比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组ZEB2基因的表达水平比较 病例组ZEB2基因的相对表达水平为1.199(0.726,2.993),对照组ZEB2基因的相对表达水平为1.000(0.607,1.315)。病例组ZEB2基因的相对表达水平高于对照组(z=-1.969,P=0.049)。
2.2 病例组患者ZEB2基因表达水平与临床病理参数的关系 不同性别、年龄、临床分期以及有无复发患者之间ZEB2 mRNA相对表达水平比较,差异均无统计学意义(均P>0.05)。伴恶变患者的ZEB2 mRNA相对表达水平均高于无不典型增生及伴不典型增生患者(P<0.05),而伴不典型增生患者与无不典型增生患者ZEB2 mRNA相对表达水平比较,差异无统计学意义(P>0.05)。见表1。
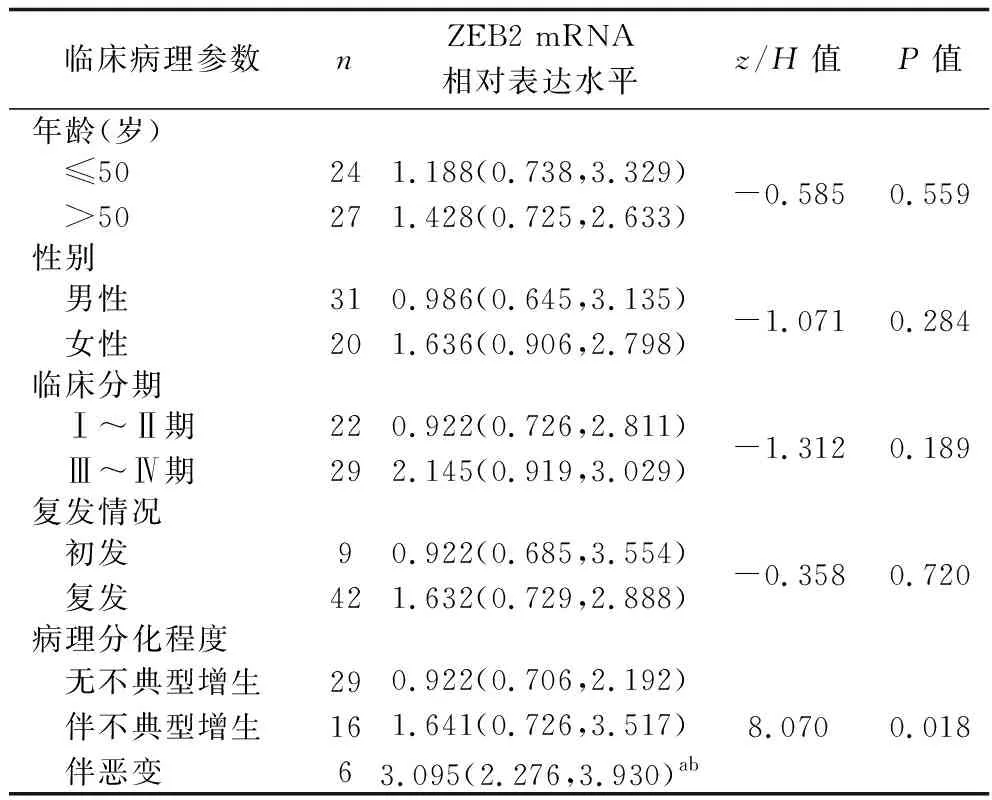
表1 不同临床病理特征病例组患者ZEB2 mRNA相对表达水平比较[M(P25,P75)]
3 讨 论
SNIP是一种源于鼻腔、鼻窦施耐德氏上皮细胞的良性肿瘤,占所有鼻腔肿瘤的0.5%~4%;尽管SNIP是一种组织学良性病变,但其具有侵袭性生长、局部破坏性较强、易复发和恶性转化等特点[4]。通常认为人类乳头瘤病毒感染参与了SNIP的进展,其他可能的病因还包括长期炎症刺激、上皮化生、变态反应以及种族因素等[5]。然而,SNIP的恶性转化过程涉及的组织形态学、免疫组织化学过程和生物标志物等仍不清楚。因此,探索SNIP恶性转化的分子机制十分重要。
肿瘤的发生、发展、侵袭和转移是一个多基因、多层次、多步骤的复杂调控过程。研究表明,上皮间质转化(epithelial-mesenchymal transition,EMT)在肿瘤侵袭、组织稳态和纤维化等方面发挥着重要作用。EMT促进肿瘤发生、侵袭及转移的机制为:EMT可降低肿瘤细胞间黏附力,增强其运动迁移能力,使肿瘤细胞更易脱离原发灶进入循环系统而引起远处转移[6]。EMT与ZEB2的关系密切,ZEB2的高表达与EMT、多种肿瘤的发生和发展相关。研究表明,ZEB2可通过抑制E-钙粘连蛋白并诱导EMT来促进肿瘤细胞的侵袭和转移[7]。Zhao等[8]的研究表明,Src通过蛋白激酶信号通路上调ZEB1和ZEB2水平,促进胃癌细胞的EMT和迁移,这提示ZEB1和ZEB2的上调与胃癌的EMT和迁移有关。易翔等[9]的研究表明,在鼻咽癌组织中ZEB2的表达升高而E-钙粘连蛋白的表达下降,两者的表达呈明显负相关,且共同参与了鼻咽癌的转移过程,其可能机制与ZEB2下调E-钙粘连蛋白的表达促进细胞EMT有关。Pan等[10]发现,双微体2癌基因结合蛋白可通过上调ZEB2表达以诱导EMT过程,从而促进非小细胞肺癌的侵袭。本研究结果显示,SNIP组织ZEB2基因表达水平高于对照组组织,且伴恶变的SNIP组织ZEB2基因表达水平高于有或无不典型增生的SNIP组织(P<0.05),即SNIP的病理分期越高,ZEB2基因表达水平也越高,这说明ZEB2基因的高表达不仅可能参与了SNIP的发生,还可能与其病理分期密切相关,或许能够影响疾病的预后。结合以上研究,我们认为ZEB2在SNIP的发展、恶变演变过程中起到一定作用,可反映SNIP侵袭恶变的生物学行为。
综上所述,SNIP组织中ZEB2的表达升高,其表达水平可能与病理分化程度有关。ZEB2可能与SNIP的发生及恶变以及增殖、侵袭相关,或可作为SNIP的生物标志物。检测SNIP组织中ZEB2的表达,或有利于指导临床的诊断、治疗和改善预后。SNIP的复发率较高,但本研究未显示ZEB2的表达与SNIP的复发相关,考虑与本研究的样本量较少有关,今后需进一步扩大样本量进行研究。
