基质成纤维细胞对卵巢癌细胞增殖能力的影响及相关分子机制▲
2020-12-30杨英捷
张 亚 杨英捷
(贵州省肿瘤医院妇瘤外科,贵阳市 550000,电子邮箱:howardfine@163.com)
卵巢癌是女性生殖系统三大恶性肿瘤之一,浸润和转移是造成卵巢癌高死亡率的主要原因,其中卵巢癌的转移主要通过直接扩散的方式转移至腹腔,不依赖于血管和淋巴管。最新研究表明,肿瘤的发生和发展与肿瘤-宿主微环境的平衡状态密切相关,上皮恶变和间质转化的交互作用共同决定了肿瘤的进展[1]。肿瘤受到由癌细胞、基质成纤维细胞、炎症细胞、内皮细胞以及细胞外基质组成的独特微环境的影响[2],其中基质成纤维细胞是腹腔网膜中的第二大类型细胞。既往研究显示,基质成纤维细胞分泌多种细胞因子作用于癌细胞,其自身在各种类型的肿瘤发生发展过程中均发挥重要作用[3]。转移癌细胞扩散后在远处的生长,称为“转移定植”,这一过程对手术去瘤后残留的微小肿瘤的存活至关重要[4]。然而,在网膜组织微环境中,基质成纤维细胞如何促进卵巢癌转移定植的分子机制尚不清楚。本研究针对基质成纤维细胞对卵巢癌SKOV-3细胞增殖的影响进行了初步观察,以便全面地了解基质成纤维细胞在卵巢癌转移定植中的作用,为进一步研究基质成纤维细胞调控卵巢癌的进展奠定基础。
1 材料与方法
1.1 主要试剂材料和细胞 收集无菌条件下切取的卵巢转移癌组织24例,所有标本均新鲜、完整,包含上皮组织及其邻近结缔组织,均经临床和病理学证实。人卵巢癌细胞系SKOV-3、基质成纤维细胞WI38购自中国科学院细胞中心。杜氏改良伊戈尔培养基(Dulbecco′s modified Eagle medium,DMEM)、RNA提取试剂TRIzol为美国Invitrogen公司产品(批号:C10268951、15596-026);AMV反转录酶、PCR Taq酶、SYBR Premix Ex Taq购于日本TaKaRa公司(批号:9068-38-6、47001-3D、A3701),表皮细胞生长因子(epidermal growth factor,EGF)、白细胞介素6(interleukin 6,IL-6)、转化生长因子α(transforming growth factor α,TGF-α)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒均购自武汉伊莱瑞特生物科技有限公司(批号:E-EL-H0059C、E-EL-H0102C、E-EL-H1586C),四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)试剂、二喹啉甲酸蛋白测定试剂盒、RIPA裂解液、电化学发光液购于碧云天生物技术研究所(批号:C0009、P0012S、P0013B、P0018S),小鼠抗人TGF-α抗体、兔抗人表皮生长因子受体(epidermal growth factor receptor,EGFR)抗体、辣根过氧化物酶标记的羊抗兔抗体、生物素标记的羊抗小鼠均购于英国Abcam 公司(批号:ab32536、ab78901、ab54378、ab87612)。
1.2 条件培养基的收集及细胞培养 将卵巢癌细胞SKOV-3和基质成纤维细胞WI38分别加入含10%胎牛血清的DMEM培养基,放在37℃、5%二氧化碳、相对湿度为90%的培养箱中进行培养,待细胞贴壁生长;收集卵巢癌细胞SKOV-3和基质成纤维细胞WI38培养24 h后的条件培养基,-80℃保存备用。取卵巢癌细胞SKOV-3以3×103个/孔的密度接种于96孔培养板中,待细胞贴壁之后分别更换上述条件培养基,置于37℃、5%二氧化碳、相对湿度为90%的培养箱中培养。本实验中,将卵巢癌细胞系条件培养基及经其处理的细胞作为对照组,基质成纤维细胞条件培养基及经其处理的细胞作为实验组。
1.3 条件培养基对卵巢癌细胞SKOV-3增殖作用的影响 分别于条件培养基处理24 h、48 h、72 h后,收集卵巢癌细胞SKOV-3,采用MTT法检测培养板中SKOV-3细胞的增殖情况,严格按照试剂盒说明书进行操作。通过Multiskan FC型酶标仪(美国Thermo公司)于490 nm波长处检测样本吸光度(A值)。实验独立重复3次。
1.4 实时荧光定量PCR检测条件培养基处理后卵巢癌细胞SKOV-3中EGFR mRNA表达水平 使用TRIzol裂解收集条件培养基处理24 h后的卵巢癌SKOV-3细胞,采用酚-氯仿抽提法提取细胞总RNA。利用反转录试剂反转录为cDNA,反转录体系:RNA 2 μg,随机引物1 μL,反应缓冲液1 μL,RNA酶抑制剂1 μL,dNTP 1 μL,逆转录酶1 μL。反转录条件为:65℃ 5 min,42℃ 1 h,70℃ 5 min。通过CFX96型定量PCR仪(美国Bio-Rad公司)进行实时荧光定量PCR实验,检测EGFR mRNA相对表达水平。EGFR基因引物序列:上游5′-AAACCGGACTGAAGGAGCTG-3′,下游5′-CCCATTGGGACAGCTTGGAT-3′;以β-肌动蛋白为内参,引物序列:上游5′-AAGAGAGGCATCCTCACCCT-3′,下游5′-GGAAGGAAGGCTGGAAG-3′。引物均由上海生工生物有限公司合成。PCR反应体系(共20 μL):2×SYBR Green Mix 10 μL,ROX 0.4 μL,上游引物0.8 μL,下游引物0.8 μL,双蒸水7.0 μL,cDNA 1.0 μL。反应条件为:94℃预变性4 min 45 s,然后94℃变性30 s,55℃退火45 s,72℃延伸1 min,循环30次,最后72℃充分延伸5 min。采用2-ΔΔCt法计算EGFR mRNA相对表达水平。实验独立重复3次。
1.5 免疫印迹技术检测条件培养基处理后卵巢癌细胞SKOV-3中EGFR蛋白表达水平 收集条件培养基处理24 h后的卵巢癌SKOV-3细胞,使用RIPA 裂解液提取细胞总蛋白,按照二喹啉甲酸蛋白定量试剂盒说明书检测总蛋白浓度。取80 μg蛋白经10% 十二烷基硫酸钠-聚丙烯酰胺凝胶分离后转至聚偏氟乙烯膜,5%脱脂奶粉封闭1 h,TBST洗膜 15 min(洗涤3次,5 min/次)。加入兔抗EGFR抗体(1 ∶500),4℃过夜,TBST洗膜(洗涤3次,5 min/次)后加入辣根过氧化物酶标记的羊抗兔(1 ∶5 000)二抗室温孵育1 h,TBST洗膜(洗涤3次,5 min/次)后滴加电化学发光液显色,凝胶成像仪(美国 Bio-Rad 公司)曝光,使用Image J软件进行蛋白表达分析。实验独立重复3次。
1.6 条件培养基中细胞因子EGF、IL-6及TGF-α水平的检测 分别收集卵巢癌细胞SKOV-3和基质成纤维细胞WI38培养24 h后的条件培养基,4 000 r/min离心5 min除去细胞碎片,收获上清用于检测。采用ELISA法检测EGF、IL-6、TGF-α水平,按照试剂盒说明书进行操作。实验独立重复3次。
1.7 免疫组织化学法检测卵巢癌组织TGF-α和EGFR的表达 每例病例选取3张相邻肿瘤组织切片,分别进行TGF-α、EGFR抗原免疫组织化学染色和苏木精-伊红(hematoxylin-eosin,HE)染色。免疫组织化学染色:经脱蜡、水化、微波抗原修复后,3%过氧化氢缓冲液室温孵育15 min,阻断内源性过氧化物酶活性;磷酸缓冲盐溶液洗涤3次(10 min/次),山羊血清室温封闭30 min封闭非特异性背景染色;分别滴加小鼠抗人TGF-α抗体(1 ∶100)和兔抗人EGFR抗体(1 ∶100),4℃孵育过夜;磷酸缓冲盐溶液洗涤3次(10 min/次);分别滴加生物素标记的羊抗小鼠IgG或生物素标记的羊抗兔IgG,室温孵育30 min;磷酸缓冲盐溶液洗涤3次(10 min/次),滴加辣根过氧化物酶标记的链霉卵白素工作液,室温孵育30 min;磷酸缓冲盐溶液洗涤3次(10 min/次),二氨基联苯胺液显色,苏木素复染,脱水、透明、封片。对照组一抗以磷酸缓冲盐溶液替代。根据着色情况及着色百分率,参考相关文献[5]对免疫组化染色结果进行分析。阳性细胞为棕褐色,随机选择5个视野进行计数,每个视野计数200个细胞,着色百分率<5%为阴性,5%~25%为弱阳性,26%~50%为中度阳性,>50%为强阳性。实验独立重复3次。
1.8 统计学分析 用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用两样本独立t或t′检验;相关性分析使用Spearman秩相关。以P<0.05为差异有统计学意义。
2 结 果
2.1 条件培养基对卵巢癌细胞株SKOV-3增殖作用的影响 在干预后的3个时间点,实验组SKOV-3细胞的活力均高于对照组(均P<0.05)。见表1及图1。

图1 光镜下观察各时间点两组细胞的增殖情况
2.2 条件培养基处理后卵巢癌细胞SKOV-3中EGFR mRNA及蛋白表达水平 条件培养基处理24 h后,实验组SKOV-3细胞中EGFR mRNA和蛋白相对表达水平均高于对照组(P<0.05),其中实验组SKOV-3细胞EGFR mRNA表达水平为对照组的3.55倍。见表2和图2。
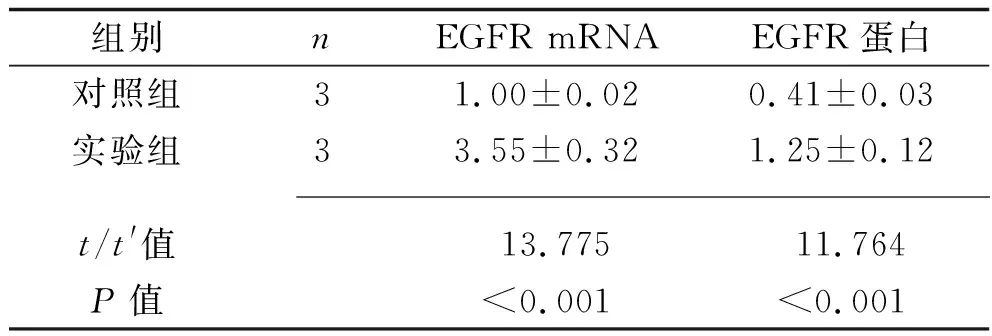
表2 两组卵巢癌SKOV-3细胞EGFR mRNA及蛋白相对表达水平比较(x±s)

图2 两组卵巢癌细胞SKOV-3中EGFR蛋白的表达情况
2.3 条件培养基中细胞因子EGF、IL-6及TGF-α水平的检测 实验组条件培养基中TGF-α的水平高于对照组(P<0.05),但两组的EGF、IL-6水平差异无统计学意义(均P>0.05)。见表3。
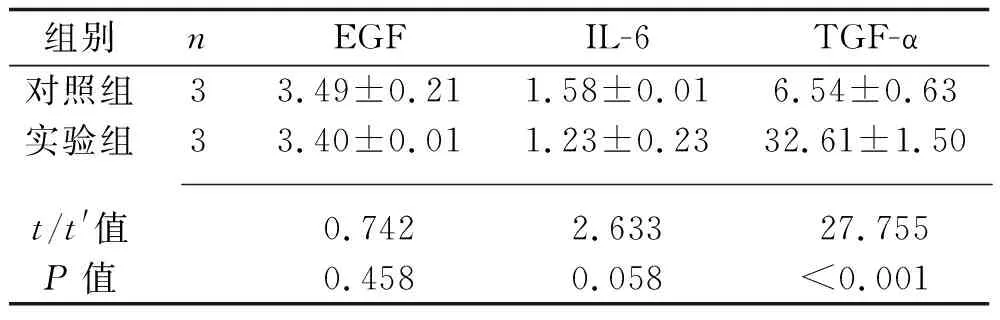
表3 两组培养基细胞因子EGF、IL-6及TGF-α水平比较(x±s,ng/mL)
2.4 卵巢转移癌组织中TGF-α和EGFR的表达情况及其相关性 TGF-α和EGFR在卵巢转移癌组织中均呈高表达(见图3),两者的阳性表达情况呈正相关性(rs=0.812,P<0.001)。见表4及图3。

表4 卵巢转移癌组织中TGF-α和EGFR表达情况[n(%)]

图3 卵巢转移癌组织免疫组织学及HE染色结果
3 讨 论
间质细胞与细胞外基质构成的肿瘤微环境在肿瘤形成发展过程中扮演重要的角色[6]。肿瘤细胞的间质微环境显著特征包括:基质成分改变,炎性细胞增多,微血管密度增加,出现活化的成纤维细胞[7]。间质中活化的成纤维细胞通过分泌多种可溶性因子,上调金属蛋白酶和丝氨酸蛋白酶的表达,并降解和重构细胞外基质,进而促进肿瘤进展[8]。事实上,已有体内外实验表明,基质成纤维细胞可以显著刺激前列腺癌上皮细胞生长[9]。Lebret等[10]发现,成纤维细胞和成纤维细胞条件培养基的一个突出作用就是通过旁分泌机制刺激乳腺癌细胞的增殖。然而有关基质成纤维细胞在卵巢癌转移定植中的作用仍然不甚清楚。因此,本研究探讨了基质成纤维细胞对卵巢癌细胞增殖能力的影响,并初步分析旁分泌TGF-α/EGFR信号轴在这一过程中的作用。
EGFR是一种重要的细胞生长调节因子,对稳定内环境具有重要作用,其介导的信号可调控细胞增殖,抑制细胞凋亡,诱发肿瘤血管生成,增强肿瘤细胞迁移和侵袭能力[11]。在胰腺癌、前列腺癌、肾细胞癌等多种恶性肿瘤中均存在EGFR表达异常的现象[12]。Zhang等[13]的研究表明,在妇科肿瘤如宫颈癌、子宫内膜癌、卵巢癌及乳腺癌中均可见EGFR的高表达,而卵巢癌中EGFR的阳性率高达78.7%[14]。高表达或异常表达的EGFR引起下游信号通路的激活,将增殖分裂信号转导至细胞内,从而改变细胞生长特性并促进细胞的恶性转化;同时,EGFR还与卵巢癌分期密切相关,恶性程度越高则EGFR表达水平越高[15],进一步证实EGFR可以作为判断卵巢肿瘤恶性程度的一个参考指标。另外,有临床研究表明,EGFR靶向药物吉非替尼可以显著抑制异种移植模型中卵巢癌的腹腔内播散或腹膜转移,表明EGFR对卵巢癌细胞的腹膜转移定植至关重要[16]。本研究中,经基质成纤维细胞条件培养基处理的卵巢癌SKOV-3细胞的活力升高(P<0.05),说明基质成纤维细胞可能通过旁分泌方式促进卵巢癌细胞的增殖;且经基质成纤维细胞条件培养基处理的卵巢癌SKOV-3细胞EGFR mRNA及蛋白相对表达水平增高(P<0.05),说明基质成纤维细胞对卵巢癌细胞的增殖促进作用可能与EGFR的激活密切相关。
EGFR的活化依赖于配体的结合,TGF-α是EGFR的配体之一。通过自分泌TGF-α并激活EGFR下游信号是卵巢癌调节肿瘤生长和侵袭的主要机制之一[17]。然而,既往研究显示,卵巢癌细胞中TGF-α呈低水平表达[18],说明癌细胞自分泌TGF-α不是促进卵巢癌细胞转移定植的关键因素。既然基质成纤维细胞的条件培养基能够促进卵巢癌细胞增殖并活化EGFR,那么卵巢癌细胞极有可能接受基质成纤维细胞来源的TGF-α的调控,促进自身存活和转移定植。本研究结果显示,实验组条件培养基中TGF-α的水平升高(P<0.05),提示基质成纤维细胞可能通过分泌TGF-α促进EGFR活化;我们进一步在卵巢转移癌组织中检测到TGF-α和EGFR的阳性表达情况呈正相关性(P<0.05),这进一步说明旁分泌TGF-α/EGFR信号轴在基质成纤维细胞促进卵巢癌细胞增殖和转移定植中的关键作用。
综上所述,基质成纤维细胞通过旁分泌方式促进卵巢癌细胞增殖,从而参与卵巢癌的转移定植,而旁分泌TGF-α/EGFR信号轴在其中发挥重要作用,这一结果或可为以后深入研究卵巢癌转移定植机制提供参考。
