宫颈癌患者癌组织中CD49f的表达量及其对免疫指标水平和不良生存结局的影响
2020-12-30任晓红杨文婷郑鹏生
任晓红 杨文婷 郑鹏生,3
(西安交通大学第一附属医院1 医学部,2 生殖医学科,陕西省西安市 710061,电子邮箱:xianrenxiaoh@163.com;3 西安交通大学医学部环境与疾病相关基因教育部重点实验室,陕西省西安市 710061)
了解肿瘤异质性如何介导人类癌症的进展,是癌症生物学的一个持续性挑战[1],特别是关于上皮细胞-间充质转化(epithelial to mesenchymal transition,EMT)与化学抗性的关联,以及肿瘤异质性的阶段特异性作用,均是目前很难理解的现象。对于人宫颈癌细胞中已被鉴定出来的特定亚组包括CD49f (+)细胞,一些研究者已经建议将其作为肿瘤起始细胞[2-3]。CD49f可在正常宫颈基底层表达,甚至可存在于宫颈上皮内瘤变的宫颈上皮的上层[3]。CD49f已被证明与肿瘤的侵袭性有关,是一种可能导致集体侵袭的基底细胞的标志物[4-5]。本研究分析宫颈癌患者癌组织CD49f的表达情况,以及其对免疫指标、生存结局的影响,以期为宫颈癌的临床诊疗提供参考。
1 资料与方法
1.1 临床资料 纳入2013年1~12月西安交通大学第一附属医院收治的50例宫颈癌患者作为宫颈癌组。纳入标准:(1)宫颈癌诊断符合《宫颈癌诊断与治疗指南(第四版)》[6]的诊断标准;(2)年龄40~50周岁;(3)入组前未接受其他治疗;(4)签署知情同意书。排除标准:(1)有其他恶性肿瘤病史;(2)合并其他重大影响生存疾病的患者。50例宫颈癌患者中,按照国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)标准分期,其中Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期各9(18.0%)、18(36.0%)、17(34.0%)、6(12.0%);鳞癌、腺癌、腺鳞癌各32(64.00%)、17(34.00%)、1(2.00%);中、高分化为32例(64.00%),低分化18例(36.00%);肿瘤直径<3 cm共21例(42.00%),≥3 cm共29例(58.00%);盆腔淋巴结转移16例(32.00%);HPV分型16/18双阳性共29例(58.00%)。并选择50例因各种宫颈良性病变行宫颈活检术的患者作为对照组。两组患者的年龄、身高、体重以及吸烟史、饮酒史比较,差异均无统计学意义(均P>0.05),见表1。本研究经我院伦理委员会批准,所有研究对象均知情同意。

表1 两组患者一般资料的比较
1.2 宫颈癌治疗方法 参照《宫颈癌诊断与治疗指南(第四版)》[6],根据宫颈癌患者的分期,采取手术+放疗的方法进行治疗。
1.3 免疫组化法检测组织中CD49f蛋白的表达 收集研究对象手术切除的宫颈病变组织,经10%甲醛固定,常规石蜡包埋,4 μm连续切片,烤箱65℃烤片4 h。然后采用二甲苯脱蜡,乙醇脱水,高pH抗原修复液修复抗原。自然冷却后,取出切片,磷酸缓冲盐溶液(phosphate buffered saline,PBS)冲洗3次,3%过氧化氢封闭20 min,PBS冲洗3次。将羊血清与PBS充分混匀后,滴于切片上。将CD49f抗体(Thermo Fisher公司,批号:710209;比例为1 ∶500)滴加在切片上,置于4℃过夜。滴加生物素标记的二抗(北京中山生物技术有限公司,批号:07051521;比例为1 ∶200),PBS冲洗,二氨基联苯胺显色,乙醇脱水,二甲苯透明。免疫组化染色阳性反应为黄-棕褐色颗粒,首先在低倍镜下(100×)观察选择有代表性的区域,然后在高倍镜下(400×)计数 500~1 000个肿瘤细胞;采用半定量积分法判断结果:阳性细胞数<5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;阳性强度以多数细胞的阳性着色程度为准,淡黄色为1分,棕黄色为2分,棕褐色为3分。以上述两个积分相乘为最终得分,0~5分为阴性(-),6~12 分为阳性(+)[7]。
1.4 实时荧光定量PCR 检测组织中CD49f mRNA的表达 取手术切除宫颈病变组织,采用总RNA抽提试剂盒(北京艾德莱生物科技有限公司,批号:252250AX)提取RNA,采用反转录试剂盒(美国GeneCopoeia公司,批号:CO2011A)将RNA反转录生成cDNA。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,GAPDH正向引物为5′-GGCATGGACTGTGGTCATGAG-3′,反向引物为5′-TGCACCACCAACTGTTAGC-3′;CD49f正向引物为5′-ATGCACGCGGATCGAGTTT-3′ ,反向引物为 5′-TTCCTGCTTCGTATTAACATGCT-3′。引物由金斯瑞公司合成,SYBER Green Master Mix试剂购自美国Invitrogen公司(批号:4367659)。配置PCR反应体系(上游引物0.6 μL,下游引物0.6 μL,SYBER Green Master Mix 10 μL,cDNA 3 μL及无核酸酶水5.8 μL),混匀后进行PCR扩增,反应条件具体如下:95℃预变性5 min;95℃变性15 s ,60℃复性及延伸30 s ,40个循环。基因相对表达量采用2-ΔΔCt法[8]计算。
1.5 免疫指标的检测 开始治疗前取两组患者全血5 mL,各分为两管,待用于检测免疫指标,主要包括血清免疫抑制酸性蛋白(immunosuppressive acidic protein,IAP)、T淋巴细胞亚群(包括CD3+、CD4+、CD8+T淋巴细胞)、自然杀伤细胞(CD16+CD56+)。其中一管采用无菌肝素抗凝,置于-80℃保存,用贝克曼库尔特商贸(中国)有限公司CytoFLEX LX型流式细胞仪检测T淋巴细胞亚群和自然杀伤细胞;另一管在1 h内以2 000 r/min离心20 min分离血清并置于-80℃保存,用酶联免疫吸附法测定血清IAP;IAP试剂盒由杭州江莱检测中心提供(批号:JL12703),按照说明书进行操作。
1.6 随访 随访起始时间为患者治疗第1天,终止时间为2019年1月1日;终点事件为死亡。通过查阅宫颈癌患者的病历资料、电话询问、门诊随访等方式随访,随访内容主要为患者目前生存状态及返院复查情况等。失访的患者按照最后一次随访时间来计算。
1.7 统计学分析 采用SPSS 20.0软件进行统计分析。计数资料以例数(%)表示,组间比较采用χ2检验;计量资料以(x±s)表示,组间比较采用t或t′检验;采用Pearson相关系数分析CD49f mRNA表达水平与免疫指标表达水平的相关性;采用Cox模型分析影响宫颈癌患者生存的相关因素。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组宫颈组织中CD49f的表达水平的比较 宫颈癌组、对照组的CD49f蛋白阳性率分别为42.0%(21/50)和12.0%(6/50),CD49f mRNA的相对表达量分别为0.32±0.16、0.24±0.08;宫颈癌组的CD49f蛋白阳性率及CD49f mRNA相对表达量均高于对照组(χ2=11.416,P<0.001;t=3.162,P=0.002)。见图1。

图1 CD49f蛋白在对照组和宫颈癌组中的表达(免疫组织化学染色,400×)
2.2 两组血清免疫指标水平的比较 与对照组比较,宫颈癌组血清CD3+T淋巴细胞、CD4+T淋巴细胞水平以及CD4+/CD8+比值降低,CD8+T淋巴细胞、自然杀伤细胞以及IAP水平上升(均P<0.05)。见表2。
2.3 宫颈癌患者癌组织中CD49f mRNA相对表达量与血清免疫指标水平的相关性 宫颈癌患者的癌组织CD49f mRNA相对表达量与血清IAP水平、CD8+T淋巴细胞水平、自然杀伤细胞水平呈正相关(r=0.660,P=0.037;r=0.505,P=0.022;r=0.480,P=0.040),与CD3+T淋巴细胞和CD4+T淋巴细胞水平均呈负相关(r=-0.451,P=0.044;r=-0.526,P=0.019)。

表2 两组血清免疫指标水平的比较(x±s)
2.4 宫颈癌患者生存情况的影响因素
2.4.1 随访结果:随访12~187个月,中位随访时间20个月,随访期间死亡1例(腺鳞癌)。
2.4.2 单因素分析:以年龄、身高、体重、吸烟及饮酒情况、家族史、病理参数及CD49f mRNA表达量作为自变量,引入Cox模型进行单因素分析,变量赋值见表4。结果显示,肿瘤直径、FIGO分期、肿瘤的分化程度、淋巴结转移、CD49f mRNA相对表达量均是宫颈癌患者生存的影响因素(均P<0.05)。见表4。

表3 变量赋值
表4Cox单因素分析

变量b值SE值Wald χ2值P值RR值(95%CI)年龄0.0240.2840.0070.9331.024(0.587,1.786)身高0.1460.2400.3700.5431.157(0.723,1.852)体重0.2800.1952.0510.1521.323(0.902,1.940)吸烟0.7190.4892.1610.1422.052(0.787,5.350)饮酒0.2050.2920.4950.4821.228(0.693,2.176)有家族史0.6600.4072.6270.1051.934(0.871,4.294)肿瘤分化程度-1.044 0.12866.741<0.001 0.352(0.274,0.452)病理类型0.3290.2012.6620.1031.389(0.936,2.061)肿瘤直径0.2290.03542.014<0.001 1.257(1.173,1.347)淋巴结转移 0.8320.2709.5040.0022.298(1.354,3.900)FIGO分期1.1030.23621.813<0.001 3.014(1.897,4.789)CD49f mRNA相对表达量0.5660.07655.480<0.001 1.762(1.518,2.045)
2.4.3 多因素分析:将单因素分析中有统计学意义的变量引入Cox模型进行多因素分析;结果显示,肿瘤分化程度、肿瘤直径、FIGO分期、CD49f mRNA相对表达量均是宫颈癌患者生存的独立影响因素(均P<0.05)。见表5。
表5Cox多因素分析
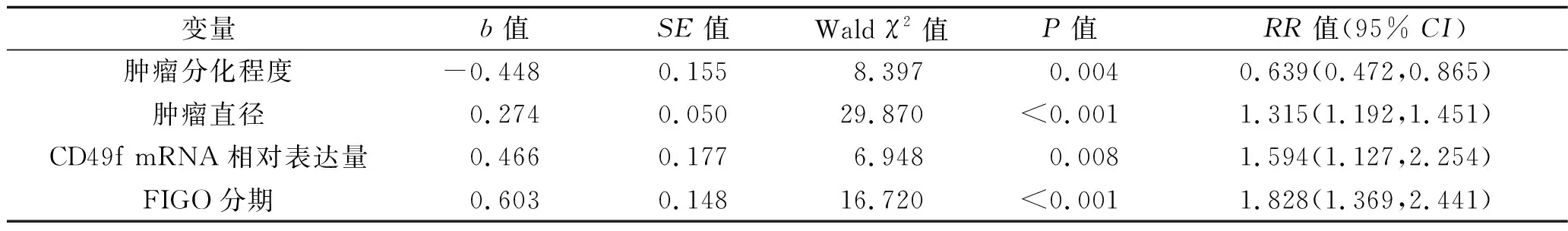
变量b值SE值Wald χ2值P值RR值(95% CI)肿瘤分化程度-0.448 0.1558.397 0.0040.639(0.472,0.865)肿瘤直径0.2740.05029.870<0.0011.315(1.192,1.451)CD49f mRNA相对表达量0.4660.1776.948 0.0081.594(1.127,2.254)FIGO分期0.6030.14816.720<0.0011.828(1.369,2.441)
3 讨 论
整合素α6亚单位又称为CD49f,是已知在干细胞群体和体细胞如角质形成细胞、血小板、上皮细胞和角膜基底细胞中被鉴定出来的蛋白质[9-10]。自该整合素家族的亚基在1998年首次被鉴定出来后,已在超过30种干细胞群中发现存在CD49f的表达,其中包括多功能干细胞以及肿瘤干细胞[11]。
大多数肿瘤内的不同细胞群具有自我更新和分化成新肿瘤细胞的潜力,因此被称为肿瘤起始细胞或肿瘤干细胞。在胶质母细胞瘤肿瘤干细胞中,CD49f被认为是自我更新、增殖和肿瘤形成能力的重要调节因子[12]。在宫颈癌细胞中,CD49f主要来自4个不同的肿瘤干细胞群:HeLa、SiHa、Ca Ski、C-4-I。与单层培养的亲代细胞系相比,从球状体获得的CD49f显示出了自我更新的特性,这一特性增强了其致癌能力以及对电离辐射的抗性[13-14]。当患者免疫力低下时,CD49f则更加容易表达[15]。本研究结果显示,宫颈癌组癌组织的CD49f蛋白阳性率及mRNA相对表达量均高于对照组(均P<0.05),这提示在宫颈癌患者中CD49f呈高表达。此外,我们发现,与对照组相比,宫颈癌组血清CD3+T淋巴细胞、CD4+T淋巴细胞水平以及CD4+/CD8+比值降低,CD8+T淋巴细胞、自然杀伤细胞以及IAP水平上升(P<0.05);同时,宫颈癌患者CD49f mRNA表达水平与血清IAP水平、CD8+T淋巴细胞水平、自然杀伤细胞水平呈正相关,而与CD3+和CD4+T淋巴细胞水平均呈负相关(P<0.05)。这提示在宫颈癌患者中,CD49f的高表达可触发特异性CD8+毒性T细胞的活化,而抑制CD3+T淋巴细胞和CD4+T淋巴细胞活化。
既往的研究已经证实,很多生物学物质的高表达与宫颈癌的不良预后有关。例如,罗舒等[16]的研究表明,宫颈癌组织中DNA(胞嘧啶-5)-甲基转移酶1[DNA(cytosine-5-)-methyltransferase 1,DNMT1] 阳性细胞率显著高于正常组织及癌旁组织;且随着癌组织中 DNMT1 阳性细胞百分率的提高,宫颈癌的结局变得更差。侯立春等[17]的研究也表明,醌氧化还原酶1 蛋白高表达可能是评估宫颈癌预后不良的生物学指标。但是,目前尚无有关CD49f与宫颈癌的不良预后的研究。本研究Cox回归分析结果显示,在排除其他的混杂因素后,CD49f mRNA的表达水平与患者的生存情况有关,其表达水平越高,患者死亡风险越高(P<0.05)。
然而,本研究存在一定的局限性:首先,对于CD49f与免疫指标的关系,我们只选取了一部分指标进行分析,其他免疫指标是否有这样的相关性,需要进一步研究才能确认。其次,宫颈癌组的样本量较少,在生存率方面的统计会存在较大的误差,需要大样本来佐证宫颈癌患者CD49f高表达与患者不良生存结局的相关性。
总之,宫颈癌患者癌组织中CD49f呈高表达,其或可导致患者的免疫指标水平出现异常,且是影响患者生存结局的因素之一。
