针刺带脉穴对腹型肥胖小鼠白色脂肪棕色化影响的研究
2020-12-30于梦芸王海英梁翠梅胡慧
于梦芸 王海英 梁翠梅 胡慧
腹型肥胖(abdominal obesity)是指脂肪在腹部或腹腔内脏部积聚过多,故又称中心性肥胖。随着世界腹型肥胖的发生率的增加,许多人生活在代谢综合征的高风险中,而代谢综合征会促进动脉粥样硬化性血管疾病和2型糖尿病等并发症的发展[1]。
哺乳动物体内的脂肪组织分为白色脂肪组织(white adipose tissue, WAT)和棕色脂肪组织(brown adipose tissue,BAT),两种脂肪组织通过WAT存储能量、BAT消耗能量的方式共同调节体内能量代谢[2]。研究表明,在冷刺激或β肾上腺素能受体激动剂的作用下,小鼠WAT中会出现散在的棕色样脂肪细胞,且细胞内线粒体数量增加,氧化磷酸化加快,这种分化过程称为白色脂肪棕色化,多种转录因子与信号通路参与其中[3]。UCP1是BAT的特异性表达基因,参与产热调节,是白色脂肪棕色化的主要体现[4],PGC-1α在调动UCP1活性过程中起重要作用[5],PRDM16是促进棕色脂肪分化的关键因子[6]。临床疗效已证明针刺具有改善患者的腹型肥胖的作用[7-8],针灸可通过调节下丘脑中枢神经抑制食欲[9],调节过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ, PPARγ)促进脂肪分化[10]等多种途径改善肥胖。因此本研究通过高脂饮食建立腹型肥胖小鼠,以WAT中的PGC-1α、UCP1、PRDM16基因和蛋白表达变化为切入点,从白色脂肪棕色化的角度探讨针灸治疗腹型肥胖的作用机制。
1 材料与方法
1.1 实验动物
清洁级4周龄雄性C57BL/6J小鼠35只,体质量(14±1)g,购自北京维通利华实验动物技术有限公司,许可证号:SYXK(京)2012-0036, 饲养于北京中医药大学实验动物中心。饲养条件:温度为(22±2)℃,湿度为50%~60%左右。人工控制室内照明,保持12小时昼夜交替循环。所有小鼠均可自由进食饮水,适应环境1周。
1.2 试剂及仪器
一次性无菌针灸针(0.30 mm×25 mm,北京中研太和医疗器械有限公司);PGC-1α、UCP1和PRDM16抗体(货号:ab54481、ab10983、ab106410,美国Abcam);β-Actin(货号:AC001-M,美国Santa Cruz);山羊抗兔igG、山羊抗鼠igG(货号:SH-0031、SH-0011,北京鼎国昌盛生物技术有限责任公司);igG TRIzol®Reagent、反转录试剂盒、荧光定量PCR试剂盒(货号:15596-018、AM2044、4385614,美国Invitrogen);PVDF转印膜(货号:XLL092-2,美国Thermo Fisher);AL204电子天平(瑞士METTLER TOLEDO); 石蜡切片机(德国LEICA);NIKON Eclipse ci显微镜、NIKON digital sight DS-FI2成像系统(日本NIKON公司)。CMNS6-1型脉冲针灸治疗仪(无锡佳健医疗器械有限公司);小鼠固定器(150 mm×65 mm×50 mm,上海华岩仪器设备有限公司)。
1.3 造模与分组
随机抽取6只小鼠为空白对照组,采用一般饲料喂养,其余29只造模小鼠采用高脂纯合饲料(购自Research DIETS公司,含20%蛋白、45%脂肪、35%碳水化合物,能量密度4.7 kcal/g)喂养,喂养12周后,称量体重、腹围。造模组体重、腹围大于空白组平均值20%的小鼠被认定为腹型肥胖[11-12]。将造模成功的12只小鼠随机分为模型组6只和针刺组6只,继续以高脂饲料喂养。
1.4 干预方法
针刺组:按照《实验针灸学》中常用实验动物针灸穴位附图中的取穴方法取双侧“带脉”穴。将小鼠置于定制的小鼠固定器内固定,充分暴露针刺部位,用0.30 mm×25 mm一次性无菌针灸针,直刺双侧“带脉”穴,深度3~4 mm,连接电针仪的正负极,疏密波,频率2 Hz/15 Hz,电流强度1.5 mA,隔日1次,15分钟/次。模型组和空白组同步固定,不做任何其他处理。共干预8周。
1.5 观察指标及检测方法
1.5.1 体质量和腹围的测定 干预前后测量体质量、腹围。在天平上放置一个小盆,计数调“0”,称取小鼠体重;1人将小鼠抓起固定,使其仰卧位,另1人用卷尺测量小鼠腹部剑突与后肢间垂直距离中点的周径。
1.5.2 脂肪组织HE 染色 将WAT、BAT经4%多聚甲醛溶液固定,常规取材,脱水,石蜡包埋,制片(4 μm厚),HE染色,在光学显微镜下观察并描述,对应主要描述部位进行拍照。
1.5.3 Western Blot法检测WAT中PGC-1α、UCP1、PRDM16蛋白的表达水平 取100 mg的WAT,加入1 mL RIPA裂解液,匀浆充分至无块状;冰浴中超声粉碎组织,4℃ 12000 rpm离心10 分钟;轻取上清液进行BCA法蛋白定量,制备样品;制备SDS-PAGE凝胶,上样,电泳,转膜,室温下封闭30 分钟。UCP1和PGC-1α一抗以1∶1000稀释,β-Actin一抗以1∶5000稀释,4℃过夜孵育。次日用洗膜后二抗,室温孵育2小时,再次洗膜。将混匀后的ECL发光液加于PVDF膜,在成像系统中成像,imageJ软件进行灰度值处理分析,以β-Actin为内参,分别以UCP1、PGC-1α、PRDM16与内参比值为相对表达量。
1.5.4 荧光定量PCR法检测WAT中PGC-1α、UCP1、PRDM16的mRNA的表达 将50 mg的WAT充分研磨后加入1 mL Trizol震荡混匀裂解,离心,取上清加入200 μL氯仿,漩涡震荡混匀,再离心取上清液加入等体积的异丙醇,离心,加入1 mL75%乙醇后离心,弃上清,将沉淀真空干燥10分钟加入30 μL DEPC水中。进行RNA鉴定及反转录,合成cDNA。扩增按照以下条件反应:95℃预变性2分钟,95℃变性15秒,62℃退火30秒,72℃延伸30秒,共35个循环。反应结束以后,PCR仪给出各个反应孔的Ct值,以GAPDH基因为内参对照,根据公式2计算各个样本的相对表达量。引物序列见表1。

表1 实验中的引物信息
1.6 统计学处理

2 结果
2.1 各组小鼠体重、腹围的变化
针刺治疗前,与空白组相比,模型组的体重和腹围明显增加(P<0.05,P<0.05),说明造模成功。针刺治疗后,与空白组比较,模型组体重和腹围显著增加(P<0.05,P<0.05);与模型组相比,针刺组的体重和腹围明显下降(P<0.05,P<0.05)。见表2。
2.2 各组小鼠双侧肾周白色脂肪及肩胛间棕色脂肪病理形态变化
在白色脂肪中,空白组脂肪细胞形态结构正常,排列紧密,呈蜂窝状;模型组与空白组相比细胞体积明显增大,呈现出大空泡的脂肪室,且形状不规则,白色脂肪特征明显;针刺组白色脂肪细胞出现多室,细胞变小、变圆,组织更加致密;在棕色脂肪中,空白组小鼠呈现近圆形的小的脂肪室,脂肪细胞旁边具有丰富的毛细血管;模型组小鼠呈现出较大的、单个空泡脂肪室;与模型组相比,针刺组细胞较小,细胞数目增多呈片状,细胞间的毛细血管更加丰富,表明针刺后小鼠肩胛间的棕色脂肪细胞出现了增殖与分化。见图1。

注:A:空白组白色脂肪;B:模型组白色脂肪;C:针刺组白色脂肪;D:空白组棕色脂肪;E:模型组棕色脂肪;F:针刺组棕色脂肪。
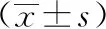
表2 各组小鼠体重、腹围治疗前后的比较
2.3 针刺对WAT中UCP1、PGC-1α、PRDM16蛋白水平的影响
与空白组相比,模型组的WAT中的UCP1、PGC-1α和PRDM16蛋白水平明显下降(P<0.05,P<0.05,P<0.05);与模型组相比,针刺组的UCP1和PRDM16蛋白水平明显升高(P<0.05,P<0.05), PGC-1α呈上升趋势但无统计学差异。见表3、图2。

表3 各组小鼠WAT中UCP1、PGC-1α、 PRDM16蛋白表达的比较

图2 各组小鼠WAT中UCP1、PGC-1α、 PRDM16蛋白表达的比较
2.4 针刺对WAT中UCP1、PGC-1α和PRDM16 mRNA表达的影响
与空白组相比,模型组WAT中UCP1、PGC-1α和PRDM16 mRNA表达显著下降(P<0.05,P<0.05,P<0.05);与模型组相比,针刺组WAT中UCP1和PRDM16 mRNA表达明显上升(P<0.05,P<0.05),PGC-1αmRNA表达呈上升趋势,但无明显统计学差异。见表4。

表4 各组小鼠WAT中UCP1、PGC-1α、 PRDM16 mRNA表达的比较
3 讨论
脂肪组织是机体主要的代谢器官,在能量稳态中具有关键作用[13]。UCP1的过度表达是白色脂肪棕色化的一个重要标志,在BAT中尤为明显。与其他细胞相比,棕色脂肪细胞主要通过UCP1以热能(非战栗性产热)的形式,将线粒体膜间质子渗透内膜至线粒体基质中,从而更大程度地解偶联三磷酸腺苷合成过程中线粒体的电子传递。PGC-1α是脂肪棕色化过程中一个重要的转录因子,是线粒体产热和氧化磷酸化的主要调节基因,它能够结合UCP1的启动子区,高表达的PGC-1α可上调UCP1的表达水平,加速机体产热[14]。PRDM16既可促进棕色脂肪的产生,也能抑制白色脂肪的分化。WAT中PRDM16的表达代表白色脂肪棕色化的程度[15],同时PRDM16过度表达可以诱导UCP1和PGC-1α的高表达[16]。本研究针刺干预后腹型肥胖小鼠的体重和腹围均明显下降;其病理图片WAT和BAT细胞变小,更致密,表明针刺可以促进棕色样脂肪和BAT的增殖和分化。同时针刺组的WAT中棕色脂肪的标志物的UCP1、PGC-1α和PRDM16的mRNA表达和蛋白水平均上调,更是验证针刺可能通过调节脂肪棕色化,增加机体能量消耗,减少脂肪累积,进一步改善肥胖。
腹型肥胖的起因多与带脉约束功能失调有关,带脉“起于季肋,环身一周”,经带脉、五枢、维道三穴与足少阳胆经交会。以横行腹部为特点,起到约束纵行上下的诸条足经和奇经的作用。带脉失约,则脾不升清、胃不降浊如“腹满腰溶溶若坐水中”,腹部脂肪堆积则“纵腹垂腴”,腹型肥胖的病变部位正处于带脉循行的范围内。因此,本研究以通调带脉为治则,选用带脉与足少阳胆经的交会穴带脉穴,《针灸大成》记载,带脉穴可主治“腰腹纵,溶溶如囊水之状”,因此针刺带脉穴可以激发带脉经气,提高约束能力,改善腹型肥胖。李敏等[17]以带脉穴位埋线法治疗腹型肥胖中风患者疗效显著,优于二甲双胍组和空白对照组。沈凌宇等[18]选用带脉、天枢、大横等穴位对腹型肥胖多囊卵巢综合征(polycystic ovary syndrome, PCOS)患者针刺治疗12周后发现,通调带脉针刺法可显著降低腹型肥胖PCOS患者的腰围、血清空腹胰岛素和胰岛素抵抗指数。李媛媛等[19]针刺治疗代谢综合征大鼠带脉穴4周后,针刺组大鼠体重、空腹血糖值、胰岛素抵抗值(HOMA insulin-resistance,HOMA-IR)以及血脂三项包括甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)和低密度脂蛋白(low-density lipoprotein cholesterol, LDL-C)较模型组明显下降(P<0.05),表明针刺带脉穴可以改善代谢综合征大鼠胰岛素抵抗,具有减重调脂降血糖的作用。王海英等[12]以电针腹型肥胖大鼠双侧“带脉穴”干预8周后,可有效减少腹型肥胖大鼠体重和腹围,降低血清中TC、TG、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)水平,改善腹型肥胖大鼠肝脏脂质代谢。本研究在中医整体观和经络辨证的基础上,拟通调带脉法治疗腹型肥胖取得良好的效果,与上述结论相符合。
综上所述,针刺带脉穴可明显抑制高脂饮食诱导的腹型肥胖小鼠体重和腹围的增长,改善WAT和BAT细胞形态,增加WAT中棕色脂肪的标记物UCP1、PGC-1α和PRDM16基因和蛋白的表达,激活棕色脂肪组织活性的同时诱导白色脂肪棕色化,增加产能,减少白色脂肪在腹部的堆积,在研究肥胖等相关代谢性疾病中具有重要意义。
