羟基磷灰石基生物材料培养破骨细胞研究现状
2020-12-30陈小波
陈小波, 何 星
(上海理工大学 材料科学与工程学院,上海 200093)
骨重建由激活、再吸收、逆转、形成和终止5 个阶段组成,此过程中成骨细胞(osteoblast,OB)、OC、骨细胞(osteocyte)等基本的多细胞单元(basic multicellular unit,BMU)参与重建,另外巨噬细胞(macrophage,MP)、B 淋巴细胞和T 淋巴细胞在内的免疫细胞也参与重建[1-2]。骨重建过程中OB 介导的骨形成过程和OC 介导的骨吸收过程紧密联系,OB-OC 介导的再吸收-形成平衡系统是维持正常骨平衡过程的关键[2]。如图1 所示。平衡系统中OB 分泌核因子κB 受体活化因子(RANKL)作为主要配体与破骨细胞前体细胞(pre-osteoclasts,POC)的受体核因子κB 受体活化因子(RANK)结合,正向刺激POC 的分化及相应骨吸收过程。来自OB、单核细胞以及T、B 淋巴细胞的骨保护素(osteoprotegerin,OPG),可与RANK 竞争性结合RANKL 进而抑制POC 的分化活性,抑制OC 吸收过程促进骨吸收和骨形成[3]。RANKL/RANK/OPG 作为骨吸收过程中重要信号通路维持骨吸收平衡系统,OB-OC 过程因人体病变等因素干扰后,骨吸收-形成平衡过程即会失衡,从而造成骨质疏松或骨质增生等骨科疾病。
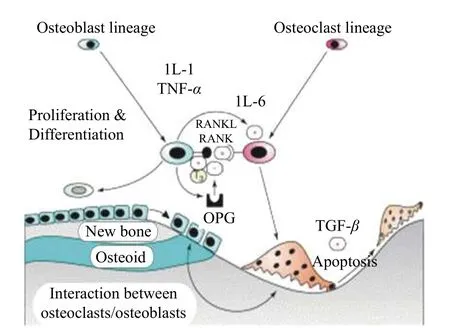
图 1 骨重塑过程破骨细胞与成骨细胞相互作用[2]Fig.1 Interaction between osteoclasts and osteoblasts during bone remodeling[2]
OC 是骨修复过程中唯一多核巨细胞(内含3-50 个紧密堆叠细胞核),主要来源于造血干细胞,也可由树突状细胞、B 淋巴细胞、单核细胞和巨噬细胞分化而来。OC 主要分布于骨质表面、骨内血管通道周围等,重塑阶段中负责脱钙和骨基质的吸收。如图2 所示,参与骨吸收期间成熟OC 可划分四种膜区:封闭区、皱褶边缘区、基底外侧区和功能性分泌区,皱褶的边界进一步划分为外周融合区和中心区域,其中封闭区为环状结构。再吸收过程中密封区紧紧粘附在骨表面,褶皱缘细胞膜释放H+、Cl-及多种蛋白水解酶(如组织蛋白酶K 和基质金属蛋白酶)等。OC 与骨表面间形成较高的酸性环境,骨中矿物质经OC 等骨吸收细胞溶解后溶解为Ca2+,等离子可被OC 吸收转移。Ca2+为调节OC 分化、吸收重要信号,可被周围OB 吸收利用实现骨形成即骨再吸收-骨形成循环系统。
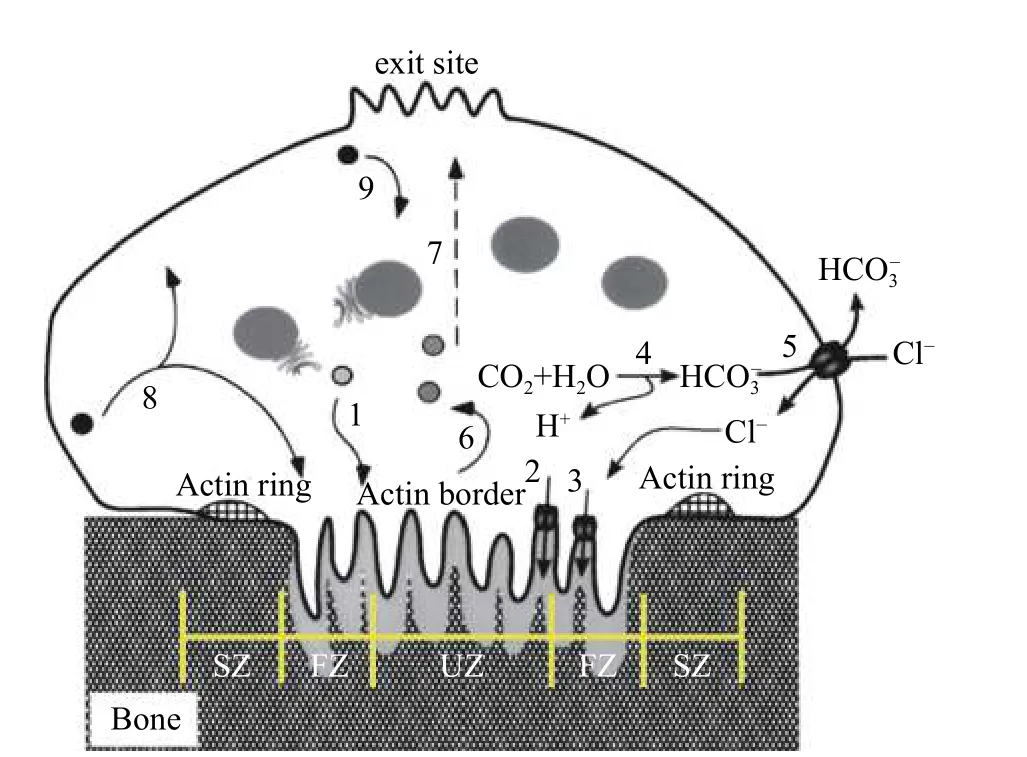
图 2 成熟OC 骨吸收反应示意图[2,4]Fig.2 Schematic diagram of bone resorption in mature osteoclasts[2,4]
如图3 所示,骨主要由有机物、无机物及水3 部分组成,骨中70%左右为无机物-骨矿物质,主要由HA(主要成分)、碳酸钙、氟化钙、氯化钙及锌等微量元素组成[5]。骨矿物质中含有微量元素、碳酸盐及硅等,骨矿物质Ca/P 处于1.37~1.87 之间,HA、β-磷酸三钙(β-tricalcium phosphat,β-TCP)、双相磷酸钙(biphase calcium phosphate,BCP)等与天然骨Ca/P 相近,具备优异的生物相容性、骨诱导性、生物降解性、骨传导性,因而广泛应用于生物骨修复材料。
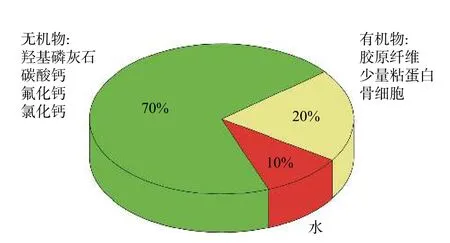
图 3 骨的主要成分[5]Fig.3 Main component of bone[5]
本文针对OC 与常用羟基磷灰石基磷酸钙材料(HA-CaPs)体外试验研究结果,探讨HA-CaPs 对POC增值分化及OC 吸收活性的影响,并总结HA-CaPs的体内吸收降解机制和体内Ca2+信号对OC 增殖分化吸收活性影响,从而为HA-CaPs 生物材料在骨修复中应用和研究提供理论基础。
1 羟基磷灰石基体外培养破骨细胞分化和吸收活性
HA、β-TCP 和BCP 因其自身高稳定性和较好的生物活性,相对于其他磷酸钙材料较广泛应用于骨修复生物材料,现就3 种材料体外培养破骨细胞研究作阐述与总结。
1.1 羟基磷灰石体外培养破骨细胞活性
HA 作为骨无机物矿物质主要物质,是应用最广泛的骨再生生物材料之一。可利用不同试剂(不同钙、磷源),利用不同合成方法诸如化学沉淀法、水热法、固相研磨法、溶胶-凝胶法等制备和调控HA 的形貌、物化性能及结晶度等理化参数[6]。
Spence 等[7]利用酸碱中合法,设定Ca/P 为1.67,制备HA 前驱体,经冷压成型和高温煅烧制备HA 陶瓷压片,高温消毒后培养人外周血单核细胞(peripheral blood mononuclear cells,PBMCs)。利用细胞影像技术、扫描电子显微镜(scanning electron microscope,SEM)及相关基因检测技术观察POC 分化和OC 吸收活性,试验结果表明HA 压片材料组POC 分化活性较高并可大量观察到成熟OC,压片表面出现大量吸收陷窝,OC 吸收效应明显,说明HA 材料具有很好的促骨吸收效应。Costa-Rodrigues等[8]利用HA 粉末经冷压成型和高温煅烧技术制备陶瓷压片,经不同粗糙度SiC 砂纸组合成不同打磨工序获得3 种不同表面粗糙度(Ra=0.582,0.187,0.043 μm)的压片,经高温消毒处理后培养PBMCs,分化活性结果表明0.187 μm组支架培养OC 分化活性最高,说明支架一定的表面粗糙度有利于提高POC 分化活性;定量分析吸收陷窝总面积,粗糙度较高的压片表面OC 吸收陷窝面积比光滑表面的高,说明具有一定粗糙度的陶瓷压片有利于促进OC 分化和吸收活性。
骨矿物质中含有Si 等微量元素影响骨修复过程中OC 再吸收活性,Botelho 等[9]用适量Si(OH)4替代H3PO4与CaCO3反应制备Si-HA,经冷压煅烧后制备陶瓷压片培养PBMCs,分析发现1.5%Si-HA组细胞培养基中钙和磷酸盐最多,说明OC 吸收活性较高,因此,Si-HA 可被OC 吸收并且Si 促进OC再吸收。Friederichs 等[10]研究发现体外培养21 天后的OC 数量在HA、Si-HA(Si 质量分数为0.5%)和Si-HA(Si 质量分数为1.2%)上数量相当,但Si-HA 上的肌动蛋白环封闭区形态与正常骨上的相似,在Si-HA(Si 的质量分数为1.2%)压片表面观察到OC 具有较大的尺寸,从而保证OC 具有更恒定的封闭区,进而提高HA 溶解量,说明Si 在掺入HA 基骨水泥后可提高OC 吸收活性。
1.2 β-磷酸三钙体外培养破骨细胞活性
β-TCP 的Ca/P 为1.50,处于骨矿物质的1.37~1.87 之间,也是一种常见骨修复材料。β-TCP 具有相对较高的溶解度,Mayr 等[11]比较HA/β-TCP 两组材料培养POC,比较两者降解速率并结合OC 分化再吸收试验结果表明,β-TCP 参与培养POC/OC 时,降解速度较快,导致Ca2+等离子浓度较高,相比HA、BCP 等材料而言抑制相关POC 分化和OC 吸收活性,如图4 所示。添加微量元素可提高β-TCP 支架力学性能,Roy 等[12]采用β-TCP 粉末与高纯度SrO和MgO 混合制备了3 种β-TCP 复合物:β-TCP,β-TCP/1.0%Mg(质量分数),β-TCP/1.0%Sr(质量分数)。经研磨冷压成型后高温煅烧制备光滑陶瓷圆片,培养RAW264.7 细胞,试验结果表明Mg 掺杂可能抑制RAW264.7 细胞分化活性,另有研究表明锌掺杂β-TCP (Zn/0.25%)(质量分数),POC 分化活性相对会抑制但OC 吸收活性会相对增加[13]。
1.3 双相磷酸钙体外培养破骨细胞活性
1.3.1 双相磷酸钙制备
双相磷酸钙(biphasic calcium phosphate,BCP)由HA 和β-TCP 2 种物相混合组成,可通过HA/β-TCP 比例物理复合,可精准调控物相比。另可通过调节钙、磷源的Ca/P 介于1.50~1.67 之间生成前驱体缺钙磷灰石(calcium-deficient apatite,CDHA)高温煅烧制备陶瓷支架[14],制备过程中可通过改变反应物Ca/P(1.50~1.67)调控CDHA 中x 值即BCP 中HA/β-TCP 物相比。反应溶液pH 通过影响溶液离子决定产物主要物相β-TCP(pH~7)和BCP(pH≥9);聂磊等[5]通过调控CDHA 煅烧温度范围650~1 300 ℃,利用X 射线衍射仪(X-Ray Diffraction, XRD)分析产物物相发温度低于850 ℃时,β-TCP 的XRD 衍射峰较弱,温度高于1 100 ℃则会出现α-TCP,考虑HA,β-TCP,α-TCP 三相相变温度区间说明煅烧温度对于BCP 物相影响较大。说明通过化学合成法制备BCP 要调控反应物Ca/P(1.50~1.67),反应溶液pH 保持在9~11 高碱性,煅烧温度保持950~1 150 ℃为最佳制备条件[5]。目前关于BCP 支架制备方法多样,针对不同制备方法有不同特点和不足,表1 详细阐述各制备方法优缺点。

图 4 HA 和β-TCP 降解速度(上)和OC 吸收陷窝大小比较HA(下左)和β-TCP(下右)[11]Fig. 4 HA and β-TCP degradation rate (top) and OC absorption lacuna size comparison of HA (bottom left) and β-TCP (bottom right)[11]

表 1 BCP 支架制备工艺特点比较[5,16]Tab.1 Comparison of process characteristics of BCP scaffold[5,16]
1.3.2 双相磷酸钙体外培养破骨细胞分化活性
Yamada 等[15]利用化学沉淀法制备不同Ca/P缺钙磷灰石后调控煅烧温度950 ℃高温煅烧2 h后,制备4 种不同HA/β-TCP(100/0,75/25,25/75,0/100)BCP 后经成型工艺制备厚度1 mm 陶瓷压片进行兔骨细胞体外培养。利用SEM 观察比较细胞培养后压片表面吸收陷窝的大小,结果发现双相条件下细胞吸收活性高于任何一个单相的,相比β-TCP 组吸收活性相对最低,说明高溶解性Ca-P 陶瓷不利于OC 吸收,可能是材料在OC-基质界面的微环境中产生了高浓度的Ca2+,从而抑制OC 等吸收活性。相对于化学合成的BCP,物理研磨混合可精确调控BCP 材料HA/β-TCP 比值,有利于观察比较不同比例条件下对OC 等细胞分化吸收活性影响。Detsch等[16]利用喷雾干燥法制备HA、β-TCP 粉体后设定HA/β-TCP 为100/0,60/40,100/0 3 种比例制备浆料,利用3D 打印技术制备生坯支架后经1 300 ℃高温煅烧后制备成孔隙率体积分数为52~56%的陶瓷支架,高温消毒后培养小鼠RAW264.7 细胞,用细胞线粒体活性等基因检测检测OC 活性、SEM 观察比较OC 形态及吸收陷窝形貌观察。3 种材料对RAW264.7 细胞分化活性影响差别不大,但是,吸收陷窝孔隙尺寸比较结果说明BCP 材料相对提高OC 吸收活性。
1.3.3 双相磷酸钙体外培养破骨细胞吸收活性
Schaefer 等[17]利用纯HA/β-TCP 粉体后以HA/β-TCP 为100/0,60/40,100/0 3 种比例混合,分别利用单向压制和聚氨酯复型技术制备2D,3D 生坯(孔径密度为45 ppi)后1 300 ℃煅烧1 h 制备陶瓷支架经高温消毒后培养RAW264.7 细胞,观察细胞分化吸收活性。研究发现2D 陶瓷压片中BCP(60/40)有利于促进RAW264.7 的破骨分化,HA 次之而β-TCP 则相对效果最差,相应的OC 吸收活性BCP(60/40)组吸收陷窝尺寸较大较明显说明OC 吸收活性较高,2D/3D同种材料细胞分化吸收试验结果表明2D 更有利于促进细胞的分化和吸收活性。3D 的陶瓷支架较高的孔隙率加快BCP 材料自身降解速度,从而造成细胞周围[Ca2+]等离子浓度较高影响细胞分化过程中信号通路进而抑制细胞分化活性,弱化OC 吸收活性。Mayr 等[18]利用HA 和β-TCP 物质混合研磨冷压烧结制备HA/β-TCP 为100/0,80/20,60/40,40/60,20/80 和0/100,分析可得HA/β-TCP 为80/20,60/40两种材料最有利于破骨前体细胞分化,因此,HA/β-TCP 比例为80/20 和60/40的BCP 被认为是很有潜力的人工骨替代材料,对于OC 具有最佳的溶解和再吸收性能,如表2 所示。
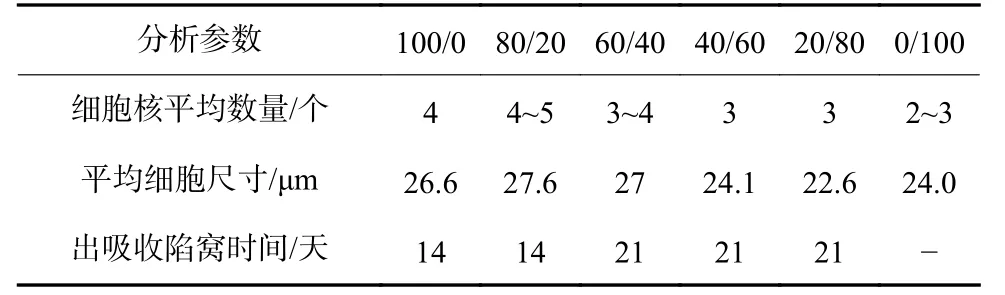
表 2 HA/β-TCP 与OC 分化/吸收活性关系[17-18]Tab.2 Relationship between HA/β-TCP and OC differentiation/absorption activity[17-18]
表3 为HA,β-TCP 和BCP 体外培养OC 活性比较。HA、β-TCP 和BCP 3 种生物材料参与OC 培养过程和试验结果说明材料物相、支架形貌及粗糙度等对POC 分化及OC 吸收活性均有影响,POC 分化过程处于动态变化和不断迁移过程并且细胞周围Ca2+等离子均会影响OC 相关活性。生物体内高度复杂的环境要求磷酸钙生物材料必须能够以适当的速度降解,以达到与新骨组织再生的平衡,同时为细胞生长和分化提供理想的场所。

表 3 HA,β-TCP 和BCP 体外培养OC 活性比较Tab.3 Comparison of OC activity in vitro cultured with HA, β-TCP and BCP
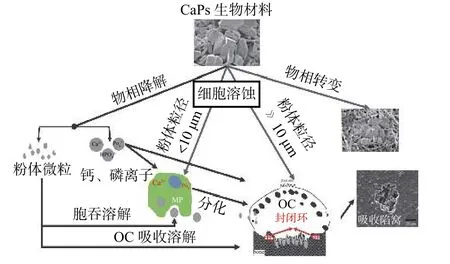
图 5 HA-CaPs 生物体内降解转化与分化吸收相互作用示意图[20]Fig. 5 Schematic diagram of the interaction of HA-CaPs in vivo degradation, transformation, differentiation and absorption[20]
2 破骨细胞对羟基磷灰石基生物材料的吸收作用
2.1 羟基磷灰石基生物材料体内降解机制
图5 为HA-CaPs 生物体内降解转化与分化吸收相互作用示意图。HA-CaP 作为生物可降解材料参与OC 等骨吸收细胞进行接触后,材料自身可自然降解,降解产物主要有等组成。磷酸钙的生物降解机制有2 种解释:一种是将物质分散成颗粒,植入的材料首先被分散成微小的颗粒或碎片,最后碎片被吞噬细胞转移;另一种是将物质溶解成Ca2+和HPO42-离子然后被细胞吸收,进行骨骼修复和重建形成新的骨骼[19]。后续研究发现,2 种降解溶蚀机制在参与细胞反应中是同时发生的,Sheikh 等[20]将生物体内植入材料的降解过程归纳为3 种反应(物理、化学、生物反应)和2 个阶段(第1 阶段:早期溶解;第2 阶段:细胞介导吸收)。
HA-CaPs 因自身具有一定溶解度,植入体支架等材料首先会溶解,溶解过程中支架材料中结合较疏松处发生脱离等现象即出现小颗粒[21]。未成熟OC或巨噬细胞即会识别粒径小于10 μm 粉体,细胞膜内陷胞吞颗粒进入细胞内部经细胞内反应溶解变为Ca2+,HPO42-等离子。对于较大的HA-CaPs 颗粒及支架材料细胞介导吸收即OC 吸收,成熟OC 经识别和移动吸附后于HA-CaPs 表面之间形成封闭反应环[22]。材料表面形成较高的酸性环境,多数HA-CaPs 稳定存在的pH 范围处于偏碱性范围,在高强酸环境下极易发生溶解及溶蚀即会发生生物溶解过程[23]。
2.2 羟基磷灰石基生物材料性质对破骨细胞分化、吸收活性的影响
HA-CaPs 经相关细胞吸收溶解及自身物理降解后,对于细胞而言其生理环境周围即出现Ca2+等离子。对于生物体而言Ca2+作为体内第二信使,对于OC 的增值、分化及骨吸收过程均有较大的调控影响。OC 生长过程一般为巨噬细胞等POC 经核因子κB 受体活化因子配体(RANKL)刺激后,单体细胞接触融合而后形成多核OC。分化过程中已知RANKL 信号可诱导[Ca2+]振荡变化,导致Ca2+/钙调神经磷酸酶去磷酸化并且激活NFATc1,NFATc1移位至细胞核诱导OC 特异性基因转录使OC 得以分化。尽管少有遗传学证据表明OC 分化需要[Ca2+]振荡信号,但在几乎所有没有[Ca2+]振荡的情况下,这一诱导分化过程都会受到损害[24]。这表明[Ca2+]振荡对于NFATc1 诱导OC 形成至关重要。另研究表明,成熟OC 中[Ca2+]的变化可调控OC 的骨吸收活性,如细胞运动、抑制酶的释放、抑制核的形成[25]。
3 总 结
巨噬细胞在骨表面迁移融合形成多核OC,OC吸附于HA-CaPs 表面,经物理降解和细胞化学溶解形成Ca2+等离子。相对OC 细胞而言,[Ca2+]作为重要生物信号反向调节OC 等相关细胞分化吸收活性,因此,HA-CaPs 研究重点即调控材料物相、陶瓷支架孔隙率(比表面积)等材料宏观降解能力以期在参与细胞吸收过程中所产生的动态降解过程,符合OC 等骨吸收细胞所需的合适离子环境。良好生物活性HA-CaPs 植入或培养OC 过程中,其良好生物相容性以保证与OC 等细胞相互影响,构成相对平衡稳定的吸收-调节系统,从而保证骨修复系统的平衡与稳定。随着对离子、分子、药物和生长因子功能化的HA-CaPs 的相关研究不断增加,使得用于硬组织修复的HA-CaPs 生物材料的性能显著提高。关于HA-CaPs 生物学特性及应用的重要发现,对于在各种临床应用中寻找理想的骨替代物具有很高的价值。为了更好地理解HA-CaPs 及其植入骨缺损部位后的一系列反应或生物学变化,需要作更多深入研究。
