藜麦花期水分胁迫下的代谢组学分析
2020-12-29时羽杰邬晓勇唐媛糜加轩万雪琴
时羽杰,邬晓勇,唐媛,糜加轩,万雪琴
(1.四川农业大学林学院,四川 成都 611130; 2.成都大学农业农村部杂粮加工重点实验室,四川 成都 610106; 3.成都大学药学与生物工程学院,四川 成都 610106)
藜麦(Chenopodiumquinoa)是苋科藜亚科藜属的1 a生双子叶草本植物,是喜冷的高海拔作物,富含蛋白质、矿物质、氨基酸、纤维素、维生素等营养成分[1-2]。联合国粮农组织(FAO)认为藜麦是唯一一种单体植物即可以满足人体基本营养需求的食物,并正式推荐为最适宜人类的“全营养食品”[3]。其生物产量高、营养价值丰富、适应性强,具有耐寒、耐旱、耐瘠薄、耐盐碱等特性[4-6],常被用于粮食和饲料作物的开发利用,也成了一些地区发展经济的重要作物[7-8]。
农作物在生长过程中常受到多种环境胁迫的影响[9],造成生长发育不良,甚至绝收。水分胁迫是影响作物生产力的重要因素之一,也是影响作物生长和发育的一个重要环境因子,主要包括了水涝和干旱2种形式[10-11]。研究发现,作物开花期间,组织幼嫩,抗性较弱,易受到环境因子的胁迫,导致产量和品质降低[12-14]。藜麦起源于南美洲安第斯山脉高原地区[15],进化出了较好的抗逆性能力。研究这种抗逆性机制,对植物栽培指导及抗性品种的选育有重要意义。目前,对藜麦的抗逆性机制研究,主要集中在盐胁迫后生理指标的变化[16-18]、形态特征变化[19-21]、转录组分子机制研究[22-23],干旱胁迫研究较少,也只局限于生理指标和形态特征的变化[24-27],而有关藜麦水涝胁迫的研究更是微乎其微。
代谢组学(Metabolomics)是继基因组、转录组和蛋白质组学后兴起的一个系统生物学科[28]。通过对存在于生物体细胞、组织和生物流体中的小分子代谢物(相对分子质量小于1 000)进行系统分析[29],从中检测并筛选出具有显著差异的代谢物质,并以此为基础研究生物体的代谢过程和变化机制[30]。常被用于药物鉴定和治疗机制的研究[31-33],植物的抗逆性研究[34-36],家系图谱分析[37]等。
本研究利用代谢组学技术,以藜麦为材料,采用盆栽法研究水分胁迫后其生理生态变化及代谢物质差异,了解水分胁迫下的主要代谢通路,为藜麦的抗水分胁迫机制及代谢调控机制奠定基础,同时,也为制定花期水分栽培的科学管理制度提供理论指导,为藜麦的引种推广提供借鉴。
1 材料与方法
1.1 试验材料
本试验选用的材料“陇藜3号”由成都大学农业农村部杂粮加工重点实验室和国家杂粮加工技术研发分中心提供。种子纯净度和发芽率均符合播种质量要求。
藜麦种子用质量分数为0.1%~0.15%的高锰酸钾溶液浸泡20 min,以利消毒。营养土和自然土按同等比例进行混合后使用,选取子粒饱满、大小均匀、无机械损伤、无病虫害的成熟藜麦种子,均匀播撒于直径为20 cm的塑料花盆中,浇适量的水,再用1~2 cm厚的营养土覆盖。待幼苗长出第4片真叶后进行间苗,留下长势相同的幼苗且保持合适的株间距[38]。由于藜麦抗旱性较强,不需要进行频繁浇水。待苗长至第8片真叶时,再进行一次间苗,每盆定苗4株。
1.2 试验方法
1.2.1 胁迫处理 初花期(显穗后10 d),取长势一致的材料进行胁迫处理。对照组使用去离子水进行浇灌;干旱胁迫组使用质量分数为30%的PEG-6000进行浇灌处理[39];水涝胁迫组使用双套盆法进行淹水模拟[40],将盆栽直接浸置水盆中浇灌至水浸没花盆。在处理48 h后进行取样,每个处理6盆重复,取从顶芽往下数的第3个节间处的叶片后立即用去离子水洗净并用无菌滤纸吸干,包裹于锡箔纸中,迅速置于液氮冷冻后,于-80 ℃超低温冰箱保存,用于生理指标和代谢组学分析。
1.2.2 生理指标测定 过氧化物酶(POD)活性、总抗氧化能力(T-AOC)、丙二醛(MDA)含量、可溶性糖(WSS)含量均采用南京建成生物工程研究所的试剂盒进行检测;可溶性蛋白(SP)含量采用考马斯亮蓝法测定[41]。
1.2.3 代谢组学分析 取同一批材料进行代谢组学分析,6个生物重复,共产生了2组对比数据,分别为正常对照组(CK)和干旱胁迫组(WD)、正常对照组(CK)和水涝胁迫组(WW)。代谢物的分离鉴定平台为气相色谱串联质谱GC-MS(PerkinElmer,USA),分析时每6个样本插入一个质控样本(QC)以观察仪器的重复性与稳定性。色谱柱为DB-5MS(Agilent,USA)。原始数据经MSDIAL软件进行峰识别、匹配、对齐等处理[42]。处理后的数据采用SIMCA-P14.1软件进行PCA,PLS-DA和OPLS-DA等多元统计分析和差异物质筛选。最后,将差异代谢物经过NIST,METLIN,MASSBANK等数据库进行鉴定获取CID号,根据CID号在Metaboanalyst平台进行相关代谢通路的分析。
1.2.4 数据处理 生理指标数据采用SPSS 26.0进行描述统计、方差分析和LSD多重比较,显著性差异的标准为P<0.05;代谢组学数据采用SIMCA-P和TBtools进行绘图。
2 结果与分析
2.1 水分胁迫对藜麦花期生理指标的影响
由表1可知,水分胁迫后SP含量降低,但与对照均无显著差异;WSS含量显著增加(P<0.05),且干旱胁迫组增加幅度显著大于水涝胁迫组;POD活性显著增加(P<0.05),但干旱胁迫组和水涝胁迫组间无明显差异;T-AOC变化趋势与WSS含量变化趋势相同,均表现为显著增加(P<0.05),且干旱胁迫组增加幅度显著大于水涝胁迫组;而MDA含量在受到水分胁迫后表现为增加的趋势,但增加幅度有明显的差异,其中干旱胁迫MDA含量组较对照组表现为显著增加(P<0.05),水涝胁迫组的MDA含量增加幅度则较小,与对照组无显著差异。说明藜麦花期受到水分胁迫时,可通过提高渗透调节物质含量和抗氧化酶活性来响应胁迫,且在水涝胁迫下影响较小,而在干旱胁迫下影响较大,MDA含量较CK组显著增加,可能是氧自由基积累过多,已对膜系统产生了严重损伤。
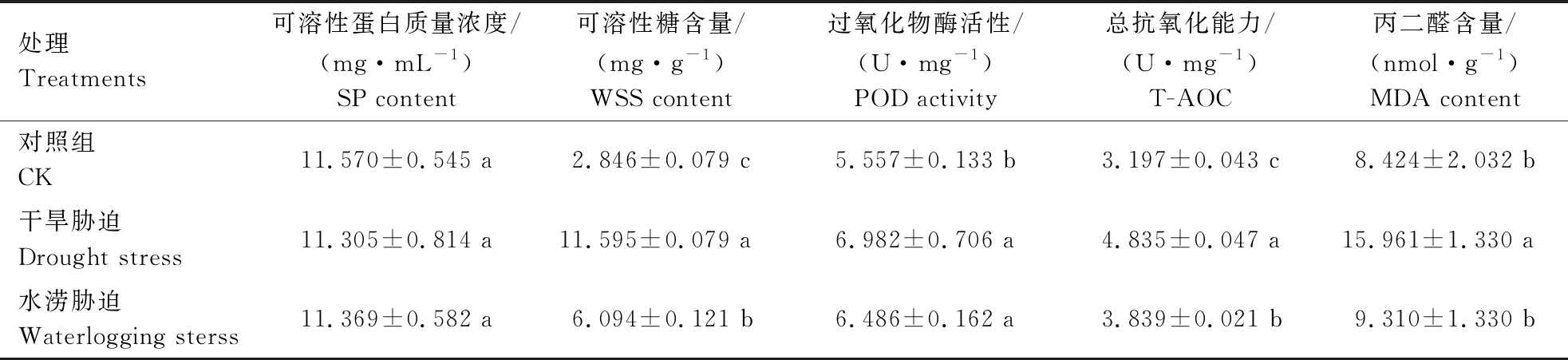
表1 水分胁迫对藜麦花期生理指标的影响
2.2 水分胁迫条件下藜麦花期的代谢组学分析
2.2.1 PCA与OPLS-DA分析 主成分分析(Principal component analysis,PCA)得到的PCA模型能全面地反映代谢组整体数据的原始状态,可以用于异常样本的发现与剔除,提高模型的准确性[43-44]。如图1所示,所有样本都在95%的置信区间内,且CK,WD,WW组间均有明显的界限,说明各组间的整体代谢物质差异显著;除了QC_1,WD_1,WD_2等3个样本外,其余样本组内较为聚集,说明数据重复性较好,可用于后续的分析。
虽然主成分分析法能够有效地提取主要信息,但是对于相关性较小的变量不敏感,而正交-偏最小二乘判别分析(Orthogonal projections to latent structures discriminant analysis,OPLS-DA)能通过正交信号校正技术将数据集X分解为与Y相关和非相关的两类,过滤掉与分类无关的信息,将相关的信息集中在第1个预测成分,更好地观察组间的差异[45-46]。如图2所示,CK和干旱胁迫与CK和水分胁迫都被分开且均匀地分布于PC 1左右两侧,说明藜麦花期受到水分胁迫后,代谢物质发生了显著性变化。为了验证OPLS-DA模型是否过拟合,进行置换检验,对模型进行n=200的排列验证,其中R2和Q2表示拟合优度系数,当R2和Q2回归线的斜率大于1,且置换检验图中所有R2和Q2左边的点都低于最右边的点,这样表示模型可靠[47-48]。如图3所示,CK和干旱胁迫组的R2=0.996,Q2=0.266,CK和水分胁迫组的R2=0.755,Q2=0.416,且所有R2和Q2左边的点都低于最右边的点。说明这2组OPLS-DA模型可靠,可以用于差异代谢物质的筛选。

注:CK表示正常对照组;QC表示质控样本;WD表示干旱胁迫; WW表示水涝胁迫。下同。

图2 对比组的OPLS-DA模型得分图

注:左图为干旱胁迫组,右图为水涝胁迫组;其中R2和Q2表示拟合优度系数,R2为模型对矩阵的解释率,Q2为模型的预测能力。
2.2.2 差异代谢物的筛选 通过OPLS-DA的S-plot图进行差异代谢物的筛选,其中横坐标表示主成分与代谢物的协方差,纵坐标表示主成分与代谢物的相关系数,越靠近右上角和左下角的代谢物表示其差异越显著,一般选取VIP≥1的物质作为差异代谢物。如图4所示,VIP≥1的点已用红色标出。结合火山图(V-plot)能更加全面地反映差异数据的变化规律,更利于筛选差异代谢物[49]。筛选的标准为P≤0.05且VIP≥1,由图5所示,CK和干旱胁迫组中总共筛选出60个差异代谢物,且代谢物主要以下调为主。其中有53个下调代谢物主要包括16个氨基酸类(色氨酸、脯氨酸、甘氨酸、谷氨酸、丝氨酸和蛋氨酸等),6个有机酸类和4个脂肪酸类(甘油酸、十四烷酸、肉豆蔻酸等),14个糖类及其衍生物(阿拉伯糖、木酮糖、果糖、乳糖等)和一些多酚、醇类、生物碱、维生素、胺类和核苷衍生物;7个上调代谢物分别是富马酸、艾杜糖、尿苷、肌醇、表没食子儿茶素没食子酸酯、N-乙酰-D-氨基葡萄糖和芥子酸。CK和水分胁迫组中总共筛选出74个差异代谢物,且代谢物主要以上调为主。其中,有57个上调代谢物主要包括13个氨基酸类(脯氨酸、丙氨酸、甘氨酸、丝氨酸等),12个有机酸类和3个脂肪酸类(十四烷酸、异柠檬酸、乳糖酸、肉豆蔻酸等),17个糖类及其衍生物(阿洛糖、潘糖、麦芽糖、乳糖醇等)和一些多酚、生物碱、胺类和核苷衍生物;17个下调代谢物主要包括氨基酸类、糖类、有机酸类(色氨酸、天冬氨酸、谷氨酸、纤维二糖、蔗糖、甘露糖、原儿茶酸、十五烷酸等)。根据所包含差异代谢物数量的多少,发现氨基酸类、糖类、有机酸类和脂肪酸类是最活跃的4个类别。这些数量较多的差异代谢物可能与藜麦花期响应水分胁迫的机制密切相关。为进一步探究这些差异代谢物质响应胁迫的机制,对其参与的代谢通路进行分析。

注:左图为干旱胁迫组,右图为水涝胁迫组;每1个点代表1种代谢物质,其中绿点为VIP<1,红点为VIP≥1的差异代谢物。

注:左图为干旱胁迫组,右图为水涝胁迫组;每1个点代表1种代谢物质,其中绿点仅为VIP≥1,红点为VIP≥1且P<0.05的显著差异代谢物。
2.2.3 差异代谢物聚类热图分析 聚类热图表现的是一个数据矩阵,可以通过不同颜色的梯度来显示代谢物质差异,再通过聚类分组,将代谢表达模式相近的组归为1类,同组的代谢物质可能具有相似的功能或参与了相同的代谢途径,可以以此来推测未知代谢物或已知代谢的功能[50-51],如图6所示。CK和干旱胁迫(WD)组中,样本被分为3类:第1类是CK_5,CK_1,CK_4,CK_2,CK_3,CK_6;第2类是WD_1和WD_2;第3类是WD_3,WD_4,WD_5,WD_6。说明CK组内代谢物质差异不大,样本重复性较好,数据较为稳定,而干旱胁迫组内有2个样本单独聚为1类,再与CK组聚为1类,可能是由于采样不当引起的误差,而其余4个聚为1类。说明干旱胁迫组整体数据重复性仍较好,筛选出的代谢物与CK组存在明显差异,且大部分差异代谢物质表达下调。CK和水涝胁迫(WW)组中,样本被分为2类,第1类是CK的6个重复样本,第2类是水涝胁迫的6个重复样本。这说明组内的重复性都较好,且筛选出的代谢物在组间存在明显差异,水涝胁迫组中大部分代谢物质表达上调。这些筛选出的差异代谢物质可以用于后续的关键代谢通路分析。

注:图中红色的表示高表达代谢物,黑色的代表变化不大,绿色的表示低表达代谢物。列为不同的样本组,行为不同的代谢物质。
2.2.4 代谢通路分析 通过Metaboanalyst平台将有CID号的显著差异代谢物进行KEGG通路富集分析,如图7所示。CK和干旱胁迫组中注释到46条代谢通路,极显著的通路有4条,分别是氨酰-tRNA生物合成、二羧酸代谢、甘氨酸-丝氨酸和苏氨酸代谢、吲哚生物碱合成,显著的代谢通路有5条,分别是硫代谢、半胱氨酸与蛋氨酸代谢、精氨酸生物合成、丙氨酸-天冬氨酸和谷氨酸代谢、泛酸和辅酶A生物合成。其中,参与极显著代谢通路且被检测到的物质有13种,主要为氨基酸类及其衍生物和有机酸,分别是色氨酸、丙氨酸、缬氨酸、丝氨酸、蛋氨酸、谷氨酸、脯氨酸、高丝氨酸、甘氨酸、组氨酸、色胺、甘油酸、异柠檬酸,且均为下调表达。CK和水涝胁迫组中注释到47条代谢通路,极显著的代谢通路有3条,分别是氨酰-tRNA生物合成、二羧酸代谢、吲哚生物碱合成,显著的代谢通路有6条,分别是异喹啉生物碱合成、氰胺酸代谢、精氨酸生物合成、甘氨酸-丝氨酸和苏氨酸代谢、精氨酸和脯氨酸代谢、赖氨酸生物合成。其中,参与极显著代谢通路且被检测到的物质有14种,主要为氨基酸类及其衍生物和有机酸,10种上调代谢物,分别为异柠檬酸、甘氨酸、苯丙氨酸、酪氨酸、丝氨酸、异亮氨酸、组氨酸、蛋氨酸、脯氨酸、色胺,4种下调代谢物,分别为天冬氨酸、谷氨酸、色氨酸、草酸。

注:左图为干旱胁迫组,右图为水涝胁迫组;每1个点代表1个代谢通路,其中点的大小表示富集代谢物质的多少。
3 结论与讨论
3.1 水分胁迫对藜麦花期生理指标的影响
WSS含量、SP含量、POD活性、T-AOC和MDA含量是反映植物受胁迫的重要生理指标,可以判断其对胁迫的耐受性[52-54]。其中MDA是植物细胞膜脂过氧化的主要产物,对植物有毒害作用,其含量的多少直接反映了植物在逆境胁迫下膜受损伤程度[55]。WSS和SP是植物细胞中的重要渗透调节物质,POD是重要的抗氧化酶之一,在植物受到胁迫时,体内的活性氧会积累,MDA含量增加,对植物体造成伤害,其体内的渗透调节物质和抗氧化酶能够减缓膜脂过氧化的毒害作用[56]。藜麦花期受到干旱和水涝胁迫后,生理指标变化十分相似,除SP变化不大外,其他指标均呈明显上升(水涝胁迫组的MDA含量稍增加),干旱胁迫组的MDA含量增加的幅度较大。说明藜麦花期受到水分胁迫后,活性氧(ROS)过度积累损伤膜系统,蛋白质降解,自身通过调节活性氧系统来应对氧化损伤,如提高POD活性,同时提高WSS含量来减少细胞水分流失、维持细胞结构完整性。宿婧等[57]研究干旱胁迫对藜麦种子生理特性的影响,发现POD活性在干旱胁迫下显著增加,且随着PEG-6000质量浓度的增加而增加。董奇琦等[58]研究发现,花生在重度干旱胁迫下POD,SOD,MDA,WSS,Pro显著增加,SP含量呈下降趋势。此外,本试验中,干旱胁迫组的MDA含量显著增加,且增加幅度远大于水涝胁迫组,可能是由于藜麦花期对重度的干旱胁迫最为敏感所致。花期是藜麦营养生长阶段和生殖生长期开始阶段,干旱胁迫可导致其开花延迟、脱落,影响其子粒的形成,降低产量。董馥慧等[59]研究干旱胁迫对苦荞不同生育时期的影响,发现花期为最敏感时期,受干旱影响最大,其POD,MDA,Pro含量显著高于对照,SP含量显著低于对照。SP的变化与本研究有所不同,可能是藜麦比苦荞有更强的干旱耐受性所致。孙建等[60]研究轻、中、重3种干旱胁迫对芝麻花期生理指标的影响,发现叶片中的POD,SOD,Pro,SP和MDA随着胁迫程度的加剧呈不断上升趋势。
3.2 水分胁迫与代谢物的关系
水分胁迫后,干旱胁迫、水涝胁迫组与CK的代谢物均有显著差异。干旱胁迫组中总共筛选出60个差异代谢物,大部分为下调表达。差异代谢物注释到46条代谢通路,极显著的通路有4条,分别是氨酰-tRNA生物合成、二羧酸代谢、甘氨酸-丝氨酸和苏氨酸代谢、吲哚生物碱合成。这些通路可能与抗干旱机制密切相关。水涝胁迫组中总共筛选出74个差异代谢物,大部分为上调表达。差异代谢物注释到47条代谢通路,极显著的通路有3条,分别是氨酰-tRNA生物合成、二羧酸代谢、吲哚生物碱合成。这些通路可能与抗水涝机制密切相关。干旱胁迫与水涝胁迫的差异代谢物通路基本一致,差异代谢物种类也基本一致,主要是氨基酸类、有机酸类、脂肪酸类、糖类和一些多酚、生物碱、胺类、核苷衍生物,其中色氨酸、丙氨酸、缬氨酸、丝氨酸、蛋氨酸、谷氨酸、脯氨酸、高丝氨酸、甘氨酸、组氨酸、色胺、甘油酸、异柠檬酸是抗干旱的关键代谢物质,异柠檬酸、甘氨酸、苯丙氨酸、酪氨酸、丝氨酸、异亮氨酸、组氨酸、蛋氨酸、脯氨酸、色胺是抗水涝的关键代谢物质。冯瑛[61]通过代谢组学分析樱桃砧木的抗旱性机制,发现上调的差异代谢物主要是有机酸、氨基酸、碳水化合物和生物碱等,且最终将奎尼酸、苯丙氨酸、3-氰丙氨酸、天冬酰胺、对苯醌和植物鞘氨醇确认为干旱响应候选指示代谢物。吴栋等[62]分析水涝胁迫下烟草的代谢产物,发现主要上调的代谢物是氨基酸(脯氨酸、谷氨酸、丝氨酸和组氨酸等),有机酸(肉桂酸、阿魏酸、绿原酸和苹果酸等),多酚和生物碱。赵妍[63]研究狗牙根干旱的代谢产物,总共鉴定出44种代谢产物,包括15种有机酸、14种氨基酸、10种糖与糖醇、3种脂肪酸及2种含氮化合物。还发现显著上调的代谢物与抗旱密切相关,包括3种有机酸,3种氨基酸,5种糖与糖醇,2种不饱和脂肪酸及2种含氮化合物。但本研究中藜麦花期在受到干旱胁迫后,主要的代谢物质表达下调,可能是由于本试验采用的是质量分数为30%的PEG-6000进行重度干旱胁迫,而花期又是藜麦的水分敏感期。长时间的重度干旱胁迫可能使得藜麦叶片光合能力降低,导致电子传输链过度还原,从而导致光氧化。此外,植物虽然可以通过调节自身的抗氧化系统和代谢酶活性来应对氧化损伤,但其调节能力存在着一定限度。当氧自由基生成的速率远大于抗氧化系统的调节能力时,植物的氧自由基会过度积累,从而对膜系统产生不可逆的损伤,导致内部代谢调节紊乱,蛋白质大量降解,细胞裂解死亡。因此,干旱胁迫组中大量的氨基酸类表达下调。而水涝胁迫组中,藜麦虽受到了胁迫,引起了氧自由基的产生,但由于其胁迫的程度在植物可承受的范围内,可通过自身抗氧化系统的调节来应对氧化损伤,使得植物的ROS和MDA含量维持在一个动态平衡,且较CK组无明显差异,植物能进行正常的代谢活动。因此,水涝胁迫组中大量的氨基酸和有机酸类表达上调。
藜麦花期在受到干旱和水涝胁迫后,响应机制有一定的相似之处。叶片中的SP含量降低,但较CK组变化不显著,WSS含量、POD活性和T-AOC均显著增加。但由于花期为水分敏感期,重度干旱胁迫对植物细胞损伤极大,使得氧自由基的生成速率超出了植物抗氧化系统调节的范围,导致氧自由基的过度积累,对膜系统产生不可逆的损伤,导致内部代谢调节紊乱,蛋白质大量降解失活,细胞裂解死亡。使得植物中的代谢物质(尤其是大量的氨基酸类)表达下调,而水涝胁迫组中的MDA变化不显著。这是由于水涝胁迫,引起氧自由基的产生与抗氧化系统的调节,维持了动态平衡,保证了膜系统的完整性,从而可进行正常的生理代谢活动。通过代谢物质以及相关通路的分析,还发现藜麦在水涝胁迫下,主要通过氨基酸类富集的氨酰-tRNA生物合成途径,有机酸和糖类富集的二羧酸代谢途径、生物碱富集的吲哚生物碱合成途径来抵御胁迫,保持植物的正常生理活动。
综上所述,藜麦花期在干旱和水涝胁迫下的生理和代谢调节机制十分相似,但对重度干旱胁迫抗性较差,时间过长会严重损害植物细胞。因此,在生产实际中更应该注意花期的水分管理,避免长期干旱导致藜麦的产量和品质下降。
