中青年隐源性脑卒中患者非阻塞性颈动脉硬化和卵圆孔未闭发生情况分析
2020-12-29潘雪梅
徐 亮 周 畅 潘雪梅 孙 恒 周 军
(1.三峡大学 第一临床医学院[宜昌市中心人民医院] 超声科,湖北宜昌 443003; 2.宜昌市第三人民医院 超声科, 湖北 宜昌 443000)
缺血性脑卒中是临床常见病之一,也是导致患者死亡和致残的重要原因。引起缺血性脑卒中的原因很多,但仍有部分患者通过各种检查找不到原因,因而被归类为隐源性脑卒中[1]。卵圆孔未闭(patent foramen ovale,PFO)在健康成年人的发生率约25%,随着年龄的增长,患病率逐渐下降[1]。近年来,越来越多的证据表明PFO与隐源性脑卒中具有相关性,尤其是在中青年(≤55岁),因此PFO成为国内外关于隐源性脑卒中研究的焦点[2,3]。非阻塞性颈动脉粥样硬化(non-obstructive carotid atherosclerosis,NOCA)是指颈动脉斑块狭窄<50%,根据国际共识的类肝素药物治疗急性缺血性脑卒中试验(TOAST试验)分析,目前并不认为NOCA是卒中的明确病因[4]。然而,NOCA是否影响中青年隐源性脑卒中的发生发展尚不清楚,NOCA与PFO对中青年隐源性脑卒中患者的发生及相互联系尚有待研究[5]。本研究通过对隐源性脑卒中患者临床资料、颈动脉超声、经食道超声心动图(transesophageal echocardiography,TEE)及经胸超声心动图造影(contrast transthoracic echocardiography,cTTE)检查进行分析,探讨NOCA及PFO在中青年隐源性脑卒中患者中的发生情况以及两者间的关系,为中青年隐源性脑卒中的治疗和预防提供参考依据。
1 材料与方法
1.1 研究对象
回顾性分析2017年8月~2019年10月在我院住院治疗的116例18~55岁中青年隐源性脑卒中患者的临床资料。隐源性脑卒中的纳入标准使用国际TOAST分类标准[5]:①大动脉硬化性卒中(颅内外血管狭窄≥50%或闭塞所致);②心源性栓塞;③小动脉闭塞;④其它原因所致的缺血性卒中;⑤不明原因性脑卒中。TOAST的分类是通过分析卒中患者的临床资料,包括人口学特点、血液检查、吸烟、高血压及糖尿病等常规危险因素;通过MR或CT对颅内动脉、颈动脉和主动脉弓检查评估大动脉粥样硬化疾病是否是卒中的潜在来源以及排除小血管闭塞性疾病(<1.5 cm的脑梗死及腔隙性脑梗死);通过计算机断层血管造影(CTA)、磁共振血管造影(MRA)或颈动脉超声检查排除≥50%的大血管狭窄或大血管闭塞的患者;通过24 h动态心电图监测及超声心动图来排除阵发性房颤、瓣膜赘生物和心源性血栓;其它少见原因如动脉夹层、动脉炎及存在血液高凝状态的患者亦被排除在外。本研究纳入的所有患者均有完整的神经影像学检查、心电图、颈动脉超声及TEE和/或cTTE检查资料;卒中的诊断依据MRI或CT上明确的阳性表现。
排除标准:①不符合TOAST标准;②年龄>55岁或<18岁;③心房颤动及严重心律失常;④伴有除PFO外其它先天性心脏病患者。所有入选患者根据PFO存在与否分为PFO阳性组和PFO阴性组。
1.2 研究方法
1.2.1 颈动脉超声检查
入组患者均于入院1周内进行颈动脉超声检查,常规采用5.0~10.0 MHz的线阵探头。于横断切面上以毫米为单位进行数据测量。动脉硬化及斑块的界定:颈动脉内中膜厚度≥1.0 mm为内膜增厚,局限性≥1.5 mm定义为斑块[6]。此外,本研究为了评估NOCA严重程度与PFO的关系,根据颈动脉斑块的有无,将NOCA严重程度分为无NOCA、NOCA无斑块及NOCA合并斑块3个等级进行分析。
1.2.2 TEE检查
采用Philips IU22超声诊断仪进行,探头频率2.0~7.0 MHz。在局部麻醉下,通过经食道探头进入食管中段水平,旋转探头角度,在二维成像的基础上结合彩色多普勒血流显示观察PFO发生情况。PFO的TEE诊断表现为原发隔与继发隔未完全贴合,两者间形成的缝隙样结构[7]。
1.2.3 cTTE检查
采用Philips EPIQ 7C超声诊断仪,探头X5-1,频率1.0~5.0 MHZ。于肘静脉建立静脉通路,通过三通管与其相连,关闭三通阀门,取两支10 mL注射器,一支装有8 mL生理盐水,一支装有1 mL空气,回抽1 mL血液,将生理盐水、血液和空气充分混合存于注射器内备用,采用经胸超声检查取四腔心切面,将混合均匀的造影剂经肘静脉三通管推入,观察心腔内的微泡情况,若4个心动周期左心腔内可见微泡回声,则诊断为PFO[8]。图1为颈动脉超声测量、PFO的TEE及cTTE超声检测。
1.3 统计学方法

2 结果
2.1 缺血性脑卒中分型及分析
研究期间共筛查242例缺血性脑卒中患者。其中,隐源性脑卒中患者116例,占比最高(47.93%)。另外,血管源性脑卒中(包括大动脉硬化性和小血管闭塞性)的发生率高达38.43%,仅次于不明原因性脑卒中。依据TOAST分型最终纳入116例隐源性脑卒中患者,TOAST分型情况见表1。

表1 缺血性脑卒中患者TOAST分型[n(%)]
2.2 隐源性脑卒中患者PFO阳性组与PFO阴性组NOCA及临床特点的比较
纳入研究的116例隐源性脑卒中患者中有81例(69.83%)存在NOCA,其中NOCA合并斑块48例(41.38%),NOCA无斑块33例(28.45%)。其中,54例存在PFO(46.55%),62例无PFO(53.45%)。PFO阳性组中有31例(57.41%)存在NOCA,PFO阴性组中有50例(80.65%)存在NOCA,两组有统计学差异(P=0.007);其中PFO阳性组中NOCA伴斑块患者有14例(25.93%),PFO阴性组中NOCA伴斑块患者有34例(54.84%),两组有统计学差异(P=0.002);而PFO阳性组中NOCA无斑块患者有17例(31.48%),PFO阴性组中NOCA无斑块患者有16例(25.81%),两组无统计学差异(P=0.499)。PFO阳性组高血压发病率低于PFO阴性组(20.37% vs 43.55%,P=0.008);而年龄、性别、吸烟、糖尿病、高脂血症均无统计学差异(均P>0.05),见表2。
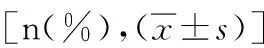
表2 PFO阳性组与PFO阴性组NOCA及临床特点的比较
2.3 NOCA与年龄以及PFO的关系
对各年龄层NOCA分析表明,随着年龄的增长NOCA发病率逐渐增加(P<0.001),见图2。无NOCA、NOCA无斑块及NOCA伴斑块三个组PFO的发生率分别为65.71%(23/35)、51.52%(17/33)、29.17%(14/48),PFO的发生率随NOCA严重程度呈负相关(P=0.001)。
3 讨论
中青年缺血性脑卒中是当今社会面临的一项重要健康问题,流行病学研究表明,近年来中青年人缺血性脑卒中发病率显著上升[9]。此外,在中青年患者中,25%~50%的卒中患者被归类为隐源性脑卒中[5]。因此,青年人缺血性脑卒中危险因素的发现对于卒中的预防和干预具有重要的临床意义。本研究通过对18~55岁缺血性脑卒中患者进行严格的筛查,纳入116例隐源性脑卒中患者,比例为47.93%,这与国外流行病学研究结果类似[10-12]。此外,本研究在筛查中发现血管源性脑卒中(包括大动脉硬化性和小血管闭塞性)的发生率高达38.43%,仅次于不明原因性脑卒中,这表明血管因素在中青年缺血性卒中患者中也起着重要作用。
在国际TOAST的分类标准中,大动脉硬化狭窄≥50%被归类为已知源性脑卒中,而大动脉硬化<50%目前未被纳入具有明确病因,这导致隐源性卒中患者中可能存在一定比例由血管因素引起的脑卒中[4]。目前国内外对于隐源性脑卒中的研究大多集中在PFO、隐匿性房颤等方面,而对NOCA的研究相对较少[13,14]。NOCA尽管不是隐源性脑卒中的直接原因,但可能是全身弥漫性动脉硬化的一个标志。本研究通过统计中青年隐源性脑卒中患者发生NOCA情况发现,NOCA在中青年隐源性脑卒中患者中并不少见,发生率高达69.83%,高于同类型的研究。在Jaffre等[5]及Buon等[15]研究中,NOCA发生率分别为25%和50%,不同研究NOCA发生率的差异可能与年龄结构不同有关。本研究结果表明,NOCA发生率随着年龄的增长有逐渐增加的趋势,提示NOCA在高龄患者中更常见,与动脉硬化相关的脑卒中可能是隐源性脑卒中的重要组成部分。此外,本研究显示NOCA合并斑块者在PFO阴性组中显著多于PFO阳性组。因此,除PFO外,NOCA合并斑块可能是导致中青年隐源性脑卒中的潜在原因。然而,目前TOAST分型标准认为NOCA并非隐源性脑卒中的主要原因,因此NOCA合并有颈动脉斑块是否可进一步加剧隐源性脑卒中的发生仍有待于进一步研究。
关于PFO引起隐源性脑卒中的潜在机制目前国际上普遍认为是反常性栓塞[16],然而NOCA引起卒中的机制目前尚不明确。尽管NOCA不是卒中发生的直接原因,但一项关于青年患者NOCA与卒中的相关研究表明,NOCA可能通过激活血栓形成而导致卒中的发生[17]。因此,NOCA的检测对于缺血性脑卒中的预防具有重要意义。既往研究表明,正常健康人群PFO的发生率约25%,而在隐源性脑卒中患者PFO的发生率约达40%,高于正常人群PFO的发生率[18,1]。此外,一项关于中青年PFO与隐源性脑卒中关系的Meta分析显示,PFO与55岁以下不明原因脑卒中有显著的相关性[19]。另有研究显示,年龄≤55岁的中青年隐源性脑卒中患者PFO发生率46.55%,高于正常健康人群[18],这表明PFO可能是年龄≤55岁中青年隐源性脑卒中的重要原因。本研究还发现,PFO阳性组的NOCA和高血压的发生率均低于PFO阴性组。由于高血压是动脉粥样硬化的主要影响因素,提示NOCA可能是PFO阴性患者发生隐源性脑卒的重要原因。此外,NOCA严重程度与PFO呈负相关,这提示随着年龄的增长,NOCA严重程度增加可能逐渐成为隐源性脑卒中发生的主要因素。因此,本研究认为NOCA与PFO可能共同构成隐源性脑卒中发生的重要组成部分。
本研究也存在一些局限性。首先,本研究中部分PFO患者的确诊方式不同。尽管有研究显示TEE和cTTE这两种检测方法对于PFO检测均具有较高的敏感性和特异性[20]。由于TEE紧贴左房,能够直观清晰地观察到PFO的形态结构,因此目前国际上把TEE作为PFO诊断的“金标准”。然而,TEE亦存在自身局限性,对于直径较小PFO的检测TEE可能存在漏诊。此外,由于TEE通过食道检查,患者无法进行Valsalva动作,部分卒中患者由于病情严重亦无法进行此类检查。而cTTE常规经胸检测,无明显禁忌症,对于PFO的右向左分流具有敏感性高、适用范围广等优势,因此对于无法采用TEE检查的患者可采用cTTE作为PFO检测的替代方法[20]。另外,本研究中患者的纳入采用国际广泛使用的TOAST分类标准,该分类标准其准确度亦可能存在差异。最后,本研究样本量有限,尚需大样本的前瞻性研究进一步深入探讨。
总之,PFO是隐源性脑卒中发生的重要原因,而在PFO阴性患者中,NOCA是隐源性脑卒中发生的潜在原因。NOCA发生率与年龄正相关,其严重程度与PFO呈负相关,NOCA和PFO可能是中青年隐源性脑卒中的重要组成部分。
