大黄酚对脑缺血损伤模型大鼠小胶质细胞活化及炎症因子表达的影响
2020-12-28张亚洲蔡友德胡斐然郭青李宇鸿何前松
张亚洲 蔡友德 胡斐然 郭青 李宇鸿 何前松


摘 要 目的:研究大黃酚对脑缺血损伤模型大鼠小胶质细胞活化及炎症因子表达的影响。方法:将SD大鼠随机分为假手术组、模型组和大黄酚高、中、低剂量组[7.88、3.94、1.97 mg/(kg·d)],每组20只(复制模型过程中如死亡或造模不成功则补足)。除假手术组外,其余各组大鼠均采用改良线栓法建立中动脉闭塞模型。于缺血2 h后,假手术组和模型组大鼠腹腔注射生理盐水1 mL,各给药组大鼠腹腔注射相应药液1 mL,每日1次,连续给药7 d。末次给药后,记录各组大鼠神经功能缺损评分,采用TTC染色法观察大鼠脑组织梗死情况并计算脑梗死面积百分比,采用免疫荧光染色法观察大鼠脑缺血半暗带区Iba-1阳性细胞的表达情况,采用Western blotting法检测大鼠脑缺血半暗带区Notch-1、肿瘤坏死因子α(TNF-α)、细胞间黏附分子1(ICAM-1)蛋白的表达情况。结果:假手术组大鼠脑组织未见梗死区域;其脑缺血半暗带区Iba-1阳性细胞较少且呈分枝状。与假手术组比较,模型组大鼠脑组织梗死区域明显;脑缺血半暗带区Iba-1阳性细胞明显增多,且呈阿米巴形或圆形;其神经功能缺损评分、脑梗死面积百分比以及脑缺血半暗带区Notch-1、TNF-α、ICAM-1蛋白的相对表达水平均显著升高(P<0.05)。与模型组比较,大黄酚各剂量组大鼠脑组织梗死区域均有不同程度缩小;脑缺血半暗带区Iba-1阳性表达细胞有所减少;其神经功能缺损评分、脑梗死面积百分比以及脑缺血半暗带区Notch-1、TNF-α、ICAM-1蛋白的相对表达水平均显著降低(P<0.05或P<0.01)。结论:大黄酚对脑缺血损伤模型大鼠具有一定的脑保护作用,可减轻其神经损伤;其机制可能与抑制Notch信号通路介导的小胶质细胞活化及炎症因子的表达有关。
关键词 脑缺血损伤;大黄酚;小胶质细胞;炎症因子;Notch信号通路;大鼠
ABSTRACT OBJECTIVE: To study the effects of chrysophanol on the activation of microglia and the expression of inflammatory factors in cerebral ischemia model rats. METHODS: SD rats were randomly divided into sham operation group, model group and chrysophanol high, medium, low dose groups [7.88, 3.94, 1.97 mg/(kg·d)], with 20 rats in each group (the number was complemented in cases of death or unsuccessful modeling during modeling process). Except for sham operation group, middle cerebral artery occlusion model was established in other groups by improved thread method. After 2 hours of ischemia, sham operation group and model group were intraperitoneally injected with 1 mL normal saline, and each administration group was intraperitoneally injected with 1 mL corresponding drug, once a day, for 7 consecutive days. After last medication, the score of neurological impairment was recorded; cerebral infarction of rats was observed by TTC staining, and the percentage of cerebral infarction area was calculated. The expression of Iba-1 positive cells in ischemic penumbra of rats was observed by immunofluorescence staining. The expression of Notch-1, TNF-α and ICAM-1 in the ischemic penumbra of rats were detected by Western blotting assay. RESULTS: In sham operation group, there was no infarction area in the brain tissue, and the Iba-1 positive cells in the ischemic penumbra were few and branched. Compared with sham operation group, the infarction area of cerebral tissue in rats was obvious in model group; the number of Iba-1 positive cells in ischemic penumbra were increased significantly, and they were in amoeba or round shape; the neurological impairment score, the percentage of cerebral infarction area, relative expression of Notch-1, TNF-α and ICAM-1 protein in ischemic penumbra were increased significantly (P<0.05). Compared with model rats, the infarction area of cerebral tissue in each dose group of chrysophanol was reduced to different extent; the number of Iba-1 positive cells in ischemic penumbra was decreased; neurological impairment score, the percentage of cerebral infarction area, relative expression of Notch-1, TNF-α and ICAM-1 protein were significantly decreased (P<0.05 or P<0.01). CONCLUSIONS: Chrysophanol has a certain protective effect on the brain tissue of cerebral ischemia model rats, and can relieve the nerve injury. Its mechanism may be associated with inhibiting the activation of microglia and expression of inflammatory factors mediated by Notch pathway.
KEYWORDS Cerebral ischemia; Chrysophanol; Microglia; Inflammation factor; Notch signaling pathway; Rats
脑卒中是世界范围内导致患者残疾和死亡的主要原因,其中缺血性卒中约占总卒中病例的60%~80%,具有发病率高、致残率高和病死率高等特点,给患者家庭和社会带来了沉重的负担[1]。卒中后的脑损伤是由一系列复杂的病理生理事件(如兴奋性氨基酸毒性损伤、钙调节障碍、氧化应激、炎症细胞浸润和细胞凋亡等)所导致的不可逆的神经细胞凋亡[2]。缺血后炎症反应已被认为是缺血性卒中关键的病理生理学因素,其中小胶质细胞作为中枢神经系统(CNS)炎症反应的主要效应器,在缺血性卒中后可通过形态和表型改变而迅速活化,活化后的小胶质细胞可介导促进脑损伤恢复的有益活动,例如吞噬细胞碎片和分泌抗炎物质、神经生长因子等[3]。但是在缺血性卒中的急性阶段,小胶质细胞活化被认为是继发性损伤的潜在原因,其可通过释放炎症因子[如细胞间黏附分子1(ICAM-1)、肿瘤坏死因子α(TNF-α)等]而导致脑组织损害[4]。最近的研究表明,Notch信号在小胶质细胞中呈高表达,其信号转导可在脑损伤后被激活;同时,Notch信号也参与了小胶质细胞活化后神经炎症介质的释放,与脑缺血后炎症反应的发生密切相关[5]。由此可见,抑制脑缺血后Notch信号转导以及活化小胶质细胞诱导的炎症因子表达有望成为防治缺血性卒中的有效策略。
大黄酚(Chrysophanol)是从大黄属植物中分离出来的重要的游离蒽醌化合物之一,具有抗炎、改善脂质代谢、抗抑郁、抗心肌缺血、保护脑组织等广泛的药理活性[6-7]。既往研究表明,大黄酚可拮抗脑缺血/再灌注损伤,抑制小胶质细胞介导的炎症因子[白细胞介素6(IL-6)、IL-1β]释放而减轻炎症损伤[8]。但大黄酚抑制小胶质细胞活化是否与Notch信号通路调控相关,尚未见相关报道。基于此,本研究拟使用改良线栓法制作脑缺血损伤大鼠模型,初步探讨大黄酚对模型大鼠脑缺血后Notch信号通路以及小胶质细胞活化、炎症因子表达的影响,为中药及其活性成分治疗缺血性卒中筛选新的靶点,并为将大黄酚开发为神经保护药物提供理论依据。
1 材料
1.1 仪器
DMIL LED型熒光显微镜(德国Leica公司);Mini Protean 3 Cell型电泳仪(美国Bio-Rad公司);Tanon-5200型全自动化学发光分析仪(上海天能科技有限公司);TB-718D型生物组织包埋机(泰维科技实业股份有限公司);DHG-9023A型恒温烘箱(上海恒一科学仪器有限公司);EOS 1300D/1500D型单反相机(日本Cannon公司)。
1.2 药品与试剂
大黄酚原料药[上海源叶生物科技有限公司,批号:T18S10F97987,纯度:≥98%;以N,N-二甲基甲酰胺-聚山梨酯80-生理盐水(体积比为1 ∶ 1 ∶ 8)混合溶液为溶剂,配制成0.1%、0.01%、0.001%大黄酚药液,备用];小鼠抗大鼠小胶质细胞/巨噬细胞特异性蛋白抗体Iba-1多克隆抗体(美国GeneTex公司,批号:GT10312);异硫氰酸荧光素(FITC)标记的驴抗小鼠IgG二抗(武汉三鹰生物技术有限公司,批号:SA00003-9);兔抗小鼠ICAM-1、TNF-α、Notch-1多克隆抗体和兔抗小鼠β-actin单克隆抗体(武汉贝茵莱生物科技有限公司,批号分别为PAB31662、PAB37416、PAB44149、WB9111-MAB43672);细胞核蛋白与细胞浆蛋白抽提试剂盒(上海碧云天生物技术有限公司,批号:P0028-1);封闭用山羊血清、BCA蛋白定量试剂盒、辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗、抗荧光衰减封片剂(北京索莱宝科技有限公司,批号分别为SL038、PC0020、P8020、S2110);PVDF膜(美国Millipore公司,批号:IPVH00010);2,3,5-氯化三苯基四氮唑(TTC)染色液(北京奥博特生物科技有限公司);氯化钠注射液(贵州科伦药业有限公司,批号:国药准字H20033974,规格:100 mL ∶ 900 mg;作生理盐水用);ECL化学发光底物(环亚生物科技有限公司);4′,6-联脒-2-苯基吲哚(DAPI)染料(美国Sigma公司,批号:24894305);其余试剂均为市售分析纯,水为蒸馏水。
1.3 动物
清洁级SD大鼠,雌雄各半,体质量(250±20) g,由长沙市天勤生物技术有限公司提供,动物生产许可证号:SCXK(湘)2014-0011。所有雌雄大鼠均自由摄食饮水,并分笼饲养于温度22~25 ℃、湿度40%~60%的环境中,适应性饲养1周后用于实验。
2 方法
2.1 分组、造模与给药
将大鼠随机分为假手术组、模型组以及大黄酚高、中、低剂量组[7.88、3.94、1.97 mg/(kg·d),分别根据人临床用量的21、14、7倍剂量换算而得,且前期研究证实高剂量无明显毒性],每组20只。参考文献[9]采用改良线栓法建立脑缺血损伤模型:所有大鼠术前禁食不禁水12 h,以10%水合氯醛溶液(0.3 mL/100 g)麻醉后,以仰卧位固定于手术台上,备皮,消毒颈部皮肤;于颈正中切开,钝性分离并暴露颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),用动脉夹夹闭CCA和ICA,在CCA上作一楔形切口,由此插入线栓(直径0.26 mm),松开动脉夹,将线栓缓慢向ICA入颅方向推进,轻推至大脑中动脉起点,遇阻力停止(进线约18~20 mm),即实现了大脑中动脉闭塞(MCAO);随后结扎CCA并逐层缝合颈部切口、消毒。假手术组大鼠同法分离CCA、ECA、ICA,除不插入线栓外,其余操作同上。在手术过程中和术后,所有大鼠均被置于恒温[(37.0±0.5) ℃]电热板上保温,待其麻醉清醒后放入饲养笼中,自由摄食饮水。密切观察大鼠生命体征,并根据Longa 5级标准评分法[4]评价其神经行为表现,并将评分为1~3分者(假手术组除外)纳入实验(复制模型过程中如死亡或造模不成功则补足,保证每组20只)。于脑缺血2 h后,假手术组和模型组大鼠分别腹腔注射生理盐水1 mL,各给药组大鼠腹腔注射相应药物1 mL,每日1次,连续给药7 d。
2.2 大鼠神经功能评分
于末次给药后,采用Longa 5级标准评分法对全部大鼠进行神经功能评估,评分标准[4]——0分:无任何神经功能缺损的表现,即正常;1分:垂直提起大鼠时,其未能充分伸展前肢;2分:大鼠行走时身体向一侧倾斜,转大圈;3分:大鼠行走时身体向一侧跌倒,转小圈;4分:大鼠没有运动或自发行走,意识水平低落。
2.3 大鼠脑组织梗死情况
采用TTC染色法检测。末次给药及神经功能评分后,各组随机选取6只大鼠麻醉后颈椎脱臼处死,用生理盐水进行心内灌注并断头取脑。于离额极2 mm处向后连续等距切取5个冠状切片(厚度约为20 μm),在37 ℃条件下置于2%TTC染色液中避光染色30 min,再在4 ℃条件下置于4%多聚甲醛溶液中固定2 h后,使用相机拍摄(正常脑组织显示为红色,而脑梗死灶显示为白色)。由Image Pro plus 6.0图像处理软件分析图像并计算脑梗死面积百分比:脑梗死面积百分比=(对侧半球面积-同侧半球非梗死面积)/对侧半球面积×100%。
2.4 大鼠脑缺血半暗带区Iba-1阳性细胞的表达情况
采用免疫荧光染色法检测。取“2.3”项下各组大鼠的脑组织切片,置于65 ℃恒温烘箱中烤片1 h,经二甲苯脱蜡、乙醇水化后,用0.01 mol/L柠檬酸钠缓冲溶液进行抗原修复,再用3%H2O2溶液在室温下孵育10 min以消除内源性过氧化物酶。将切片置于10%山羊血清中封闭30 min后,用磷酸盐缓冲液(PBS,pH 7.4)清洗,滴加Iba-1抗体(稀释度为1 ∶ 1 000),4 ℃下孵育过夜;用PBS清洗5 min×3次,滴加FITC标记的IgG二抗(稀释度为1 ∶ 100),避光室温孵育1 h;用PBS清洗5 min×3次,用DAPI染料复染细胞核,以抗荧光衰减封片剂避光封片。使用荧光显微镜观察并拍照,模型组和各药物组随机选取缺血半暗带区5个视野,假手术组选取与上述区域对应的5个视野,观察Iba-1阳性细胞(镜下呈绿色荧光)的表达情况。
2.5 大鼠脑缺血半暗带区Notch-1、TNF-α、ICAM-1蛋白的表达情况
采用Western blotting法檢测。末次给药及神经功能评分结束后,各组另随机选取8只大鼠麻醉后颈椎脱臼处死,模型组和各药物组选取缺血半暗带区脑组织适量,假手术组大鼠选择与上述区域对应的脑组织适量,按照细胞核蛋白与细胞浆蛋白抽提试剂盒说明书方法提取总蛋白,上述蛋白经BCA蛋白定量试剂盒测定浓度后,于100 ℃下变性10 min。取变性后的蛋白样品20 μg,进行12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(分离胶:120 V,50 min;5%浓缩胶:80 V,40 min),并于电泳后转移至PVDF膜上,在4 ℃下用5%脱脂奶粉封闭过夜;加入Notch-1、TNF-α、ICAM-1抗体和内参β-actin抗体(稀释度均为1 ∶ 1 000),于4 ℃下孵育过夜;用PBST溶液洗涤3次后,加入HRP标记的IgG二抗(稀释度为1 ∶ 10 000),室温下孵育1 h;用PBST溶液洗涤3次后,以ECL法显色,使用全自动化学发光分析仪成像。使用Image J V1.8.0.112软件分析各条带的灰度值,以目的条带与内参条带的灰度值之比表示Notch-1、TNF-α、ICAM-1蛋白的相对表达水平。
2.6 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用方差分析,组间两两比较用t检验。P<0.05为差异具有统计学意义。
3 结果
3.1 大黄酚对脑缺血模型大鼠神经功能缺损评分和脑梗死面积百分比的影响
假手术组大鼠脑组织未见梗死区域;模型组大鼠脑组织梗死区域明显,其神经功能评分和脑梗死面积百分比均较假手术组显著升高(P<0.05);大黄酚各剂量组大鼠脑组织梗死区域均有所缩小,其神经功能损伤评分和脑梗死面积百分比均较模型组显著降低(P<0.01),详见表1、图1(每组随机展示了3只大鼠的TTC染色观察结果)。
3.2 大黄酚对脑缺血模型大鼠半暗带区Iba-1表达的影响
假手术组大鼠脑缺血半暗带区Iba-1阳性细胞较少,且呈分枝状;模型组大鼠脑缺血半暗带区Iba-1阳性细胞较假手术组明显增多,且呈阿米巴形或圆形;大黄酚各剂量组大鼠脑缺血半暗带区Iba-1阳性细胞均较模型组有所减少,详见图2。
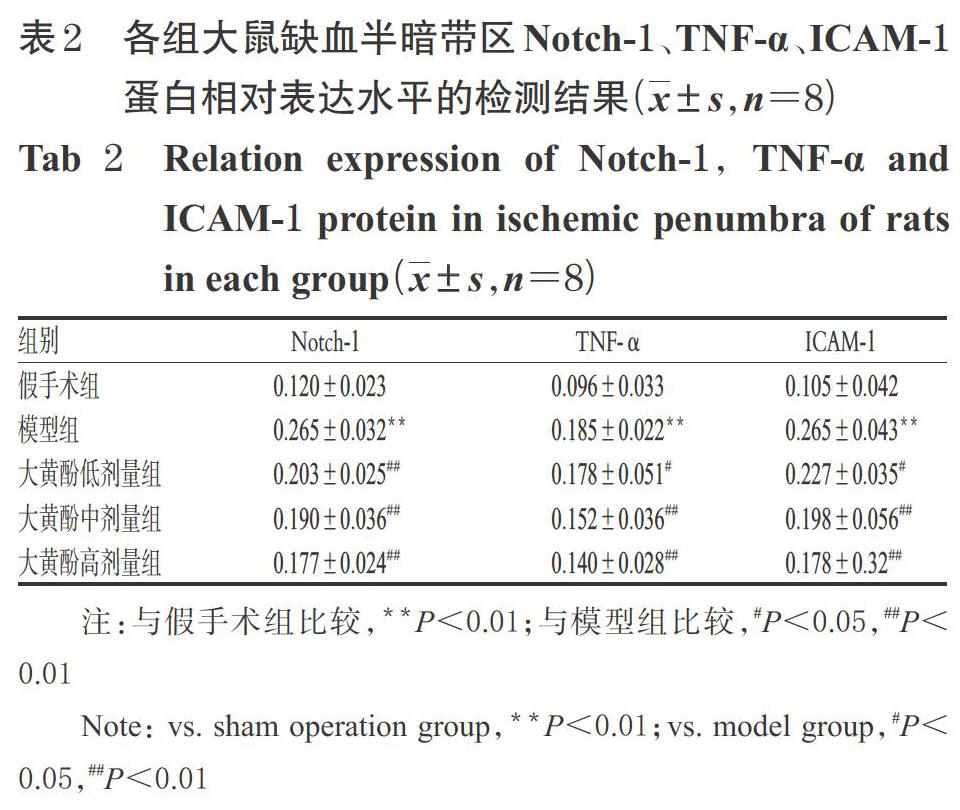
3.3 大黄酚对脑缺血模型大鼠缺血半暗带区Notch-1、TNF-α、ICAM-1蛋白表达的影响
与假手术组比较,模型组大鼠脑缺血半暗带区Notch-1、TNF-α、ICAM-1蛋白的相对表达水平均显著升高(P<0.01);与模型组比较,大黄酚各剂量组大鼠上述蛋白的相对表达水平均显著降低(P<0.05或P<0.01),详见图3、表2。
4 讨论
小胶质细胞被认为是CNS内的常驻免疫细胞,也是第一个对缺血性卒中致病理生理改变作出反应的细胞,参与了缺血时半暗带区内的神经炎症反应[10]。正常情况下,小胶质细胞呈高度分枝状,具有三级和四级分枝结构,且细胞间的分枝很少发生重叠。当脑内发生炎症、创伤或其他神经系统疾病时,小胶质细胞迅速被激活,活化的小胶质细胞胞体增大、突起变短、细胞形态呈圆形或杆状;同时,活化的小胶质细胞进一步被激活和调整,细胞突起消失,细胞形态呈阿米巴状,并具有吞噬功能。小胶质细胞的形态学改变反映了其活化状态,而该细胞的活化状态与脑内受损部位的严重程度密切相关[11]。当脑缺血发生时,缺血半暗带中的小胶质细胞被激活,其胞体增生肥大,形态由分枝状向阿米巴形或圆形转变,激活的小胶质细胞可释放促炎细胞因子、趋化因子,并分泌神经递质至细胞外环境中,进一步加重脑组织损害[12]。本研究结果显示,假手术组大鼠脑组织中的小胶质细胞呈分枝状且处于静息状态;而当脑缺血损伤发生后,模型组大鼠脑缺血半暗带区中的小胶质细胞呈阿米巴形或圆形,提示脑缺血损伤激活了小胶质细胞。
免疫反应是参与急性脑缺血病理生理學过程并影响卒中患者预后的主要因素[13]。虽然免疫反应仅在灌注不足的血管以及局部缺血性脑实质中发生,但其引发的炎症反应可在整个生物体内传播;同时,上述炎症反应可导致继发性神经元损伤,对急性缺血性损伤和脑功能恢复产生实质性影响[14]。小胶质细胞是大脑中的常驻免疫细胞,在正常情况下会不断监测大脑的微环境;一旦发生缺血,小胶质细胞就会被激活,从而产生有害的和神经保护的炎症因子,而这两种因子的平衡决定了受损神经元的功能状态[3]。在脑缺血早期,小胶质细胞激活可促进IL-2、TNF-α、ICAM-1等炎症因子的表达,后者可诱导炎症级联反应,从而导致脑组织损伤[15]。Notch信号通路是一种膜受体信号通路,是神经元、小胶质细胞和星形胶质细胞以及CNS正常发育的主要参与者,在调节免疫细胞(如T细胞和巨噬细胞)的活化中具有重要作用[16]。在CNS中,Notch信号被认为是细胞“命运”信号,Notch受体与其配体结合可激活Notch靶向基因的转录[17]。有证据表明,Notch信号在小胶质细胞中表达,对小胶质细胞的成熟和活化具有促进作用,并可促进卒中后炎症反应的发生[18]。最近研究报道指出,在脑缺血损伤的病理生理过程中,Notch信号通路被诱导激活,活化的Notch信号通路参与了小胶质细胞神经炎症介质的释放,从而加重脑组织损伤,最终导致神经功能缺损转归不良[19]。本研究发现,缺血7 d后,模型组大鼠脑组织梗死区域明显,其神经功能评分、脑梗死面积百分比以及脑缺血半暗带区Notch-1、TNF-α、ICAM-1蛋白的相对表达水平均较假手术组显著升高,表明脑缺血后大鼠脑组织受到损伤,Notch信号被激活,TNF-α、ICAM-1等神经炎症介质的释放明显增加,提示小胶质细胞中的Notch信号通路参与了脑缺血炎性损伤过程。经大黄酚干预后,各药物组大鼠脑梗死区域有所缩小,其Iba阳性细胞明显减少,其神经功能评分、脑梗死面积百分比以及脑缺血半暗带区Notch-1、TNF-α、ICAM-1蛋白的相对表达水平均显著降低,表明该药物可改善大鼠神经功能损伤、缩小脑梗死区域面积,并明显抑制小胶质细胞的激活,同时可下调Notch信号通路,减少ICAM-1、TNF-a等神经炎症介质的表达,提示Notch信号通路可能是大黄酚抗脑缺血损伤的作用靶点。
综上所述,大黄酚对脑缺血损伤模型大鼠具有一定的保护作用,可改善其神经功能缺失、缩小脑梗死区域面积;这种作用可能与抑制Notch信号通路介导的小胶质细胞活化及其炎症因子的表达有关。本研究初步确定了大黄酚预防脑缺血炎性损伤的可能机制,可为该药物的进一步开发和利用提供理论依据。
参考文献
[ 1 ] FAVATE AS,YOUNGER DS. Epidemiology of ischemic stroke[J]. Neurol Clin,2016,34(4):967-980.
[ 2 ] 梁辰,初海平,王福文.脑缺血再灌注损伤药物治疗的研究进展[J].中国药房,2016,27(4):538-541.
[ 3 ] QIN C,ZHOU LQ,MA XT,et al. Dual functions of microglia in ischemic stroke[J]. Neurosci Bull,2019,35(5):921-933.
[ 4 ] KRONENBERG G,UHLEMANN R,RICHTER N,et al. Distinguishing features of microglia and monocyte-derived macrophages after stroke[J]. Acta Neuropathol,2018,135(4):551-568.
[ 5 ] BALAGANAPATHY P,BAIK SH,MALLILANKARAMAN K,et al. Interplay between Notch and p53 promotes neuronal cell death in ischemic stroke[J]. J Cereb Blood Flow Metab,2018,38(10):1781-1795.
[ 6 ] 魏江存,陈勇,谢臻,等.中药大黄炮制品的化学成分及药效研究进展[J].中国药房,2017,28(25):3569-3574.
[ 7 ] LI RR,LIU XF,FENG SX,et al. Pharmacodynamics of five anthraquinones (aloe-emodin,emodin,rhein,chysophanol,and physcion) and reciprocal pharmacokinetic interaction in rats with cerebral ischemia[J]. Molecules,2019. DOI:10.3390/molecules24101898.
[ 8 ] YUAN Y,FANG M,WU CY,et al. Scutellarin as a potential therapeutic agent for microglia-mediated neuroinflammation in cerebral ischemia[J]. Neuromolecular Med,2016,18(3):264-273.
[ 9 ] HERMANN DM,POPA-WAGNER A,KLEINSCHNITZ C,et al. Animal models of ischemic stroke and their impact on drug discovery[J]. Expert Opin Drug Discov,2019,14(3):315-326.
[10] YANG C,HAWKINS KE,DORE S,et al. Neuroinflammatory mechanisms of blood-brain barrier damage in is- chemic stroke[J]. Am J Physiol Cell Physiol,2019,316(2):C135-C153.
[11] YOUNG K,MORRISON H. Quantifying microglia morphology from photomicrographs of immunohistochemistry prepared tissue using ImageJ[J]. J Vis Exp,2018. DOI:10.3791/57648.
[12] KAUR C,RATHNASAMY G,LING EA. Biology of microglia in the developing brain[J]. J Neuropathol Exp Neurol,2017,76(9):736-753.
[13] ANRATHER J,IADECOLA C. Inflammation and stroke:an overview[J]. Neurotherapeutics,2016,13(4):661- 670.
[14] SINGH V,ROTH S,LLOVERA G,et al. Microbiota dysbiosis controls the neuroinflammatory response after stroke[J]. J Neurosci,2016,36(28):7428-7440.
[15] KAWABORI M,YENARI MA. Inflammatory responses in brain ischemia[J]. Curr Med Chem,2015,22(10):1258-1277.
[16] ZHANG YM,CHEN SX,DAI QF,et al. Effect of acupuncture on the Notch signaling pathway in rats with brain injury[J]. Chin J Integr Med,2018,24(7):537-544.
[17] CAI Z,ZHAO B,DENG Y,et al. Notch signaling in cerebrovascular diseases:review[J]. Mol Med Rep,2016,14(4):2883-2898.
[18] WANG JJ,ZHU JD,ZHANG XH,et al. Neuroprotective effect of Notch pathway inhibitor DAPT against focal cerebral ischemia/reperfusion 3 hours before model establishment[J]. Neural Regen Res,2019,14(3):452-461.
[19] 姚書琦,易玮,刘荣,等.近5年电针预处理及电针治疗脑缺血大鼠的机制研究进展[J].针刺研究,2019,44(5):383-387.
(收稿日期:2020-06-10 修回日期:2020-10-22)
(编辑:张元媛)
