ERK5抑制剂促进肺成纤维细胞自噬及其在小鼠肺纤维化中的作用研究
2020-12-28华晓敏王昌明
华晓敏 王昌明
桂林医学院附属桂林市人民医院呼吸内科541002
通信作者:王昌明,Email:13607731185@163.com
肺纤维化是一种以持续上皮细胞损伤和过量细胞外基质 (extracellular matrix,ECM)沉积为主要病理特征的慢性纤维增生性疾病[1]。肺纤维化主要是肺组织受损后修复调节失控、重建异常所引起的病变,在这一过程中,一系列细胞因子和生长因子的表达异常、炎症反应、血管增生和重建、纤维蛋白溶解障碍及外界环境等因素导致的氧化应激都参与肺纤维化的发病过程,由此造成上皮细胞缺损、成纤维细胞增生和ECM 沉积等主要病变,最终结果是成纤维细胞替代了行使正常功能的肺泡上皮细胞,导致了纤维化的发生[2]。成纤维细胞转化为肌成纤维细胞分泌胶原、促进ECM 的沉积,在肺纤维化形成过程中起着重要作用[3]。转化生长因子β1(transforming growth factor-β1,TGF-β1)是重要的促纤维化因子,TGF-β1可以促使上皮间质转化和成纤维细胞向肌成纤维细胞的分化,进而导致ECM 的沉积[4]。细胞外信号调节蛋白激酶5(extracellular signal-regulated protein kinase-5,ERK5)是一种促分裂原活化蛋白激酶,与细胞存活、抗凋亡信号传导、细胞增殖与分化有关[5]。本研究通过建造肺纤维化细胞模型和动物模型,探讨ERK5在肺纤维化中的作用及其可能的致病机制。
1 材料与方法
1.1 实验细胞 人肺成纤维细胞 (human lung fibroblasts,HLFs)购自中国科学院昆明细胞库(编号:KCB200695)。细胞培养在含10%胎牛血清及青链霉素的DMEM 高糖培养基中,培养箱条件为5%CO2、37 ℃。
1.2 细胞实验主要试剂 重组人TGF-β1(2μg粉剂)购于美国Pepro Tech 公司。ERK5 抑制剂BIX02189 (5 mg粉剂)购于美国Selleck 生物科技有限公司。DMEM 高糖培养基、胎牛血清(Gibco FBS-10099-141)、1%双抗 (青霉素及链霉素)、0.25%含EDTA 胰酶 (Trypsin)购于美国Gibco 公 司。ERK5、α-平 滑 肌 肌 动 蛋 白(α-smooth muscle actin,α-SMA)、p62、LC3Ⅱ、Beclin-1一抗购于英国Abcam 公司,辣根过氧化物酶标记过的二抗购于中杉金桥生物技术有限公司。
1.3 细胞实验方法
1.3.1 TGF-β1诱导HLFs表型转化 用浓度为10μg/L的TGF-β1 作用24 h 诱导肺纤维化细胞模型。
1.3.2 蛋白质印迹法 (Western blot) 采用Western blot分析从TGF-β1 处理组与对照组中提取的表型转化标志性蛋白Fibronectin和α-SMA 的表达。收集细胞后加入RIPA 裂解液,在冰上裂解30 min后离心提取蛋白质,用BCA 试剂盒进行蛋白定量,经过SDS-PAGE 电泳、压片后进行条带灰度值量化分析。
1.3.3 细胞免疫荧光 采用细胞免疫荧光检测TGF-β1处 理 组 和 对 照 组 细 胞 中Fibronectin 和α-SMA的表达量。HLFs 在24 孔板中培养,经TGF-β1处理24 h后固定细胞30 min,通透15 min,封闭1 h,孵育一抗和荧光二抗,经过核染色后用抗荧光衰减封片剂封片,在荧光显微镜下观察。
1.3.4 q RT-PCR 检测BIX02189 的最佳作用浓度 BIX02189按 照 浓 度 梯 度0、1、2、5、10、15μmol/L作用于HLFs,培养后利用Trizol 提取细胞RNA,纯化后酶标仪定量,进行RNA 逆转录和ERK5引物PCR扩增,进行ERK5的定量分析。
1.3.5 自噬相关因子LC3Ⅱ、p62、Beclin-1 和α-SMA的表达 实验分为DMSO 组、BIX02189组、DMSO+TGF-β1 组、BIX02189+TGF-β1 组、BIX02189+TGF-β1+3-MA 组 和3-MA 对 照 组。Western blot分析各组细胞中自噬相关因子LC3Ⅱ、p62、Beclin-1和表型转化标志因子α-SMA的表达。1.4 实验动物 C57BL/6小鼠24只,雄性,6~8周龄,体质量18~22 g,购于湖南斯克莱景达实验动物有限公司,实验动物使用许可证编号:SCXK 桂2013-0001。
1.5 动物实验主要试剂 注射用盐酸博来霉素(1.5万U/支)购于翰辉制药有限公司,用3 ml注射用生理盐水稀释为浓度5 g/L。ERK5 抑制剂BIX02189 (5 mg粉剂)购于美国Selleck 生物科技有限公司,按照2% DMSO+30% PEG300+5% Tween 80+dd H2O 的比例配置溶剂,用1.135 ml溶剂稀释粉剂为10 mmol/L溶液。ERK5、α-SMA、LC3Ⅱ一抗购于英国Abcam 公司,辣根过氧化物酶标记过的二抗购于中杉金桥生物技术有限公司。
1.6 动物实验方法
1.6.1 实验分组 实验分为生理盐水对照组(NS组)、博来霉素模型组(BLM 组)、BIX02189治疗组(BT组)和BIX02189对照组(BC组),每组6只。1.6.2 建造肺纤维化动物模型 参照文献 [6-7],BT 组于造模当日一次性气管内滴注50μl博来霉素3.5 mg/kg,造模前2 h 腹腔注射10 mg/kg BIX02189 100μl,自第3 日起隔日注射等量BIX02189;BC组气管内滴注50μl生理盐水,腹腔注射10 mg/kg BIX02189 100μl;BLM 组气管内滴注3.5 mg/kg博来霉素50μl,腹腔注射生理盐水;NS组气管内、腹腔内均注射生理盐水。
1.6.3 观察小鼠一般状态及肺组织改变 观察各组小鼠体型变化、进食量的差别、活跃程度差别及有无呼吸急促等情况。将小鼠麻醉后,称量小鼠体质量并记录。开胸后观察小鼠肺部大小、颜色及质地变化。取出全肺,用去离子水清洗后吸干水分,称量全肺的重量并记录,计算小鼠肺系数。肺系数=肺湿重(mg)/体质量(g)×100%。
1.6.4 肺组织病理学检测 饲养28 d后,用7%水合氯醛(0.2 ml/100 g)腹腔注射麻醉后,将小鼠固定于手术台上,从下腹部开始剪开皮肤,逐层暴露,腹主动脉放血,逐渐向上剪开直至暴露气管,先用手术线结扎右主支气管,然后切断气管,钝性分离肺组织与其他软组织。从气管内缓慢注入4%多聚甲醛使左肺充盈,用夹子夹闭左主支气管,将左右肺分离。左肺组织放入已盛有4%多聚甲醛的标本瓶中,固定24 h后送去病理科做切片进行Masson染色和HE 染色。右肺组织用锡纸包好后放入-80 ℃冰箱储存,用于后续实验。
1.6.5 Western blot检测小鼠肺组织中ERK5、α-SMA、LC3Ⅱ的表达 从-80 ℃冰箱取出组织放入研钵里,倒入适量液氮,用研磨锤不断研磨,直至组织成粉末状,将组织放入2 ml离心管中,加入1 ml组织裂解液 (PMSF∶RAPI=1∶100),在冰上超声裂解后提取蛋白质,定量后进行SDSPAGE电泳,同前述Western blot步骤,最终进行条带灰度值量化分析。
1.7 统计学分析 所有数据至少重复3次。采用SPSS 20.0软件进行统计学分析。计量资料以x-±s表示,两组比较采用独立样本T 检验,多组资料比较时采用单因素方差分析,各组资料先进行正态性检验和方差齐性检验,符合正态分布、方差齐者两两比较采用S-N-K 法分析,方差不齐者采用Dunnett t 3检验。P <0.05为差异有统计学意义。
2 结果
2.1 TGF-β1诱导HLFs表型转化 Western blot结果显示:与对照组相比,TGF-β1 处理组Fibronectin和α-SMA 的蛋白表达量明显增加 (图1、2);细胞免疫荧光检测到经TGF-β1 处理后胞质中Fibronectin 和α-SMA 蛋白表达量增加 (图3、4)。
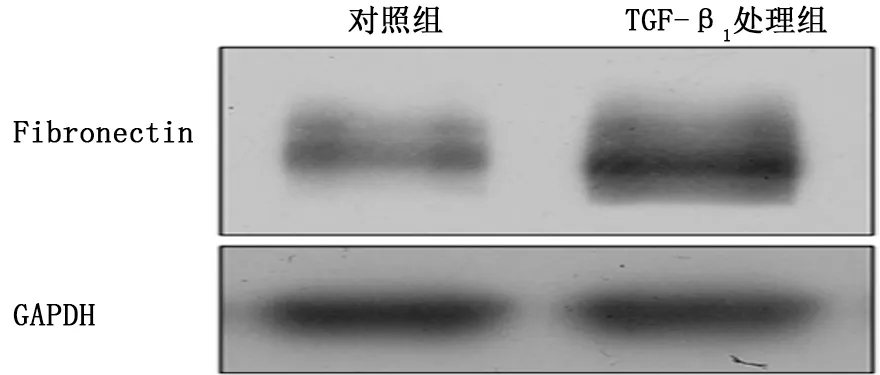
图1 蛋白质印迹检测对照组和TGF-β1 处理组人肺成纤维细胞中Fibronectin的表达
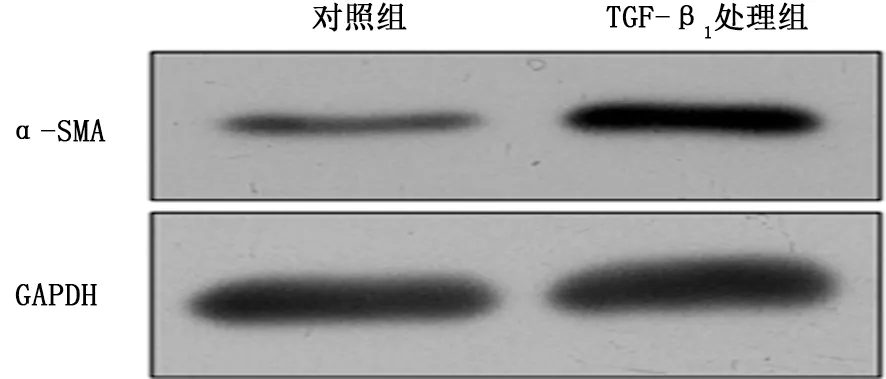
图2 蛋白质印迹检测对照组和TGF-β1 处理组人肺成纤维细 胞 中α-SMA 的 表 达
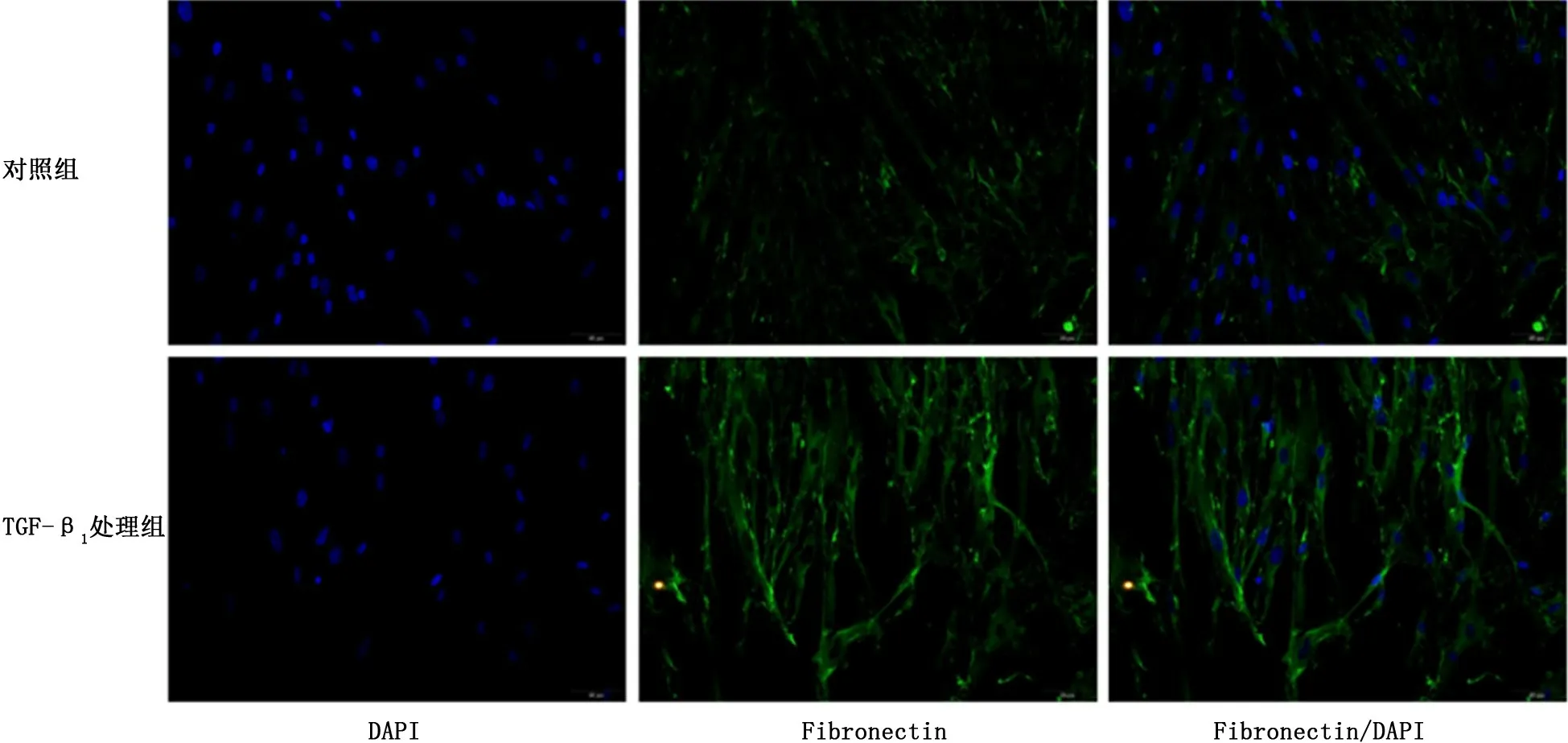
图3 细胞免疫荧光检测对照组和TGF-β1 处理组人肺成纤维细胞中Fibronectin的表达
2.2 ERK5抑制剂通过促进细胞自噬抑制α-SMA的表达 qRT-PCR 在m RNA 水平检测ERK5 抑制剂最佳作用浓度为15 μmol/L (图5)。BIX02189+TGF-β1组 较DMSO+TGF-β1组p62蛋白表达量降低,LC3Ⅱ、Beclin-1蛋白表达量增加,表明细胞自噬增强;α-SMA 蛋白表达量减弱,表明细胞表型转化受到抑制。而应用自噬抑制剂后的BIX02189+TGF-β1+3-MA 组 较BIX02189+TGF-β1组α-SMA 的表达量增加,表明自噬受到抑制后促进了细胞表型转化(图6)。
2.3 小鼠一般状态及肺组织改变 NS组和BC组小鼠生长状态良好,精神状态良好,呼吸平稳,食欲佳,有活力。BLM 组和BT 组小鼠一般状态不好,体型较另外两组小,精神状态差,呼吸急促,进食减少,缺乏活力。但BT 组较BLM 组小鼠状态稍好。麻醉后解剖小鼠,可见NS组和BC 组小鼠肺组织颜色红润,质地柔软,表面光滑饱满。BLM 组和BT 组小鼠肺组织颜色苍白,质地较硬,表面凹凸不平。BLM 组肺系数明显高于NS 组(P <0.01),BT 组肺系数较BLM 组降低 (P <0.01),BC 组与NS 组肺系数差异无统计学意义(图7)。

图5 qRT-PCR 检测BIX02189最佳作用浓度
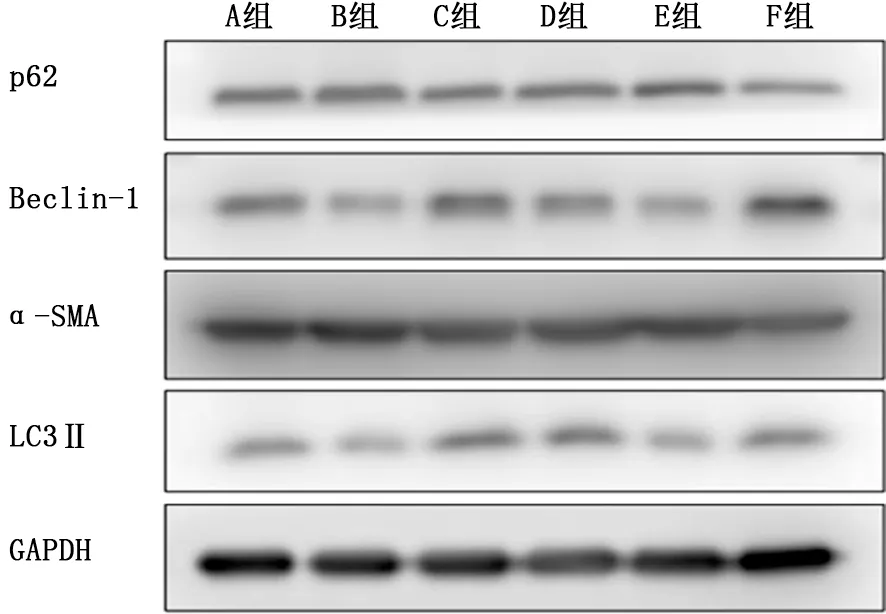
图6 蛋白质印迹检测各组p62、LC3Ⅱ、Beclin-1、α-SMA表达

图7 各组小鼠肺系数的比较
2.4 各组小鼠肺组织病理学表现 HE 染色显示NS组无明显炎症及纤维化特征;BC组与NS组无明显差别,可见少量的炎性细胞浸润,可能是实验过程中操作手法引起的肺组织局部炎症反应;BLM 组肺泡壁明显增宽,可见大量胶原纤维增生,肺实变明显,并伴有炎性细胞浸润;BT 组上述病理情况较BLM 组减轻,可见灶状的纤维化区域,炎性细胞浸润较少 (图8)。Masson染色显示NS组、BC 组小鼠肺泡结构基本完整,可能是注入4%多聚甲醛固定时不够轻柔导致肺泡壁破裂,肺泡间隔未见增厚,仅有少量蓝色胶原纤维沉积;BLM 组小鼠可见大量蓝色胶原纤维沉积,颜色较深,弥漫性纤维组织形成;BT 组较BLM 组肺泡间隔变窄,蓝色的胶原纤维沉积量减少,纤维化程度减轻(图9)。2.5 各组小鼠肺组织中ERK5和α-SMA、LC3Ⅱ的表达 NS组小鼠ERK5蛋白有表达,BC 组小鼠ERK5蛋白较NS 组降低,BLM 组小鼠ERK5蛋白表达量较NS组升高,BT 组小鼠ERK5蛋白表达量较BLM 组降低(图10)。BLM 组小鼠肺组织中α-SMA 的蛋白表达量明显高于NS组,BT 组和BC 组小鼠肺组织中α-SMA 的蛋白表达量较BLM 组明显降低;BLM 组小鼠肺组织中LC3Ⅱ的蛋白表达量明显低于NS 组,BT 组和BC 组较BLM 组LC3Ⅱ的蛋白表达量升高(图11)。
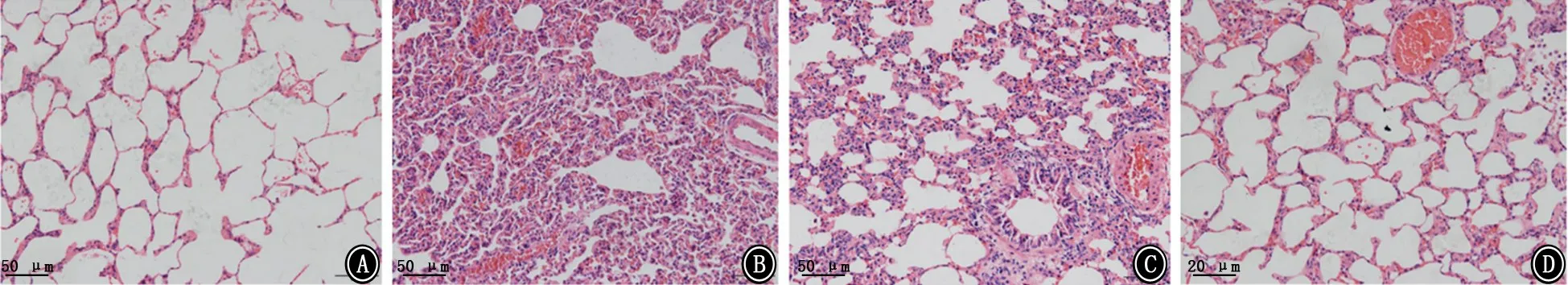
图8 各组小鼠肺组织病理学表现 HE ×200 A:生理盐水对照组;B:博来霉素模型组;C:BIX02189 治疗组;D:BIX02189对照组

图9 各组小鼠肺组织病理学表现 Masson ×200 A:生理盐水对照组;B:博来霉素模型组;C:BIX02189 治疗组;D:BIX02189对照组
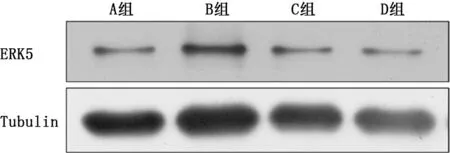
图10 蛋白质印迹检测各组小鼠肺组织中ERK5表达

图11 蛋白质印迹检测各组小鼠肺组织中α-SMA 和LC3Ⅱ表达
3 讨论
成纤维细胞向肌成纤维细胞的表型转化是肺纤维化发生的重要环节,Fibronectin和α-SMA 的高表达常被认为是肌成纤维细胞的特有标志,所以检测Fibronectin和α-SMA 的表达量可有效反映成纤维细胞向肌成纤维细胞的分化,即成纤维细胞的表型转化情况[8]。根据课题组的前期研究成果,TGF-β1可成功诱导体外肺纤维化细胞模型,因此本研究直接选取TGF-β1的最佳作用浓度和时间处理HLFs,通过Western blot和细胞免疫荧光检测到Fibronectin和α-SMA 的表达量增加,证明成功诱导HLFs的表型转化。
Beclin-1在自噬的启动阶段发挥了重要作用,介导自噬起始[9];LC3Ⅱ参与自噬溶酶体膜的延伸和自噬溶酶体的形成[10];p62 在自噬形成的过程中不断被消耗[11]。所以,本研究通过检测这3 个蛋白在细胞中的表达量来反映自噬情况。在HLFs中,抑制ERK5 的表达,Western blot 检测到LC3Ⅱ与Beclin-1的表达水平增加,p62表达水平降低,可以在一定程度上说明ERK5 抑制剂可促进自噬,而ERK5 是起到抑制自噬的作用;抑制ERK5的表达,Western blot检测到成纤维细胞表型转化的标志性蛋白α-SMA 表达水平下降,说明ERK5参与了TGF-β1诱导的细胞表型转化。在此基础上,对ERK5 抑制剂组应用自噬抑制剂后,LC3Ⅱ与Beclin-1的表达水平降低,p62和α-SMA表达水平升高,说明自噬受到抑制,并且促进了成纤维细胞的分化,所以笔者考虑,ERK 抑制剂可以抑制成纤维细胞的表型转化,并且此作用很有可能是通过促进细胞自噬而实现的。但是自噬的调控是一个复杂的动态过程,仅通过几个表型因子的检测远远不能够解释其调控的机制,若要得出ERK5通过调控自噬来影响成纤维细胞表型转化的结论,需要更深入、具体的研究,这也是本课题组未来的研究方向。
在肺成纤维细胞构建的肺纤维化细胞模型中探究了表型转化的标志因子及自噬相关蛋白的表达与ERK5的关系后,开始进一步在动物体内验证ERK5的调控是否与在人的细胞模型中一致,所以利用经典的博来霉素诱导小鼠肺纤维化的造模方法构建纤维化模型,通过腹腔注射ERK5 抑制剂的方法干预治疗,观察小鼠的一般状态及肺组织改变,进而检测检测小鼠肺组织中α-SMA 和LC3Ⅱ的表达变化,来说明ERK5 抑制剂对肺纤维化程度的改变和对自噬的影响。气管内滴注博来霉素是肺纤维化小鼠造模的经典方法,本课题组的前期研究成果表明,在博来霉素所致的大鼠肺纤维化模型中,α-SMA、波形蛋白和Ⅰ型胶原的表达增加,促进ECM 的沉积[12]。通过对各组小鼠肺组织病理切片的分析及α-SMA 蛋白表达水平的检测可知,治疗组与模型组相比,炎症程度和纤维化程度较轻,α-SMA 蛋白表达水平下降,LC3Ⅱ表达水平升高,这与在细胞模型中检测到的变化一致。所以,ERK5抑制剂可在一定程度上改善小鼠肺纤维化,并且ERK5抑制剂对自噬有一定的促进作用。但是若要明确ERK5抑制剂通过促进自噬改善肺纤维化及其分子机制,还需要进一步的研究及更深入的实验。
利益冲突所有作者均声明不存在利益冲突
