联合肌肉减少症建立模型预测结直肠癌术后腹腔内感染风险
2020-12-28叶国庆许京轩曾云鹏朱策王祥孙婧杨欣欣沈贤
叶国庆,许京轩,曾云鹏,朱策,王祥,孙婧,杨欣欣,沈贤
(1.平阳县中医院 外科,浙江 温州 325000;2.温州医科大学附属第二医院 胃肠外科,浙江 温州 325027)
结直肠癌是在全球发病率中排行第三的恶性肿瘤,每年在全球中约超过693 900例患者死于结直肠恶性肿瘤[1]。结直肠癌发病率位于中国恶性肿瘤的第四位,且逐年上升,严重危害公众生命健康[2]。结直肠癌根治术目前仍然是可能治愈结直肠恶性肿瘤的主要治疗方法[3]。然而,这种类型的手术具有较多的术后并发症,并且有发生严重手术部位感染的高风险。腹腔内感染是术后感染的重要组成部分,给患者带来额外的经济负担,并增加术后住院时间[4]。因此,明确腹腔内感染的发病原因和危险因素具有重要意义。
由于患者消化不良和吸收不足,营养不良在癌症患者中非常普遍[5]。在胃癌中,约有36%~43%的患者存在不同形式的营养不良风险[6],这与腹部手术患者术后并发症发生率较高相关[7]。肌肉减少症是与营养不良相关的综合征,其特征是骨骼肌质量逐渐丧失,肌肉力量和身体机能逐渐低下[8]。研究表明,肌肉减少症与各种消化道癌症的不良术后预后相关[9]。然而,肌肉减少症是否与结直肠癌术后不良反应发生率相关,目前尚有争议。此外,目前关于肌肉减少症与结直肠癌术后并发症的研究大多数都是回顾性研究,并选择骨骼肌作为诊断肌肉减少症的唯一参数,而忽略了肌肉减少症与肌肉力量和身体机能有关的成分,因此本研究旨在确定腹腔内感染与肌肉减少症之间的关系并基于独立相关因素构建联合预测模型以预测腹腔内感染的风险。
1 资料和方法
1.1 一般资料 2014年7月至2017年12月在温州医科大学附属第二医院和平阳县中医院普通外科的386例接受根治性结直肠癌切除术患者。排除了3例术前腹腔内感染严重的患者。所有手术均由经验丰富的医师进行。结直肠癌的治疗方案基于《结直肠癌治疗指南》。该研究得到温州医科大学附属第二医院伦理委员会的批准,所有参与者在参加研究前均签署了知情同意书。
1.2 数据采集 收集患者临床病理特征,包括年龄、性别、BMI、美国麻醉师协会(ASA)分级、营养风险筛查2002(nutritional risk screening,NRS2002)标准指标、合并症、既往腹部手术病史、血红蛋白浓度、白蛋白浓度;手术特点,包括手术时间、切除和重建类型、腹腔镜手术和麻醉方式以及术后住院时间和住院费用。
1.3 腹腔内感染的诊断 ①术后有发烧、腹痛、腹胀或腹膜炎的体征,并伴有血白细胞或中性粒细胞升高;②细菌学腹膜引流液或穿刺液培养呈阳性;③腹部超声、CT或再次手术证实存在腹腔内感染,如脓性渗出液和局部脓肿。
1.4 术前测量骨骼肌的质量 通过测量L3处横截面的所有骨骼肌面积来计算患者的腹部和骨骼肌质量,包括腰大肌、竖脊椎、四边形、腹横肌、内外斜肌和腹直肌等所有骨骼肌的面积之和,以用于后续研究[10]。骨骼肌在CT上的Hounsfield单位为-29~150,以区别于其他组织[10]。为了最大程度减少偏差,骨骼肌测量人员均不参与实验且接受过专业训练而能熟练使用专门的处理系统(版本3.0.11.3,BN17 32位;INFINITT Healthcare Co.,Ltd.,韩国)。
1.5 肌肉力量和身体机能测量 根据肌肉减少症的定义,测量术前握力和平时6 m步行的速度,以确定患者的肌肉力量和身体机能。为了测试术前的握力,患者用优势手牵拉电子握力器(EH101;广州凯美瑞),重复3次,取平均值。步行实验是通过计算在6 m距离内从第一次脚步到最后一次脚步之间的时间间距来测量6 m的步态速度[11],在手术前7 d内测量了以上2个参数,并记录3次重复测试的均值。
1.6 肌肉减少症的诊断 根据欧洲肌肉减少症工作组(EWGSOP)[12]和亚洲肌肉减少症工作组(AWGS)[8]的定义,低骨骼肌质量加肌肉力量或身体机能低下的患者被定义为患有肌肉减少症,并考虑到种族差异,肌肉减少症的诊断标准:①低肌肉质量(男性L3骨骼肌指数(skeletal muscle index,SMI)≤40.8 cm2/m2,女性L3 SMI≤34.9 cm2/m2);②低肌力(手抓握力:男性<26 kg,女性<18 kg);③肌肉性能低下(平均6 m步态速度<0.8 m/s)。
1.7 统计学处理方法 采用SPSS22.0软件进行数据分析。计量资料进行K-S检验,符合正态分布的数据以±s表示,非正态分布数据以M(P25,P75)表示,采用t检验和Mann-WhitneyU检验进行比较;分类资料进行χ2检验和Fisher精确检验。基于单变量分析结果的进行多元逻辑回归分析,计算自变量的OR(95%CI);创建了由独立风险因素组成的联合预测模型,以计算腹腔内感染的预测概率。P<0.05为差异有统计学意义。
2 结果
2.1 患者特征 共有383名结直肠癌患者符合标准并入选本研究。患者的一般特征见表1。非腹腔内感染组和腹腔内感染组年龄、PLR值、肿瘤大小比较差异有统计学意义(P<0.05)。根据诊断标准,在所有患者中有93例(24.2%)被诊断为肌肉减少症,44例(11.4%,34例男性和10例女性)被诊断为腹腔内感染。
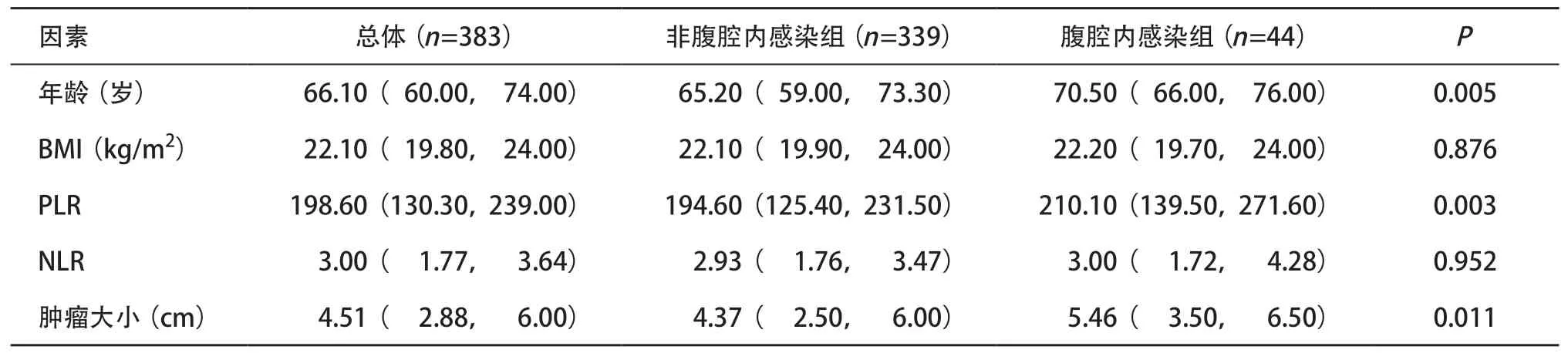
表1 纳入患者一般情况分析
2.2 单因素和多因素分析 在单因素分析中,年龄、PLR、肿瘤大小、肌肉减少症、NRS评分、是否使用腔镜与腹腔内感染的发生相关(P<0.05),见表2。腹腔内感染与术前合并症、糖尿病、高血压、低白蛋白血症、手术史之间无显著关联(P>0.05)。经多因素logistic回归分析,肿瘤直径≥3.4cm[OR(95%CI)=2.011(0.950~4.258),P=0.006]、年龄≥65岁[OR(95%CI)=2.038(0.912~4.556),P=0.007)和肌肉减少症[OR(95%CI)=2.105(1.059~4.185),P=0.034)是腹腔内感染的独立危险因素。
2.3 腹腔内感染评分系统的构建 根据多因素logistic回归分析,得到结直肠癌术后发生腹腔内感染的3个独立预测指标。计算出每个独立危险因子的OR值,予对数转换并乘以100,得到每个危险因子对应的风险得分,并将其分配给每个因子,因此,风险评分系统是基于每个风险变量的赋分值,进一步做3个独立危险因素及联合模型与腹腔内感染ROC曲线来确定评分系统对腹腔内感染的预测准确性是否较高。年龄(0.636)、肿瘤大小(0.599)、肌肉减少症(0.608),我们的计分系统具有较高的AUC值(0.702),能够更加灵敏、准确地预测结直肠癌术后发生腹腔内感染的风险。见图1。
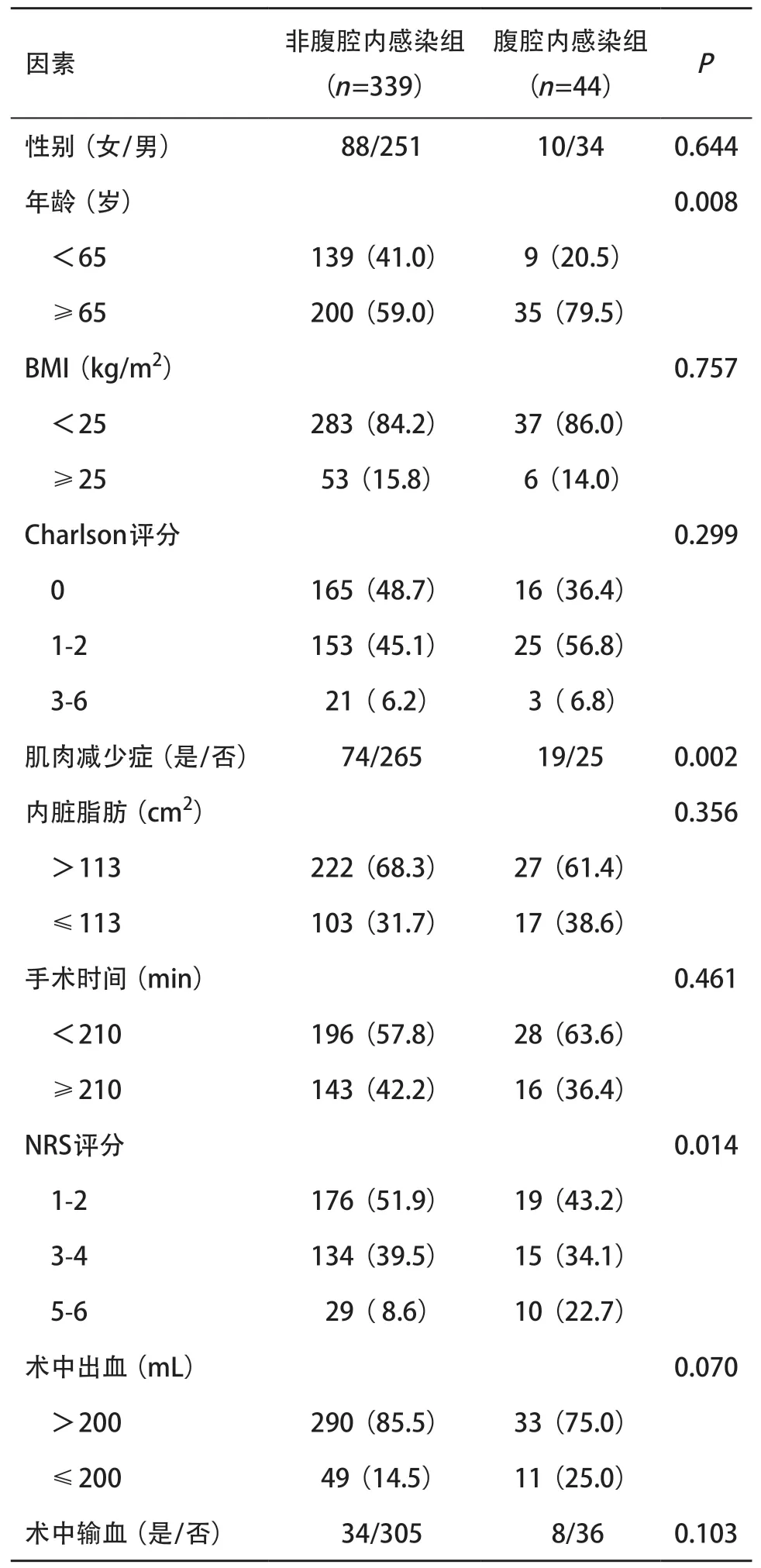
表2 腹腔内感染发生相关因素的单因素分析[例(%)]
3 讨论
腹腔内感染是根治性结直肠癌术后常见的严重并发症[18]。据报道,腹腔内感染在胃肠道手术后发生率为13.6%,腹腔内感染,特别是胰腺相关感染和吻合瘘管,可能会延长患者的住院时间并导致死 亡[13]。在腹部肿瘤手术中,相关的腹腔内感染是癌症患者总体生存和无进展生存的独立危险因素[14],因此,为减少住院时间并延长生存时间,及早预测和治疗腹腔内感染的发生至关重要。

续表2

图1 联合预测模型与3个独立危险因素预测腹腔内感染发生的ROC曲线
由于肌肉减少症在评估营养状况中起着重要作用,其对术后临床结局的不利影响在研究和临床界引起越来越多的关注[9],2014年,EWGSOP将肌肉减少症定义为骨骼肌损失加骨骼肌力量低下[13]。AWGS将肌肉减少症描述为老年综合征,并在2014年建议使用亚洲临界值来定义肌肉减少症[8]。由于本研究中所有患者均为中国人,因此该亚洲临界值涉及握力和步行速度。此外,腹部CT扫描用于评估术前骨骼肌质量,因为它比AWGS推荐的双X线吸收法更准确。但由于通过CT图像分析得出的L3骨骼肌密度的所有临界值均基于西方人群的数据,因此本研究中使用的不同性别的L3骨骼肌密度的临界值是基于我们先前对一项超过900名中国胃癌患者的大样本回顾性研究[15]。基于上述定义,本研究中,计66例男性和27例女性患者被诊断为肌肉减少症。
与以前的仅使用骨骼肌密度评估肌肉减少症的研究不同,该研究使用肌肉质量(L3 SMI)和肌肉功能(握力和6 m步行速度)对肌肉减少症进行了严格的评估,与报道的肌肉减少症患者在胃切除术后更有可能发生术后并发症的研究[21]相似,我们确定肌肉减少症是结直肠癌术后发生腹腔内感染的独立预测因子。在此前报道中,肌肉减少症与较低的BMI和较高的NRS评分以及术前血红蛋白显著相关,这两者都是营养状况的指标。据报道称,骨骼肌质量是评估人体营养状况的新指标[16],因此肌肉减少症可被视为营养不良的更好指标。营养不良,尤其是蛋白质缺乏,可能导致淋巴器官萎缩,从而影响几种免疫功能,例如淋巴细胞增殖、抗体反应和迟发型超敏反应[17]。此外,微量营养素缺乏是普遍现象,在营养不良的患者中,可能会影响先天和适应性免疫力,并导致促炎细胞因子增加,从而导致炎症状态[18-19]。另外,肌肉减少症患者被发现具有更广泛的浸润和更高的淋巴转移阶段,这可能导致更大的手术切除和更长的手术时间[20]。此前有报道称,手术时间长是结直肠癌术后患者腹腔内感染的危险因素[21],这一结果可能是手术部位长时间暴露和牵开器受压的结果。此外,由于局部血液循环不良,局部缺氧和失血增加,易导致患者缺乏抵抗感染的正常能力而更容易发生腹腔内感染[22]。
在单因素分析中,NRS2002评分是另一个与腹腔内感染显著相关的因素,但在进一步的多变量分析中并不是独立的危险因素,这与我们之前的研究相似,即NRS2002评分不再是术后并发症的重要预测指标[9]。在本研究中,我们发现肌肉减少症患者的NRS2002评分较高,这表明肌肉减少症对腹腔内感染的影响超过了NRS2002得分。换句话说,这表明肌肉减少症是预测腹腔内感染更好的营养评估指标。在本研究中,肿瘤大小是腹腔内感染的独立危险因素。这个因素以多种方式导致感染:广泛的手术范围,有限的手术可视性,更长的手术时间以及更多的术中出血[23]。据报道,由于温度调节和麻醉管理,增加手术时间和扩大手术范围可能会增加SSI率[24]。
本研究基于多因素分析的结果,构建了一个简单而实用的联合预测模型,集中考虑了肌肉减少症、肿瘤大小和年龄。考虑到可以量化和评估腹腔内感染发生风险的工具的便利性和直观性,联合预测模型可以帮助外科医师区分辨别一致性指数为0.702的低风险和高风险患者,患者入院后即可轻松获得模型中所需的所有参数,且很容易获得患者的总风险评分并初步评估腹腔内感染的发生率。基于此模型可以确定高风险患者的亚组,为了减少腹腔内感染的发生,可以采取各种措施。首先,对肌肉减少症者应提供管理良好的强化营养支持,以改善营养状况,从而促进术后恢复;其次,对那些接受大范围胃切除术和较长手术时间的患者,建议在干预期间根据半衰期定期重新注射预防性抗生素。
本研究是确定肌肉减少症与腹腔内感染之间关系的一项前瞻性研究,且创建了可直接用于临床环境中以视觉方式量化腹腔内感染风险的联合预测模型。本研究的局限:由于在CT扫描诊断肌肉减少症方面对L3骨骼肌密度尚无亚洲共识,本研究中的肌肉减少症诊断是基于之前的回顾性研究,可能存在偏差;本研究是单中心试验,人群中的偏倚可能是不可避免的,将来需要进行大规模的多中心研究,以验证该调查的结论。
