细粒棘球蚴感染小鼠M-MDSC对Treg和Th17细胞增殖的调控①
2020-12-26徐小丹王二强孟娟娟桂显伟吴向未陈雪玲
徐小丹 王二强 刘 坪 孟娟娟 桂显伟 武 杰 侯 隽 王 仙 吴向未 陈雪玲
(石河子大学医学院免疫学教研室,石河子 832002)
包虫病或称棘球蚴病(hydatid disease)是由细粒棘球蚴绦虫的幼虫寄生于中间宿主引起的一种严重影响人畜健康的寄生虫疾病,主要分布于牧区,以细粒棘球蚴引起的囊性包虫病为多见[1]。棘球蚴感染早期无明显症状,但随着包囊体积增大,在感染后期会引起组织、脏器的物理性损伤,进而影响组织器官正常功能的发挥[2]。虫体之所以能在宿主体内长期生存,主要依赖于对宿主的免疫逃逸[3]。
髓源性抑制细胞(myeloid derived suppressor cells,MDSCs)是髓系来源的异质细胞群,在肿瘤、炎症、寄生虫感染等病理情况下可急剧增加,具有强大的免疫抑制功能,主要通过高表达精氨酸酶1(Arginase 1,Arg1)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抑制T细胞增殖[4-6]。小鼠体内的MDSC主要分为2个亚群,分别是单核细胞型MDSCs(monocytic-MDSCs,M-MDSC)和粒细胞型MDSCs(polymorphonuclear-MDSCs,PMN-MDSC),在细粒棘球蚴感染小鼠模型中已发现M-MDSC表达,并且高表达精氨酸酶[7,8]。Th17和Treg是有别于Th1和Th2的效应T细胞亚群。研究发现,在包虫感染早期Th17表达升高,在包虫感染中后期患者外周血中发现Th17/Treg表达失衡,出现以Treg表达升高为主的免疫抑制状态,进一步促使包虫的免疫逃逸[9-11]。同时有研究表明,在小鼠包虫感染晚期脾脏M-MDSC与Th17呈负相关,但M-MDSC对Th17、Treg的作用尚未见报道[12]。故本文在建立细粒棘球蚴肝脏感染C57BL/6小鼠模型的基础上,利用磁珠分选和流式细胞术初步探索感染后1个月和3个月小鼠脾脏中M-MDSC对Th17和Treg的作用,为进一步研究细粒棘球蚴感染的免疫机制提供新思路。
1 材料与方法
1.1材料
1.1.1实验动物及细粒棘球蚴原头蚴的来源 原头蚴采集于新疆维吾尔自治区昌吉州屠宰场病羊肝脏。雌性6~8周C57BL/6小鼠(A2017-068-01)购自新疆医科大学第一附属医院实验动物中心。
1.1.2主要试剂和仪器 流式抗体Anti-mouseCD11b-PE、Anti-mouse GR-1-FITC、Anti-mouseLy-6G-FITC、Anti-mouseLy-6C-APC、Anti-mouseIL-17A-perc-psy5.5、Anti-mouseFoxP3-PE、anti-mouseCD4-PE、CD4-PECy、Fixation/Permeabiliz-ation Buffer和CFSE染液购自eBioscience公司;流式细胞仪(FACS AriaⅢ)购自BD 公司;Anti-mouse CD3、Anti-mouse CD28购自Biolegend公司;小鼠淋巴细胞分离液购自Solarbio 公司;RPMI1640培养基、胎牛血清(FBS)均购自BI。Myeloid-Derived Suppressor Cell Isolation Kit购自MiltenyiBiotec公司;Arg1抑制剂nor-NOHA和 iNOS抑制剂 L-NMMA 购自Sigma-Aldrich公司。
1.2方法
1.2.1细粒棘球蚴原头蚴的采集及悬液的制备 从感染细粒棘球蚴病的羊肝上无菌抽取无钙化、无感染、完整的单囊型细粒棘球蚴包囊内容物置于无菌离心管,原头节(protoscole,PSC)自然沉淀,再用含有100 U/ml 青霉素和链霉素双抗的无菌PBS(pH7.3)漂洗3次,除去育囊碎片使其自然沉淀,经0.5%伊红染色5 min,显微镜下鉴定具有活性的虫体数(>90%),用含双抗的无菌PBS稀释制成含有PSC 1 000个/ml的PSC悬液备用。
1.2.2细粒棘球蚴小鼠感染模型的建立及取材 将12只健康C57BL/6小鼠随机分为感染组和对照组,6只/组。感染组小鼠每只于肝脏被膜下注射原头节5 000个,对照组注射等体积PBS。于感染后的第30、90天颈椎脱臼处死小鼠,沿腹中线剪开腹腔暴露肝脏,观察细粒棘球蚴接种后肝脏的感染情况。使用无菌器械摘取小鼠肝脏立即投入预冷的10%中性甲醛溶液中固定7 d,中间换液一次,脱水包埋后备检。
1.2.3标本的制作及组织病理学检查 将已固定的肝脏组织修剪成0.5 cm×0.5 cm 大小,流水冲洗,75%乙醇浸泡过夜,梯度脱水后浸蜡,采用徕卡石蜡包埋机进行组织包埋。包埋后的组织蜡块置于石蜡切片机进行连续切片,切片厚度为4 μm。肝脏的HE染色:将肝组织切片置于烤箱中烤40 min,然后脱蜡至水;将切片置于苏木素染液中染色2 min,流水洗去多余染液;将切片置于盐酸乙醇分化液中1 s,自来水终止反应;将切片置于PBS缓冲液中返蓝 1 min,伊红染色1 min,流水多次冲洗;切片浸入梯度乙醇脱水,每步各5 s;通风橱内风干,封片,显微镜下观察并采图。肝脏组织天狼猩红染色:切片脱蜡后天狼猩红染色1 h,流水冲洗后苏木素染核5 min,流水冲洗,切片浸入梯度乙醇脱水,每步各5 s;通风橱内风干,封片,显微镜下观察并采图。
1.2.4脾脏单细胞悬液的制备 颈椎脱臼法处死感染30 d、90 d小鼠和naïve小鼠,无菌摘取小鼠脾脏,剪刀剪碎后用玻璃注射器轻轻碾磨脾脏,使分散的细胞通过300目滤网,置于15 ml离心管,350 g离心5 min,弃上清,加入1 ml红细胞裂解液,混匀,室温静置3 min。加入10 ml PBS终止裂解,350 g 离心5 min ,弃上清,加入少量PBS,制备单细胞悬液。
1.2.5免疫磁珠分离 M-MDSC 取上述制备的感染30 d、90 d小鼠的脾脏单细胞悬液,按照分离试剂盒说明书进行分离。主要步骤为:anti-GR-1-Biotin 抗体4℃孵育10 min,anti-Biotin Microbeads 4℃孵育15 min,过MACS柱后,以2 ml PBS洗脱,收集M-MDSC备用。
1.2.6naïve小鼠脾脏淋巴细胞分离 取上述制备的naïve 小鼠的脾脏单细胞悬液,在离心管中加入3 ml Ficoll分离液后沿试管壁缓慢加入2 ml脾细胞悬液,500 g 离心30 min。缓慢吸取血浆与分离液间的白膜层即淋巴细胞层至离心管内,加入10 ml PBS 250 g 离心10 min 洗涤细胞2次后备用。
1.2.7体外MDSC与淋巴细胞共培养实验 将上述获得的naïve 小鼠的淋巴细胞稀释至1×107个/ml,每毫升细胞悬液加入1 μl CFSE 贮存液,终浓度为5 μmol/L,37℃孵育10 min,每5 min 混匀1次,用等体积灭活的胎牛血清冰上中止5 min,PBS洗涤2次后用完全培养基重悬细胞。计数1×105个/孔,以1∶1比例加入分选纯化的M-MDSC进行共培养,共培养体系中加入1 μg/ml的Anti-CD3抗体,0.5 μg/ml 的Anti-CD28抗体和2 ng/ml的IL-2,为分析MDSC诱导Th17和Treg的增殖机制,在共培养体系中加入Arg1抑制剂(nor-NOHA)和iNOS抑制剂(L-NMMA)使终浓度为500 μmol/L,共培养4 d后收集细胞,流式检测Th17、Treg表达。
1.3统计学分析 数据用SPSS20.0软件进行统计学分析,采用两样本均数的t参数检验,以P<0.05为差异有统计学意义。
2 结果
2.1细粒棘球蚴感染小鼠肝脏模型的建立 细粒棘球蚴感染30 d小鼠的肝脏出现乳白色包囊,稍有凸起,感染90 d包囊变大,数目增多(图1)。
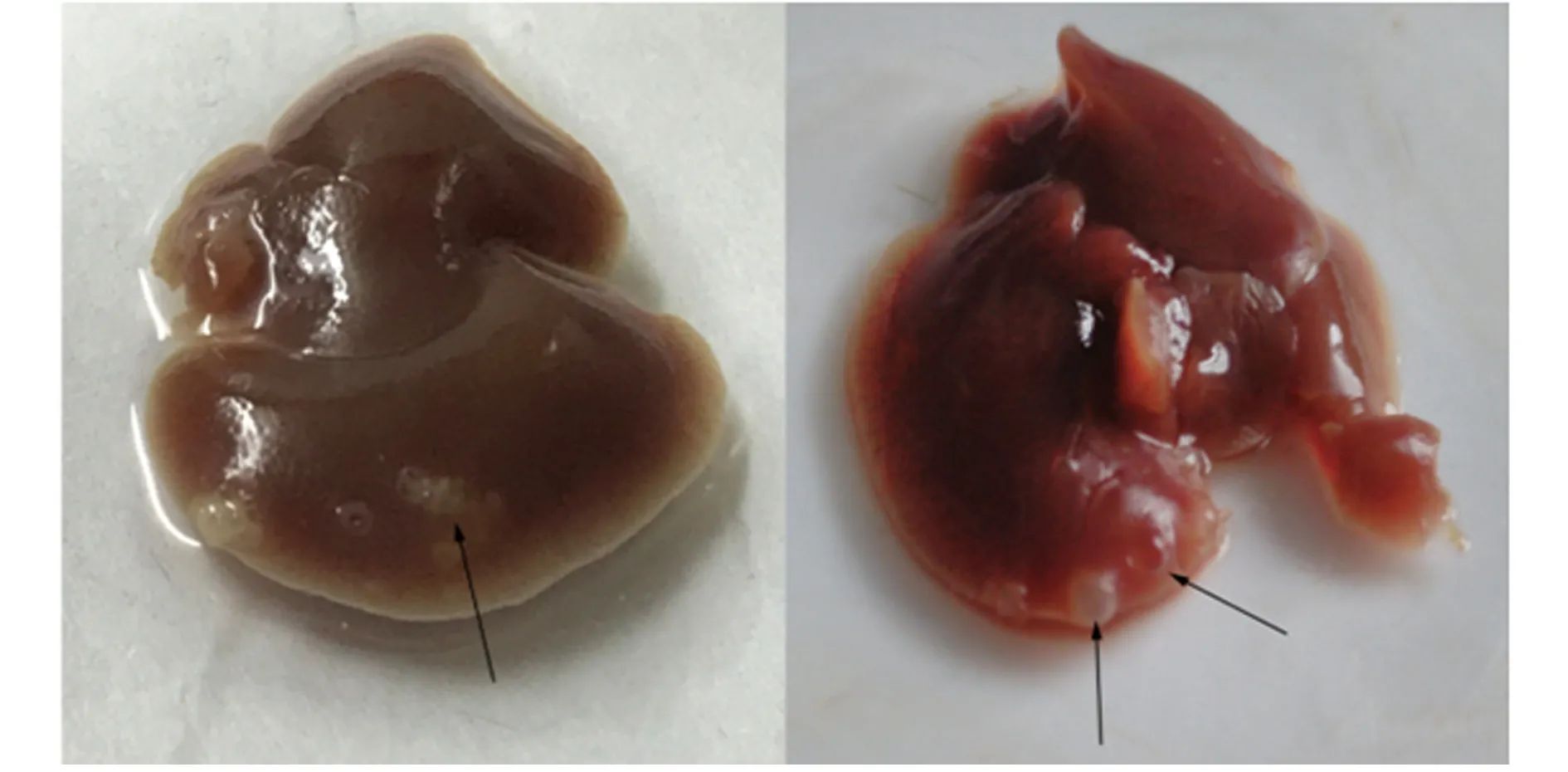
图1 细粒棘球蚴感染小鼠肝脏中产生的包囊Fig.1 Cysts in liver of mice infected with Echinoco-ccus granulous
2.2细粒棘球蚴感染小鼠肝脏组织病理变化 HE结果显示对照组小鼠肝组织结构正常,肝小叶结构完整清晰,肝细胞排列整齐,未见炎症细胞浸润。实验组小鼠感染30 d后可见肝细胞水肿,病灶处可见大量细粒棘球蚴堆积,此时并未形成完整的角质层和生发层,病灶周围有大量淋巴细胞和嗜酸性粒细胞浸润。感染90 d可见肝细胞明显水肿,病灶处形成了完整的生发层和角质层,病灶周围有大量淋巴细胞和嗜酸性粒细胞浸润,同时有多核巨、异物巨细胞以及上皮样细胞存在。天狼猩红染色结果显示对照组小鼠仅肝血窦处有部分胶原沉积,实验组感染小鼠30 d病灶周围可见疏松的纤维组织形成,随着感染时间延长,在感染90 d时可在病灶处见致密纤维包囊形成(图2)。
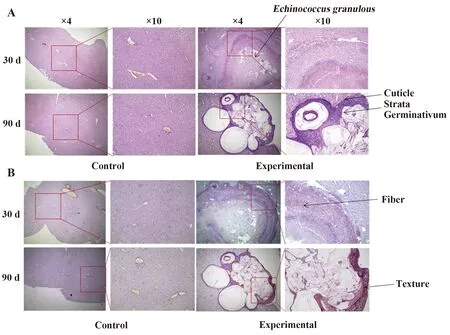
图2 细粒棘球蚴感染小鼠肝脏HE 和天狼猩红染色Fig.2 HE staining and sirius red staining of liver tissue in mice infected with Echinococcus granulousNote:A.HE staining;B.Sirius red staining.
2.3细粒棘球蚴感染小鼠脾脏中MDSCs表达升高 流式细胞术检测感染小鼠脾脏中CD11b+Gr1+细胞的表达水平。结果显示,小鼠感染30、90 d后MDSCs表达水平与对照组相比差异有统计学意义(P<0.01,图3)。
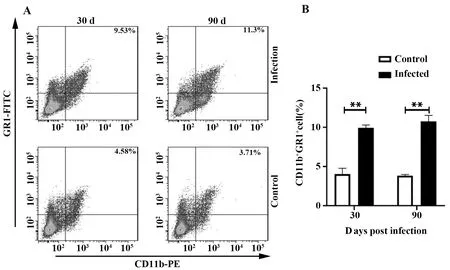
图3 细粒棘球蚴感染小鼠不同时间小鼠脾脏MDSCs比例Fig.3 Percentage of MDSCs in spleen of mice with Echinococcus granulous at different timeNote:A.Expression level of CD11b+Gr-1+ cells detected by FACS at 30 d,90 d after Echinococcus granulous infection;B.Statistical analysis of percentages of MDSCs.**.P<0.01.
2.4细粒棘球蚴感染小鼠30 d脾脏中的M-MDSC促进Th17增殖但对Treg作用不明显 结果显示感染30 d小鼠脾脏中的M-MDSC与naïve组相比促进小鼠淋巴细胞Th17增殖(P<0.05),但Treg的增殖与naïve 组相比无明显差异(图4)。

图4 感染后30 d M-MDSC促进Th17细胞增殖Fig.4 M-MDSC promoted proliferation of Th17 at 30 d after infectionNote:A.Proliferation level of CFSEloCD4+IL-17A+ cells and CFSEloCD4+Foxp3+ cells from lymphocytes that co-cultured with M-MDSCs;B.Statistical analysis of percentages of CFSEloCD4+IL-17A+ from lymphocytes that co-cultured with M-MDSC.*.P<0.05;C.Statistical analysis of percentages of CFSEloCD4+Foxp3+ from lymphocytes that co-cultured with M-MDSC.
2.5细粒棘球蚴感染小鼠90 d 脾脏中M-MDSC 抑制Th17增殖, 促进Treg增殖 感染90 d小鼠脾脏中M-MDSC与naïve组相比抑制小鼠淋巴细胞Th17增殖,促进Treg增殖(P<0.05,图5)。
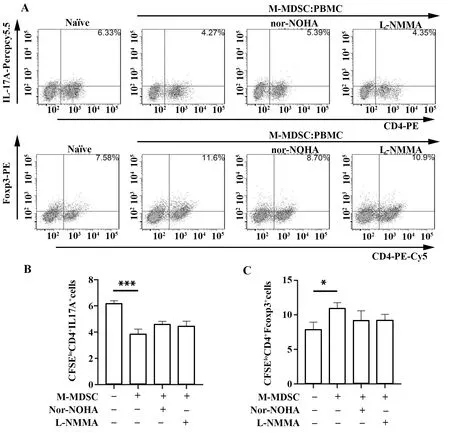
图5 感染后90 d M-MDSC抑制Th17增殖,促进Treg增殖Fig.5 M-MDSC suppressed proliferation of Th17 and promoted proliferation of Treg at 90 d after infectionNote:A.Proliferation level of CFSEloCD4+IL-17A+ cells and CFSEloCD4+FoxP3+ cells from lymphocytes that co-cultured with M-MDSC;B.Statistical analysis of percentages of CFSEloCD4+IL-17A+ from lymphocytes that co-cultured with M-MDSC.***.P<0.001;C.Statistical analysis of percentages of CFSEloCD4+Foxp3+ from lymphocytes that co-cultured with M-MDSC.*.P<0.05.
3 讨论
逃避宿主的免疫效应是维持寄生的关键因素。细粒棘球蚴在宿主体内长期生存主要依赖于有效的免疫逃逸机制。其中CD4+T细胞起主要的免疫调节作用,前期研究表明细粒棘球蚴感染的小鼠机体的免疫应答感染早期以CD4+T细胞为主的抗感染免疫,而在感染后期逐渐转变为以CD8+T细胞为主的抑制性免疫[13]。与此同时CD4+T细胞的亚群也随着感染进程发生改变,主要表现为由早期的Th1和Th17为主的保护性免疫逐渐转变为以Th2和Treg为主的抑制性免疫,进一步为虫体的免疫逃逸提供机会[14]。
既往研究表明寄生虫感染会诱导宿主MDSCs大量增加[15]。例如在刚果锥虫(Trypanosomacongolense)、和利什曼原虫(Leishmaniaspp.)、刚地弓形虫(Toxoplasmagondii)等感染后可诱导M-MDSC在体内的聚集进而抑制CD4+T增殖和功能[16,17]。在锥虫(Trypanosomacruzi)急性感染小鼠中,小鼠脾脏的MDSCs与Th17细胞比例呈负相关,在特异性去除MDSC后,会导致强烈的Th17反应并产生严重的寄生虫血症[18]。在实验性脑脊髓膜炎中发现MDSCs和CD4+T 细胞共培养可通过释放细胞因子促进Th17分化[19,20]。以上实验均可证明MDSC能够影响Th细胞的增殖分化。
本研究结果发现细粒棘球蚴感染早期(30 d)小鼠脾脏中的M-MDSC能促进Th17增殖,而对Treg无明显作用;而在纤维包囊形成期(90 d),脾脏中的M-MDSC能促进Treg增殖,并抑制Th17增殖。这一结果与患者体内Th17/Treg失衡相符合。同时研究中给予Arg1和iNOS的抑制剂并未起到明显作用。Th17和Treg都是由 naïve CD4+T增殖分化而来的T细胞亚群,在TGF-β信号通道介导下,IL-6、IL-21等促炎因子会诱导naïve CD4+T向Th17分化,当缺乏促炎因子时则会分化为Treg。而本文中并未分选出Naïve CD4+T 特异性诱导Th17和Treg增殖,而是非特异性诱导T细胞增殖,因此不能排除其他细胞分泌的因子诱导Th17和Treg增殖的现象,同时也从侧面反映出M-MDSC可能分泌大量细胞因子诱导Th17和Treg分化。这也可能是在实验中给予Agr1抑制剂和iNOS抑制剂未起到明显作用的原因。
本实验感染早期(30 d)脾脏中M-MDSC能够促进Th17增殖,而纤维包囊形成期(90 d)M-MDSC抑制Th17增殖。Th17细胞主要分泌IL-17细胞因子,其可以诱导上皮细胞、内皮细胞、纤维原细胞分泌IL-1β、IL-6、GM-CSF等吸引大量中性粒细胞浸润,同时也有文献表明在结肠癌中IL-17能够促进PMN-MDSC的聚集,因此在细粒棘球蚴感染早期M-MDSC是否通过分泌细胞因子诱导Th17的高表达进一步促进M-MDSC的聚集尚需进一步研究[21]。
综上所述,细粒棘球蚴感染小鼠MDSCs的表达升高,随着感染时间的延长,M-MDSC能诱导Th17/Treg表达失衡,形成以Treg表达为主的免疫抑制状态,从而抑制宿主的免疫杀伤,产生免疫逃逸作用。
