丙泊酚抑制wnt/β-catenin通路对宫颈癌HELA细胞生长和运动能力的调节作用①
2020-12-26汪利群涂云霞
黄 佳 潘 玫 汪利群 涂云霞
(江西省妇幼保健院生殖健康科,南昌 330006)
宫颈癌是一种常见的妇科恶性肿瘤,目前全球每年大约有47万例宫颈癌新增病例[1]。研究数据表明,宫颈癌是导致女性死亡的主要疾病之一,目前全球每年因宫颈癌失去生命的患者数超过20万例[2,3]。随着科技的进步,医疗水平的提升,宫颈癌的治疗效果显著改善,但死于宫颈癌转移和复发的患者仍然较多[4]。上皮间质转化(epithelial-mesenchymal transition,EMT)与多种恶性肿瘤的发生发展和侵袭转移有着密切的联系[5,6]。现阶段研究发现,参与 EMT 过程的信号通路包括Wnt、TGF-β、notch等信号通路,其中Wnt信号通路是一条经典的通路。Wnt信号通路可以调节宫颈癌细胞的侵袭性和转移能力[7]。丙泊酚是一种常见的静脉麻醉药,多用于肿瘤切除手术前的麻醉。近年来研究表明,丙泊酚可以抑制肿瘤细胞的生长和转移。汪威等[8]研究表明:丙泊酚可以抑制wnt/β-catenin 通路,实现抑制肿瘤细胞的侵袭性和转移力。本文旨在研究丙泊酚抑制wnt/β-catenin 通路对宫颈癌HELA细胞生长和运动能力的调节作用,以期了解丙泊酚抑制wnt/β-catenin 通路对宫颈癌HELA细胞生长和运动能力的作用机理,从而为宫颈癌患者治疗提供一定的理论依据。
1 材料与方法
1.1材料
1.1.1主要细胞 宫颈癌HELA细胞购自中国科学院细胞库。
1.1.2动物 成年雌性Wistar大鼠60只,购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2017-0022,普通级,分12个笼子饲养,每个笼子5只,于本院动物中心在15~18℃,相对湿度为35%~40%条件下饲养。
1.1.3主要试剂与仪器 丙泊酚(乐维静;国药准字H20030115)购自四川国瑞药业有限责任公司;Caspase-3、Caspase-9、Ki67、PCNA购自Abcam公司;Annexin V-FITC、MMP-9和VEGF抗体均购自Santa Cruze Biotechnology 公司;凋亡检测试剂盒购自杭州四季青生物工程材料有限公司;磷酸缓冲液PBS购自天津科密欧有限公司;DMEM 高糖培养基购自上海博升生物;CCK 试剂盒购自上海抚生实业有限公司。低温离心机购自湖南恒诺离心机有限公司;光学显微镜购自东莞市同创仪器有限公司;荧光分光光度计购自上海仪电分析仪器有限公司;流式细胞仪购自赛默飞世尔科技有限公司。
1.2方法
1.2.1分组干预 将人宫颈癌HELA细胞分为:空白组(Control)、低剂量丙泊酚组(propofol 2.5 μg/ml)、中剂量丙泊酚组(propofol 5 μg/ml)、高剂量丙泊酚组(propofol 10 μg/ml),分别为0、2.5、5、10 μg/ml 的丙泊酚预处理。
将60只成年雌性Wistar大鼠分为:空白组(Control)、低剂量丙泊酚组(propofol 10 mg/kg)、中剂量丙泊酚组(propofol 20 mg/kg)、高剂量丙泊酚组(propofol 50 mg/kg),分别腹腔注射0、10、20、50 mg/kg 的丙泊酚。
1.2.2细胞培养 将人宫颈癌HELA细胞培养于含10%FBS的DMEM 高糖培养基中,在37℃、5%CO2培养箱内培养,细胞传代,取对数生长期细胞进行实验。
1.2.3建立模型 建立宫颈癌移植瘤大鼠动物模型及判断建模是否成功参考高岿然等[9]实验方法。取对数生长期的宫颈癌HELA细胞,消化、离心后在大鼠皮下注射接种 2.5×1010个/ml,隔日观察肿瘤生长情况以及大鼠的一般情况。
1.2.4CCK8检测细胞增殖 常规培养宫颈癌HELA细胞,当细胞生长融合度大于80%时,使用胰蛋白酶消化后离心,PBS溶液洗涤,然后使用培养基重悬细胞,调整细胞浓度1×104个/ml。在96孔板上,每孔加入细胞悬液90 μl,每组设4个复孔。分别加入0、2.5、5、10 μg/ml的丙泊酚。每孔加入10 μl CCK8试剂轻敲培养板混匀,继续培养3 h,取出测定其在450 nm 波长处的吸光度,并按照CCK 试剂盒说明书计算细胞增殖情况。
1.2.5流式细胞术检测细胞凋亡 恒温离心机保持4℃,1 000 r/min离心 5 min 收集细胞;收集细胞后加入100 μl Binding Buffer重悬细胞并加入5 μl Annexin V-FITC和 5 μl PI,轻轻混匀;室温避光孵育 15 min并加入400 μl Binding Buffer用流式细胞仪检测。
1.2.6Transwell检测细胞运动能力 参照Hu等[10]的Transwell研究方法。将细胞培养24 h后,制成无FBS悬浮液恒温培养1 d后,随机选取视野使用显微镜观察细胞形态,同时统计细胞数量。
1.2.7大鼠模型试验 将60只成年雌性Wistar大鼠皮下注射宫颈癌HELA细胞建立移植瘤模型,分别将低中高剂量丙泊酚10、20、50 mg/kg腹腔注射,并设置空白对照组,注射等量的生理盐水。30 d后检测肿瘤重量。
1.2.8Western blot 检测蛋白表达水平 按照Western blot 检测方法操作,蛋白质条带用扫描仪进行扫描,采用Imagaquent 5.1软件对Ki67、PCNA、Caspase-3、Caspase-9、MMP-9、VEGF蛋白质条带灰度进行相对定量分析。以目的蛋白条带与GAPDH灰度比值表示蛋白相对表达水平。
1.2.9免疫组化观察 本实验中免疫组化采用PV 法染色,将石蜡切片5 μm,常规脱蜡后使用3%过氧化氢甲醇溶液室温浸泡15 min并使用 4%胃蛋白酶消化15 min,滴加一抗 VEGF(效价1∶50),Ki67 (效价1∶50)置于湿盒中恒温冰箱保存12 h,使用0.01 mol/L PBS清洗后滴加二抗葡聚糖-酶复合物,37℃孵育60 min,再次使用0.01 mol/L PBS清洗,显色后使用苏木素复染1 min脱水并封片。
1.3统计学分析 本研究采用SPSS20.0统计学软件对数据进行处理和分析,方差分析使用单因素方差分析,若P<0.05表示差异有统计学意义。
2 结果
2.1丙泊酚对宫颈癌HELA细胞生长情况的影响 CCK8检测结果显示,与空白组比较,使用不同浓度丙泊酚处理24 h、48 h及72 h对宫颈癌HCLA细胞生长能力均无显著影响(P>0.05);使用丙泊酚处理96 h后的宫颈癌HELA细胞生长能力显著低于空白组,且高剂量丙泊酚组宫颈癌HELA细胞生长能力显著低于中剂量丙泊酚组和低剂量组,中剂量丙泊酚组宫颈癌HELA细胞生长能力显著低于低剂量组,差异有统计学意义(P<0.05),见图1A。与空白组相比,丙泊酚处理组Ki67及PCNA蛋白表达水平显著降低,且高剂量组显著低于中剂量组,中剂量组显著低于低剂量组,差异有统计学意义(P<0.05),见图1B。

图1 丙泊酚对宫颈癌HELA细胞生长的影响Fig.1 Effects of propofol on growth of cervical cancer HELA cellsNote:A.Cell proliferation detected by CCK8;B.Expressions of Ki67 and PCNA proteins vs Control,*.P<0.05.
2.2丙泊酚对宫颈癌HELA细胞凋亡情况的影响 流式细胞仪检测结果显示,丙泊酚预处理组细胞凋亡率显著高于空白组,高剂量丙泊酚组宫颈癌HELA细胞凋亡率显著高于中剂量组,中剂量组宫颈癌HELA细胞凋亡率显著高于低剂量组(P<0.05),见图2A;与空白组相比,丙泊酚处理组活化的Caspase-3和Caspase-9水平显著升高且高剂量丙泊酚组活化的Caspase-3和Caspase-9水平显著高于中剂量组,中剂量组活化的Caspase-3和Caspase-9水平显著高于低剂量组(P<0.05)见图2B。

图2 丙泊酚对宫颈癌HELA细胞凋亡情况的影响Fig.2 Effects of propofol on apoptosis of cervical cancer HELA cellsNote:A.Detection of apoptosis by flow cytometry;B.Expressions of related apoptosis proteins Caspase-3 and Caspase-9.*.P<0.05 vs Control.
2.3丙泊酚对宫颈癌HELA细胞运动情况的影响 Transwell检测结果显示,相比空白组,丙泊酚预处理组单位面积侵袭细胞数目显著降低,高剂量组单位面积侵袭细胞数目显著低于中剂量组,中剂量组单位面积侵袭细胞数目显著低于低剂量组,差异有统计学意义(P<0.05),见图3A;与空白组相比,丙泊酚处理组MMP-9、VEGF蛋白表达水平显著降低,高剂量组MMP-9、VEGF蛋白表达水平显著低于中剂量组,中剂量组MMP-9、VEGF蛋白表达水平显著低于低剂量组,且差异有统计学意义(P<0.05),见图3B。

图3 丙泊酚对宫颈癌HELA细胞运动能力影响Fig.3 Effects of propofol on motor ability of cervical cancer HELA cellsNote:A.Cell motor ability detected by Transwell;B.Expressions of cell migration-related proteins MMP-9 and VEGF.*.P<0.05 vs Control.
2.4丙泊酚对宫颈癌HELA细胞wnt/β-catenin 通路的影响 与空白组相比,丙泊酚预处理组wnt1、β-catenin和c-Myc蛋白表达水平显著降低,高剂量组显著低于中剂量组,中剂量组显著低于低剂量组,差异有统计学意义(P<0.05),见图4。

图4 丙泊酚对宫颈癌HELA细胞wnt/β-catenin 通路影响Fig.4 Effects of propofol on wnt/β-catenin pathway in cervical cancer HELA cellsNote:*.P<0.05 vs Control.
2.5丙泊酚对大鼠体内肿瘤的影响情况 与空白组相比,丙泊酚预处理组大鼠肿瘤质量显著降低,高剂量组显著低于中剂量组,中剂量组显著低于低剂量组,差异有统计学意义(P<0.05),见图5A。免疫组化染色可以看出,空白组Ki67和VEGF均被染成淡黄色,呈显著阳性表达,丙泊酚预处理组Ki67和VEGF呈蓝色,且随着丙泊酚浓度增加蓝色逐渐加深,见图5B。与空白组相比,丙泊酚预处理组Ki67和VEGF阳性细胞数目百分比显著降低,且高剂量组显著低于中剂量组,中剂量组显著低于低剂量组,差异有统计学意义(P<0.05),见图5C。
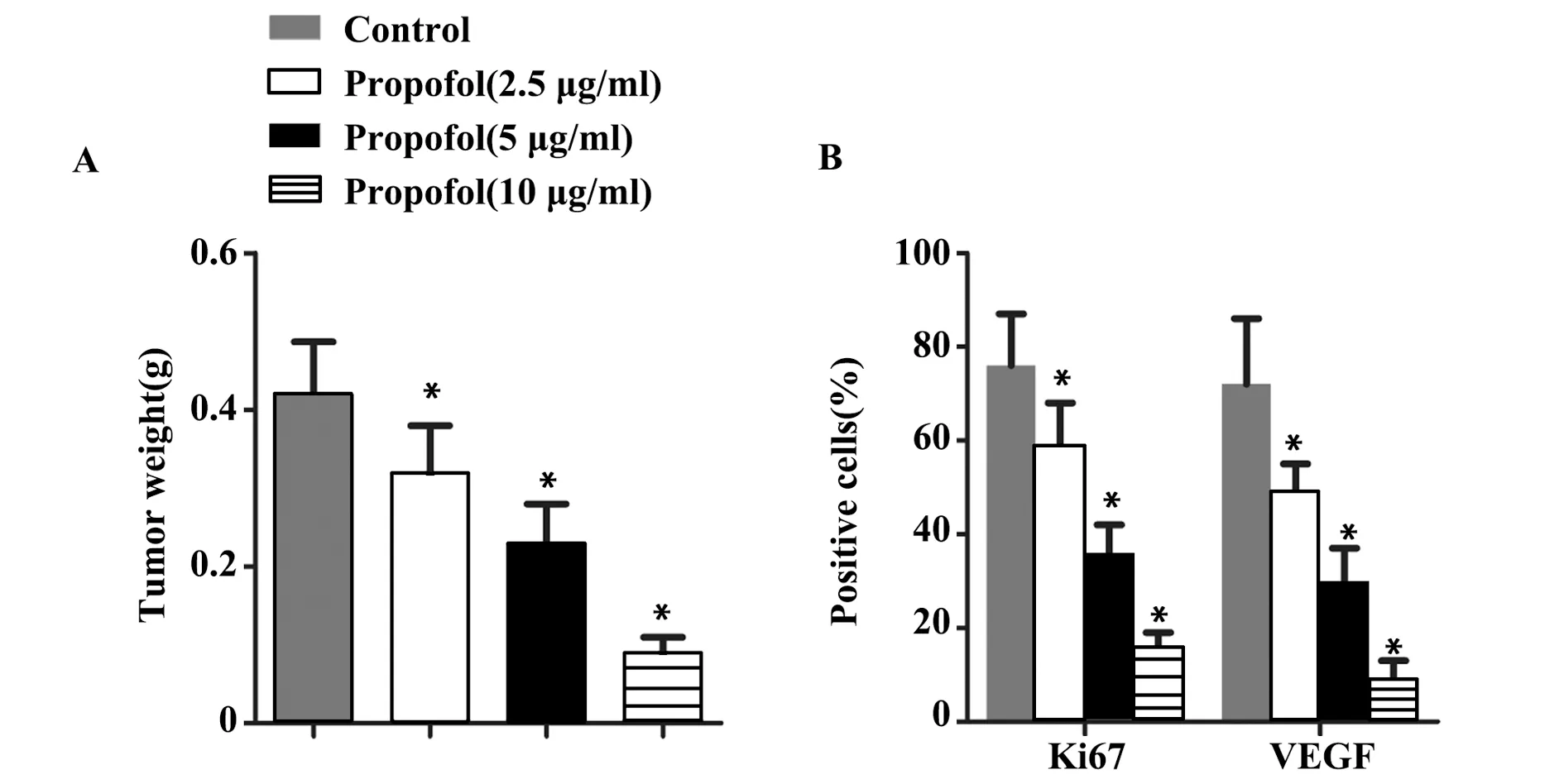
图5 丙泊酚对大鼠体内宫颈癌肿瘤的影响Fig.5 Effects of propofol on cervical cancer tumor in ratsNote: A.Tumor weight in rats;B.Positive rates of Ki67 and VEGF in cervical cancer tissues of rats;C.Expressions of Ki67 and VEGF in cervical cancer tissues by immunohistochemistry (× 400).*.P<0.05 vs Control.
3 讨论
增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)是细胞增殖分化的重要蛋白之一,PNCA指数越高,细胞的分裂增殖越快[11]。当PNCA指数持续升高会使细胞在形态和结构机能上改变并且使得细胞获得无限增殖的能力[12]。增殖细胞周期相关核抗原(Ki67)是一种细胞核内与细胞分裂增殖相关的蛋白抗原,可以反映细胞增殖能力,当Ki67表达升高,说明细胞增殖能力增强,Ki67表达降低则说明该细胞增殖能力降低。石小燕等[13]研究表明:Ki67的表达与细胞增殖密切相关,是调节细胞周期的重要组成部分。本实验中可以看出使用丙泊酚处理后宫颈癌HELA细胞中Ki67及PCNA蛋白表达显著降低,且在一定浓度范围内随着丙泊酚处理浓度增加Ki67及PCNA蛋白表达显著降低。表明了丙泊酚可以通过降低Ki67及PCNA蛋白表达水平抑制宫颈癌HELA细胞的增殖能力,且呈浓度依赖性。
细胞凋亡是受基因调控的一种程序性死亡,其中Caspase是细胞凋亡的核心。Caspase-3、Caspase-9是Caspase家族的凋亡因子[14]。王铭等[15]研究表明:Caspase-9是Caspase家族中最常见的凋亡启动子。在Caspase家族中主要执行凋亡的基因为Caspase-3[16]。有活性的Caspase-9裂解使得 proCaspase-3产生有活性的Caspase-3并通过剪切另外的Caspase底物,引起级联反应,最终导致移植瘤发生凋亡,达到控制肿瘤细胞凋亡的作用[17]。本研究发现,使用丙泊酚处理后宫颈癌HELA细胞中有活性的Caspase-3、Caspase-9含量显著增加,说明丙泊酚处理可以促进宫颈癌HELA细胞的凋亡,同时随着丙泊酚处理浓度的增加,有活性的Caspase-3、Caspase-9含量显著增加,表明丙泊酚促进宫颈癌HELA细胞的凋亡呈浓度依赖性。
基质金属蛋白酶(matrix metalloproteinase,MMPs)是一类具有降解细胞外基质(extracellular matrix,ECM)能力的蛋白水解酶。MMPs与肿瘤细胞的浸润、迁移、运动及血管生成等有着密切的关系[18]。刘进忠等[19]研究表明:肿瘤细胞发生侵袭转移首先需要降解ECM并破坏基底膜。MMP-9则是降解 ECM最重要的蛋白酶类。当MMPs激活后形成的MMP-9降解、破坏肿瘤表面成分后会使得肿瘤细胞沿缺失的基底膜向周围组织浸润,促进癌细胞侵袭和转移。本研究发现使用丙泊酚处理后宫颈癌HELA细胞MMP-9显著降低,且随着丙泊酚的浓度增加MMP-9表达水平显著降低,说明丙泊酚可以抑制宫颈癌HELA细胞表达MMP-9,达到抑制肿瘤侵袭和迁移的效果,且在一定浓度范围内呈浓度依赖性。
刘洪伟等[20]研究表明激活Wnt/β-catenin 信号通路对细胞的分化和生长有着密切的关系,研究证实,抑制 Wnt1 信号通路可以抑制肿瘤细胞增殖并诱导肿瘤细胞的凋亡。刘春兰等[21]研究表明:免疫组化方法分析 Wnt1 和 β-catenin 在宫颈癌细胞中表达显著高于正常宫颈细胞,且与疾病的发展呈正相关。研究证实在宫颈鳞状上皮的恶性转换过程中Wnt1 和 β-catenin参与其中,同时在宫颈癌的发展过程中起了促进作用。本研究发现使用丙泊酚处理后宫颈癌HELA细胞中Wnt1 和 β-catenin蛋白及该通路相关蛋白c-Myc表达显著降低,说明丙泊酚可以抑制Wnt/β-catenin 信号通路,同时随着丙泊酚处理浓度的增加,Wnt/β-catenin 信号通路相关蛋白表达量进一步减少,说明Wnt/β-catenin 信号的抑制程度会随着丙泊酚浓度的升高而增加,且呈剂量依赖性。
综上所述,丙泊酚可通过抑制Wnt/β-catenin 通路实现抑制宫颈癌HELA细胞生长和运动能力,其作用机制可能与促进凋亡因子Caspase-3和Caspase-9表达,抑制细胞侵袭和迁移相关蛋白的表达,同时抑制Wnt/β-catenin 通路有关蛋白的表达有关。但调控宫颈癌HELA细胞相关通路较多,在后续的实验中可以进一步探讨丙泊酚通过调节其他通路对宫颈癌HELA细胞生长、侵袭、迁移及凋亡机制的影响。
