牡荆素调控M1/M2型巨噬细胞极化抗肺腺癌转移的作用研究①
2020-12-25殷亦男王程燕焦丽静
赵 蓓 殷亦男 王程燕 毕 凌 许 玲 焦丽静
(上海中医药大学附属岳阳中西医结合医院肿瘤一科,上海200437)
肺癌是世界上最常见的癌症,在男性中占所有癌症死亡人数24%,女性占23%[1]。随着手术、化疗、靶向治疗等各种治疗方案的应用,肺癌5年生存率有了很大的提高,但近90%的肺癌患者因癌细胞发生转移而死亡[1,2]。不可避免的癌细胞转移依然是肺癌整体治疗所面临的主要难题[3]。免疫应答是人体防御肿瘤的天然屏障,而免疫效应的失衡是肿瘤发生和进展的重要原因。巨噬细胞是一种非特异性免疫效应细胞,在人体免疫系统中发挥重要的作用,具有免疫监视、免疫防御、免疫调节以及抗原呈递等多种免疫功能[4]。肿瘤相关巨噬细胞(tumor-associated macrophage,TAMs),是浸润在肿瘤组织中的巨噬细胞,是肿瘤微环境中最多的免疫细胞[5]。有研究发现,TAMs能够分泌细胞因子如肿瘤坏死因子α 和血管内皮生长因子A等促进肿瘤形成新的血管,从而促进肿瘤的转移[6]。
牡荆素是一种广泛存在于植物中的天然黄酮类化合物,具有抗炎、抗氧化、止痛等生物活性,并且对食管癌、淋巴瘤等有着明显的增殖抑制效果,在肿瘤治疗上有着较好的应用前景[7-9]。在本项目组的前期研究中,牡荆素能够抑制非小细胞肺癌(non-small cell lung cancer,NSCLC)A549细胞增殖、迁移及侵袭,并且能够上调Caspase3、Caspase9、Bcl-2和Bax基因表达,具有多靶点的抗肺癌效应。在此基础上,本研究进一步探讨牡荆素多靶点抗肺癌的机制,推动牡荆素在NSCLC中的应用。
1 材料与方法
1.1材料 小鼠单核巨噬细胞株(RAW264.7细胞),A549细胞株购自中国科学院上海细胞库,支原体检测阴性。中药单体牡荆素(诗丹德生物技术公司);脂多糖(LPS,Sigma);IL-4(PeproTech);PE anti-mouseCD206(Biolegend);pSTAT3(Abcam);RNA提取试剂,结晶紫染料(美国Sigma公司);CCK8试剂盒(同仁化学研究所);Transwell小室(美国Corning公司);Perfect real time-PCR试剂盒(日本TaKaRa公司);SYBR Green RCR Kit(QuantiNova公司);PCR引物设计和合成(生工生物工程有限公司);DMEM培养基,胎牛血清(美国Gibco公司);Griess试剂盒(上海碧云天)。
1.2方法
1.2.1RAW264.7细胞的培养 用完全培养基(含10%FBS的高糖DMEM培养基)在37℃、 5%CO2的培养箱中培养RAW264.7细胞,每日更换培养基,待细胞生长到80%左右传代。
1.2.2A549细胞的培养 用完全培养基(含10%FBS的高糖DMEM培养基)在37℃、5%CO2的培养箱中培养A549细胞,隔日更换培养基,待细胞生长到80%左右传代。
1.2.3CCK8检测牡荆素对RAW264.7细胞活力的影响 取对数生长期的RAW264.7细胞,按照每孔100 μl(密度为5×104个/ml)接种到96孔板,每组3个复孔。除空白对照组外,设置不同的给药浓度组(200、100、50、25、12.5 μmol/L),培养24 h。随后,每孔加入10 μl的CCK8试剂避光孵育1.5 h,利用酶标仪于OD450nm波长处检测各孔的吸光度A。细胞活力计算公式为:细胞活力(%)=各浓度给药组的A/空白组的平均A×100%。
1.2.4Real-time PCR法观察牡荆素对细胞内iNOS、IL-1β、Arg-1、MR基因表达的影响 RAW264.7细胞培养于6孔板,设置空白对照组、M1模型组、M2模型组、M1模型牡荆素干预组、M2模型牡荆素干预组(25、50、100 μmol/L),贴壁生长过夜。M1模型组和M1模型牡荆素组加入LPS,处理24 h后收集各组RNA样品。M2模型组和M2牡荆素干预组加入IL-4(20 ng/ml),协同刺激细胞,收集24 h各种的RNA样品。用Trizol提取方法细胞总的RNA,用Perfect Real Time试剂盒逆转录提取总cDNA,反应体系37℃ 15 min,85℃ 5 s,4℃保存,后用RT-PCR进行检测。PCR反应条件:95℃ 2 min,95℃ 5 s,60℃ 10 s,共40个循环。重复3次,β-肌动蛋白(β-actin) 作为内标基因。使用2-ΔΔCt法计算mRNA含量。

表1 检测基因的引物序列
1.2.5Griess法测定RAW264.7细胞中NO含量 RAW264.7细胞以5×103个/孔接种于96孔板中,贴壁生长过夜,无血清培养24 h。分别设置空白对照组、M1模型组、给药组,空白对照组不给予任何处理,M1模型组和给药组采用LPS(500 μg/L)协同刺激细胞,同时牡荆素以25、50、100 μmol/L剂量处理给药组。24 h后吸取上清液50 μl加入新的96孔板中,加入等量的Griess反应试剂,反应时间为10 min,在540 nm下读数,计算细胞上清液中NO含量。
1.2.6Transwell小室迁移实验观察巨噬细胞诱导M2型巨噬细胞前后对肺腺癌A549细胞的迁移能力及牡荆素干预的影响 处于对数生长期的RAW264.7细胞以1×106个/孔培养于24孔板中,分别设置M2模型组和牡荆素组采用IL-4(20 μg/L)刺激细胞,同时牡荆素组以25、50、100 μmol/L剂量处理细胞,24 h后收集上清液,各取600 μl置于24孔板下室,放入Transwell小室,在Transwell小室上室加入无血清培养基调整密度为5×105个/ml的A549细胞,体积均为100 μl,作用24 h后,用4%多聚甲醛固定30 min,0.5%结晶紫染色30 min,水漂洗后用棉签轻轻拭去Transwell小室上层未迁移的细胞,200倍显微镜下随机5个视野观察细胞并计数。
1.2.7流式细胞术检测牡荆素对于巨噬细胞M2型的抑制作用 RAW264.7细胞分组同1.2.4,24 h后收集细胞,用预冷的PBS冲洗2遍,PBS重悬细胞,调整细胞浓度为1×107个/ml,取100 μl到流式管中,加入PE 抗鼠CD206抗体以及IgG2a的同型对照组,4℃避光孵育20 min;1 000 r/min离心5 min,收集细胞,弃上清,再加入200 μl PBS,Cytoflex流式细胞仪检测。用Cytoflex软件分析结果。
1.2.8Western blot和RT-PCR法考察牡荆素对蛋白的影响 细胞分组同1.2.4,24 h后,用冰PBS洗涤,加入含蛋白酶抑制剂和磷酸酶抑制剂的裂解液后收集细胞,放置冰上30 min,离心(12 000 r/min,15 min,4℃),取蛋白上清液进行蛋白测定。每孔加入 20 μg的蛋白上样,80 V恒压电泳30 min,再转为120 V恒压电泳分离蛋白,经200 mA恒流转膜2 h,用5%脱脂牛奶封闭液常温下封闭1 h,PBS洗涤3次,每次10 min,再加入p-STAT3和GAPDH抗体,置4℃孵育过夜(抗体稀释比例1∶1 000),用TBST洗涤3次,每次10 min,再加入二抗(1∶10 000)室温下孵育1.5 h,再洗涤3次,曝光。
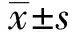
2 结果
2.1牡荆素对RAW264.7细胞活力的影响 不同浓度牡荆素作用于巨噬细胞,CCK8结果显示,牡荆素25、50、100 μmol/L浓度时对静息状态下的巨噬细胞无明显的细胞毒性,因此选用25、50、100 μmol/L用于后续的实验,如图1。
2.2牡荆素对不同表型细胞内iNOS、IL-1β、Arg-1、MR基因表达的影响 正常状态下,iNOS、IL-1β、Arg-1、MR基因在巨噬细胞中呈低表达,经LPS诱导刺激后iNOS和 IL-1β的表达均显著升高;与M1组相比,牡荆素在25、50、100 μmol/L浓度下可明显抑制M1表型相关基因iNOS和IL-1β的表达,且呈浓度依赖性。而IL-4可诱导M2组中的Arg-1和 MR的表达上升,牡荆素可呈浓度依赖下调Arg-1和MR的基因表达,如图2。
2.3牡荆素对LPS诱导下RAW264.7细胞分泌NO的影响 与静息状态下的巨噬细胞相比,经LPS干预后的RAW264.7细胞上清液中NO明显升高;与M1组相比,加入25、50、100 μmol/L的牡荆素均可抑制NO的释放量,且随着浓度的增高,NO的释放量越低,如图3。
2.4牡荆素对IL-4诱导M2型巨噬细胞对肺癌A549的迁移能力变化 与空白对照组比较,经IL-4诱导的M2型巨噬细胞上清液可显著增强 NSCLCA549体外迁移能力;而牡荆素低、中、高三个剂量干预组的细胞上清液能够显著抑制M2型A549细胞迁移,图4。

图1 牡荆素对巨噬细胞的细胞活力的影响Fig.1 Effect of vitexin on cell viability of macrophagesNote:Compared with control group,△△.P<0.01.
2.5牡荆素对IL-4诱导M2型巨噬细胞表型CD206的变化 静息状态下的巨噬细胞CD206表型不明显,经过IL-4诱导的M2型巨噬细胞显著提升了巨噬细胞表型CD206的表达;而牡荆素可以明显抑制M2型巨噬细胞CD206的表达,并且存在浓度依赖性,图5。
2.6牡荆素对IL-4诱导M2型巨噬细胞IL-4/STAT3通路的影响 在正常的巨噬细胞中,STAT3蛋白磷酸化水平低表达,经刺激剂IL-4激活后巨噬细胞磷酸化水平显著提高。牡荆素低剂量和高剂量均能够显著降低STAT3的磷酸化水平,呈剂量依赖性,图6。
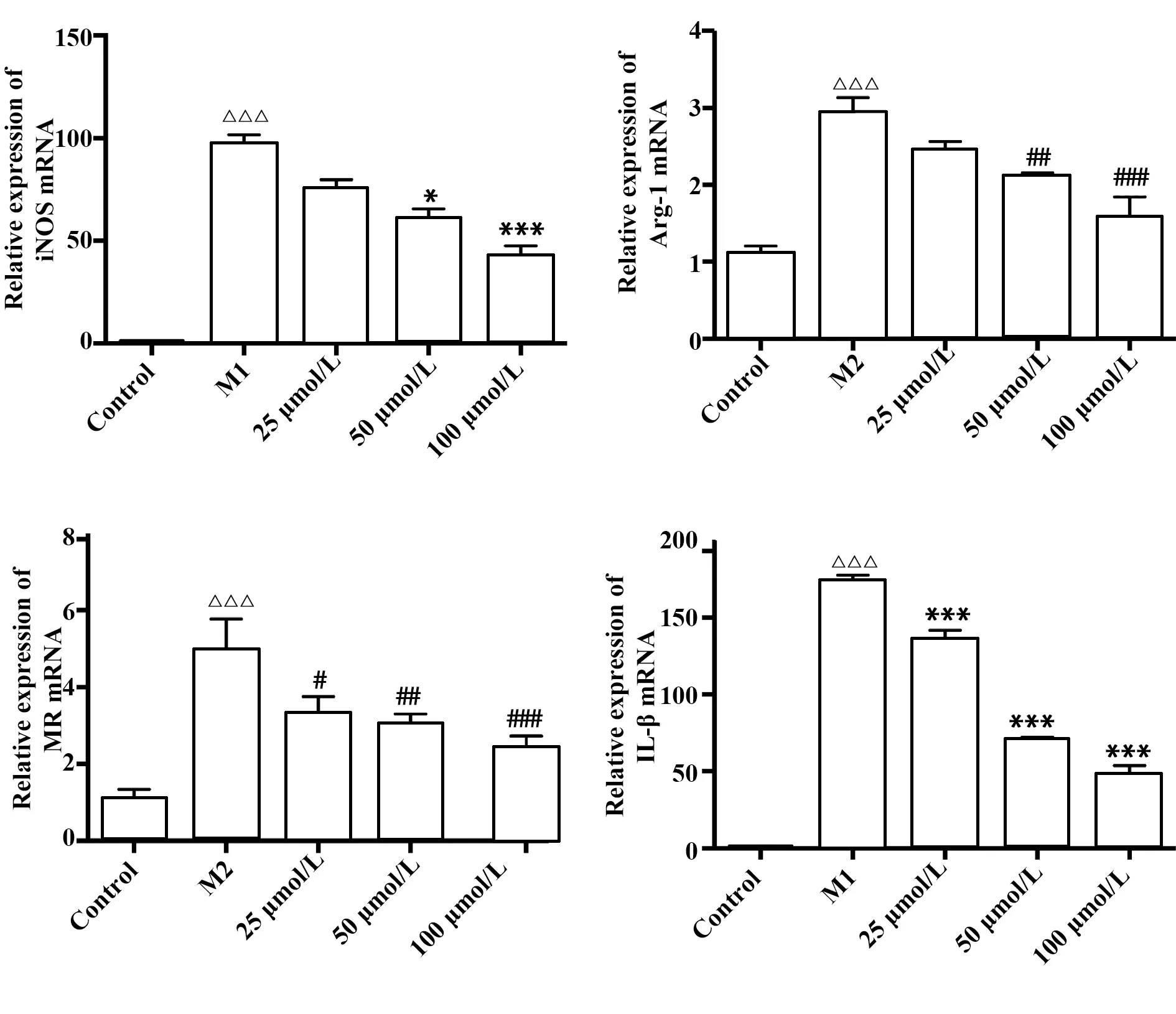
图2 牡荆素对 M1/M2型巨噬细胞中IL-1β、iNOS、MR和Arg-1的mRNA表达的影响 Fig.2 Effects of vitexin on mRNA expression of IL-1β,iNOS,MR and Arg-1 in M1/M2 macrophagesNote:Compared with control group,△△△.P<0.01; compared with M1 group,*.P<0.05,**.P<0.01,***.P<0.001;compared with M2 group,#.P<0.05,##.P<0.01,###.P<0.001.
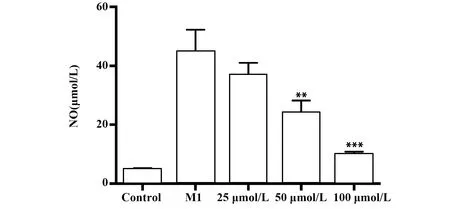
图3 牡荆素对M1型巨噬细胞上清液中NO含量的影响Fig.3 Effect of vitexin on NO content in supernatant of M1 macrophageNote:Compared with M1 group,**.P<0.01,***.P<0.001.

图4 M2型巨噬细胞对非小细胞肺癌A549细胞的体外迁移及牡荆素干预的影响(×200)

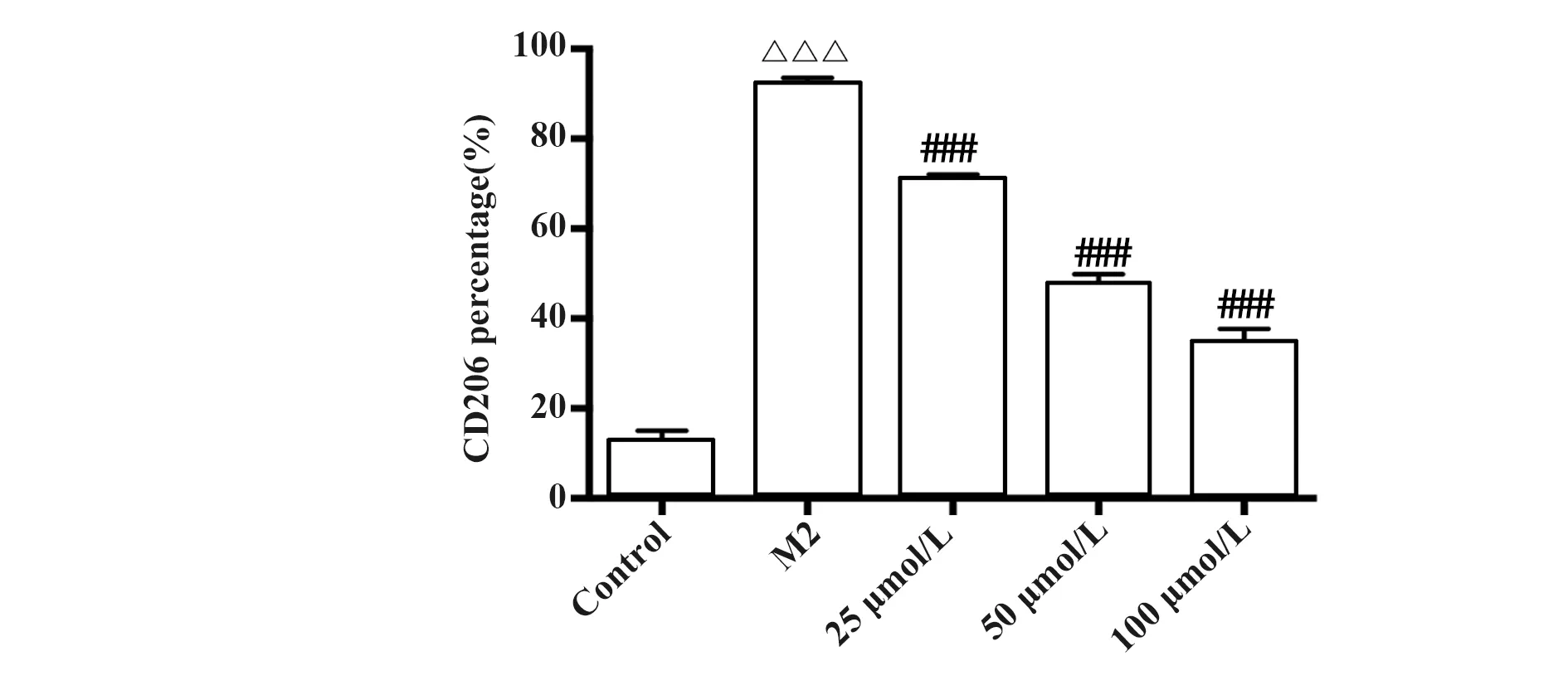
图5 牡荆素对M2型巨噬细胞CD206表型的影响
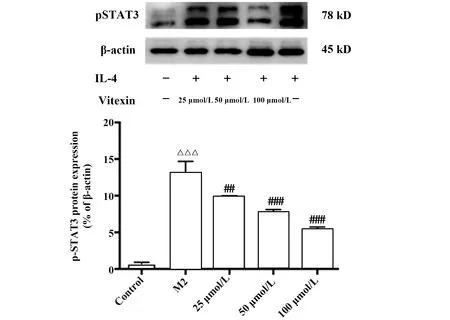
图6 牡荆素对M2型巨噬细胞STAT3蛋白磷酸化水平的影响Fig.6 Effect of vitexin on phosphorylation of STAT3 protein in M2 macrophageNote:Compared with control group,△△△.P<0.001;compared with M2 group,##.P<0.01,###.P<0.001.
3 讨论
肺癌作为全球人类死亡的重要原因,给人类健康造成沉重负担,并给临床医生和患者带来重大的挑战[1]。NSCLC是肺癌的一种亚型,约占肺癌的85%~90%,是癌症死亡最常见的类型[10]。目前在NSCLC治疗中已经引入一些新的治疗方法,如免疫治疗、靶向治疗[11]。巨噬细胞是炎症效应细胞和宿主防御肿瘤,巨噬细胞在肿瘤中具有丰富的表达[6]。但是与其他细胞不同,巨噬细胞存在着高度异质,可以通过局部微环境刺激从M0阶段极化到不同的亚型即M1和M2,显示完全相反的功能[12,13]。
巨噬细胞的极化现象在肿瘤发展中广泛存在,M1型巨噬细胞通过分泌促炎因子和趋化因子参与机体的炎症反应,M2型巨噬细胞则是分泌抑制细胞炎症的因子,抑制炎症,降低机体免疫反应,促进肿瘤的转移[14,15]。其极化调节主要是通过一些核内信号蛋白发挥作用[16]。M1型巨噬细胞被IFN-γ、LPS或TNF-α激活,使IL-1β和iNOS在M1型巨噬细胞中高表达。其中iNOS是一氧化氮合酶(NOS)的一种,细胞中的NOS以L-精氨酸为底物,生成大量的NO,诱导致炎信号通路,过度的炎症则对机体造成一定的损伤[17,18]。牡荆素浓度低于200 μmol/L,可以下调M1型巨噬细胞iNOS和IL-1β细胞因子mRNA的水平,并且显著抑制M1型巨噬细胞中NO,抑制炎症反应。M2型巨噬细胞由IL-4和IL-13诱导,特异性表达Arg-1和甘露糖(MR,CD206)。而Arg-1是M2型巨噬细胞的标记物,它将L-精氨酸水解成尿素和鸟氨酸,并通过与iNOS竞争共同底物L-精氨酸来抑制NO介导途径,给肿瘤细胞提供营养,协助肿瘤的远端转移和免疫逃逸[19,20]。M2型巨噬细胞能够调节炎症反应和适应性Th2免疫,主要发挥免疫抑制作用[21],通过调节免疫应答,驱动肿瘤的生长和促进肿瘤微血管系统的形成[22]。CD206是M2型巨噬细胞特异性标志物,高表达能够促进肿瘤细胞的转移[23]。TAMs大多是M2型巨噬细胞,促进肿瘤转移,侵袭和免疫逃逸,其数量与多种肿瘤预后呈负相关[24]。所以阻断巨噬细胞的M2型极化是抑制肿瘤进展的一个重要的策略。
黄酮类药物具有抗炎的生物活性,能够显著抑制LPS诱导M1型巨噬细胞的炎症介质,能够调节M2型巨噬细胞的极化[25-27]。牡荆素具有低细胞毒性,能够通过LPS激活RAW264.7,降低TNF-α、IL-1β、NO、PGE2的释放,促进IL-10释放,同时还能够调节促炎介质的转录因子,降低LPS诱导细胞中pP38、p-ERK1/2和p-JNK的表达[28]。但是牡荆素对于M2型巨噬细胞的生物作用尚缺少深入研究,本研究通过研究牡荆素对小鼠巨噬细胞极化的影响发现,牡荆素可以抑制IL-4诱导的M2型标志物MR、Arg-1和CD206的表达,发挥M2型极化抑制的作用。据文献报道,JAK/STAT3信号通路在多种肿瘤细胞系中均有异常,并在肿瘤的发生发展有重要的作用。在正常组织中,STAT3信号处于失活状态,而在肿瘤细胞中过度活化[29]。在巨噬细胞静息的状态下,STAT3信号通路并不活化,IL-4能够激活STAT3信号的通路。文献报道,天然产物成分可以通过抑制STAT3的激活来抑制肿瘤细胞增殖和巨噬细胞向M2表型极化的进程[30]。本研究发现牡荆素可以降低STAT3蛋白的磷酸化水平,使得IL-4/STAT3信号通路失活,从而影响巨噬细胞M2型的极化。
综上,牡荆素调节M1型巨噬细胞iNOS、IL-1β的基因表达;牡荆素通过抑制STAT3信号通路活化,影响M2型巨噬细胞Arg-1、MR和CD206的表达,减弱M2表型促非小细胞肺癌的体外转移的能力,最终发挥抗肺癌的作用。
