新型冠状病毒肺炎早期ARDS危险因素的研究
2020-12-24马广宇赵文静
马广宇 刘 通 蔡 稳 赵文静
自2019年12月以来,由新型冠状病毒(2019 novel coronavirus,2019-nCoV)引起的新型冠状病毒肺炎(corona virus disease 2019,COVID-19)疫情在中国境内迅速蔓延并成为全球大流行疾病,截至2020年5月18日,全球累计约270万人感染[1]。部分患者入院后,病情可在短时间内迅速恶化,部分患者出现急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS) 表现[2]。尽管已对其治疗措施进行较多研究,ARDS的病死率仍高达30%[3]。为了早期预测预后可能发生ARDS的患者,现对590例相关病例的临床资料进行研究。
对象与方法
1.研究对象:选择2020年1月10日~3月15日江苏省收治的631例COVID-19患者,排除孕妇、年龄<18周岁及3例信息缺失患者,共纳入590例病例。所有病例均经咽拭子检查,采用反转录-聚合酶链反应(RT-PCR)方法检测新型冠状病毒核酸阳性。ARDS的诊断符合柏林标准:发病时间在已知临床发病或呼吸症状新发、加重后1周内,胸部影像学呈双侧致密影,且无法由胸腔积液、肺不张或肺结节完全解释,以及出现无法用心力衰竭或液体超负荷完全解释的呼吸衰竭,PaO2/FiO2(氧合指数)≤300 即可诊断ARDS[4]。
2.研究方法:将590例患者按照国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》[5]进行临床分型并分组,轻型、普通型为轻症组(PaO2/FiO2>300mmHg,1mmHg=0.133kPa),重型、危重型为重症组(PaO2/FiO2≤300mmHg)。分析患者来院就诊后1~3天内完善的早期临床指标白细胞计数(WBC)、中性粒细胞计数(NEUT)、淋巴细胞计数(LY)、血小板计数(PLT)、白蛋白(ALB)(取多次检查结果中最差1次)及1~6天内使用干预措施的累积天数和剂量。
3.统计学方法:采用SPSS 22统计学软件对数据进行统计分析。非正态计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示,比较用秩和检验;计数资料以率(%)表示,比较用χ2检验。影响因素的分析采用Logistic回归模型,绘制ROC曲线,以P<0.05为差异有统计学意义。
结 果
1.两组患者相关因素比较:重症患者的平均年龄60.5(52.2~71.0)岁高于轻症患者46.0(33.0~56.0)岁,差异有统计学意义(P=0.000);两组性别比较,差异有统计学意义(P=0.032),重症组男性多于女性,详见表1。
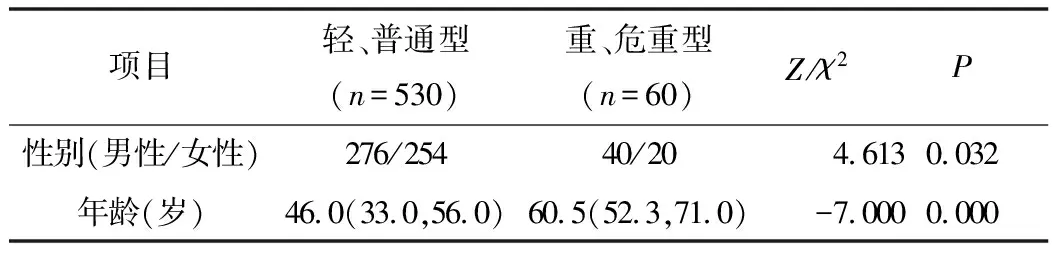
表1 590例COVID-19患者一般情况比较[M(Q1,Q3)]
两组NEUT、LY、PLT、ALB、从发病到住院时间比较,差异有统计学意义(P<0.05),重症组男性、NEUT水平、从发病到住院时间高于轻症组;LY、PLT、ALB水平低于轻症组。两组白细胞计数、糖皮质激素和白蛋白早期使用天数和剂量比较,差异无统计学意义(P>0.05),详见表2、表3。
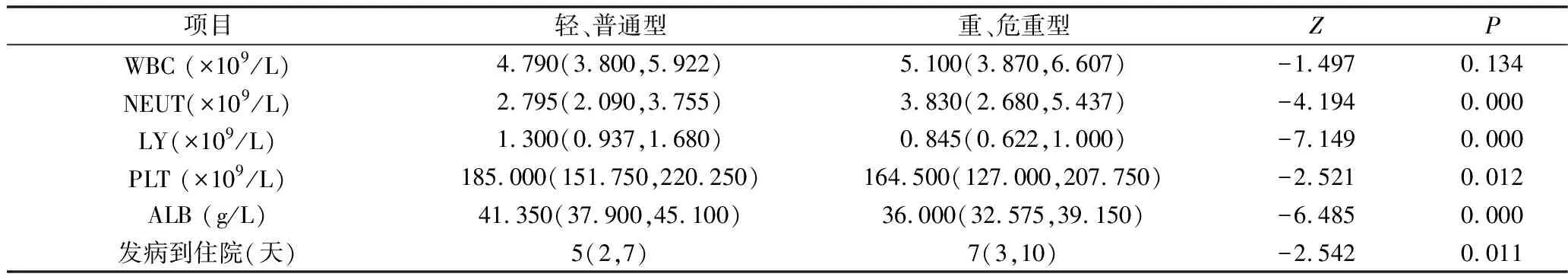
表2 不同分组COVID-19患者实验室基线特征比较[M(Q1,Q3)]

表3 不同分组COVID-19患者干预措施比较[n(%),M(Q1,Q3)]
2.多因素分析:以研究对象是否为重症组为因变量,以单因素分析中差异有统计学意义的变量为自变量,进行二元Logistic回归分析。年龄、NEUT、LY、ALB是进展为早期ARDS的危险因素(P<0.05),详见表4。
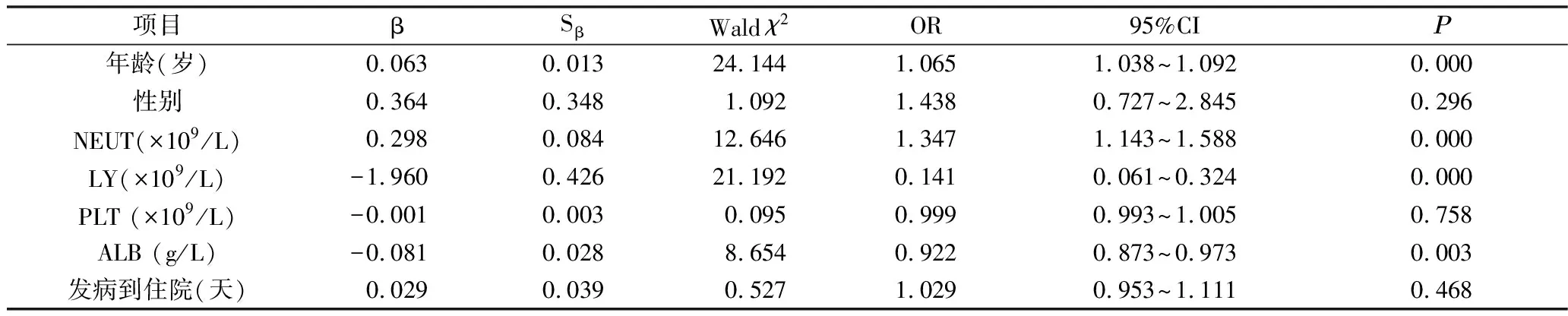
表4 COVID-19早期ARDS患者影响因素的Logistic回归分析参数
3.ROC曲线:针对年龄、NEUT、LY、ALB制作ROC曲线,其曲线下面积分别为0.775、0.665、0.781和0.755(P均>0.5),以上指标对于预测COVID-19患者进展为早期ARDS具有诊断价值,详见表5、图1、图2。

表5 各变量ROC曲线下面积及最佳分割点
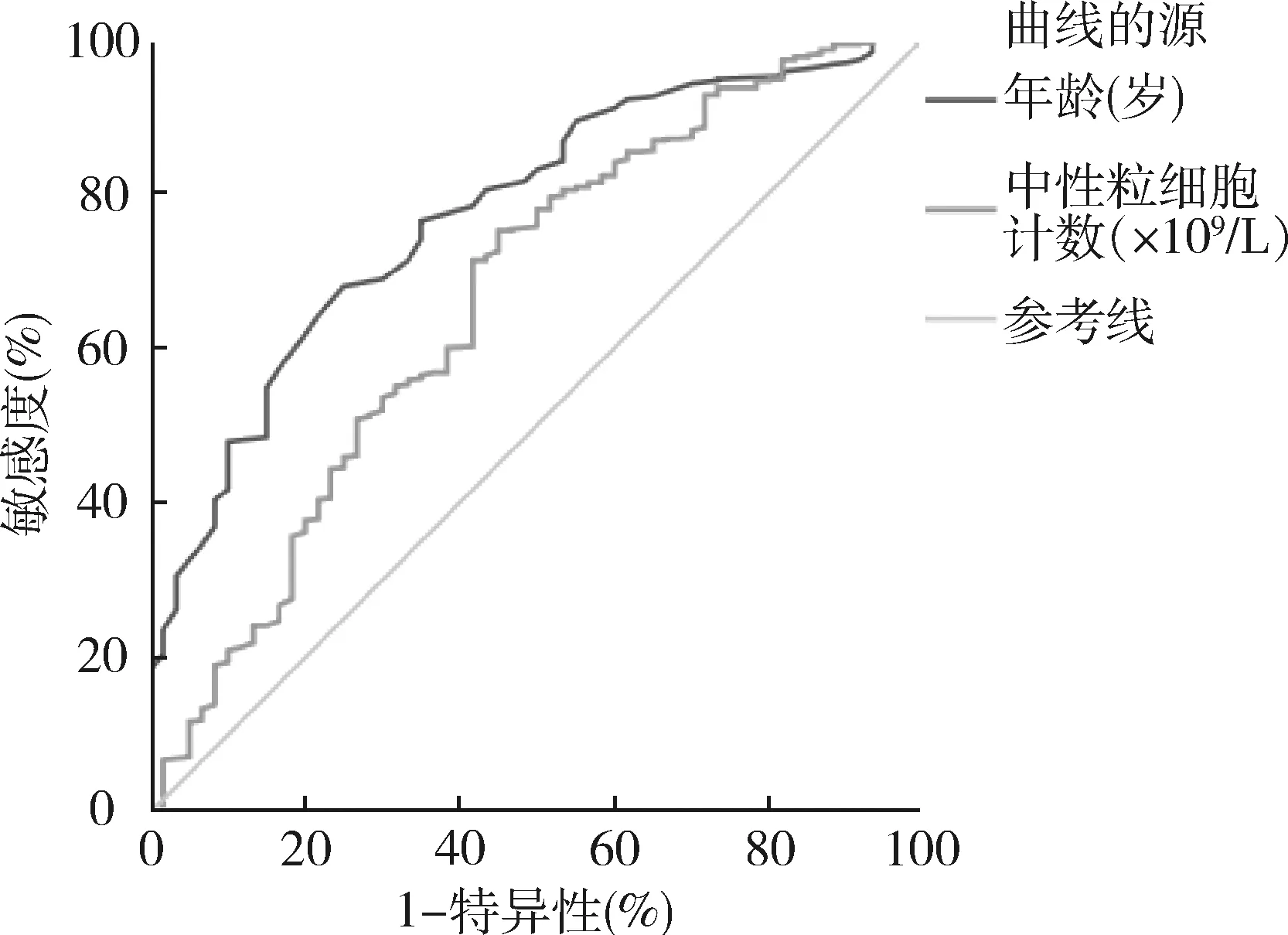
图1 年龄-中性粒细胞计数的ROC曲线

图2 淋巴细胞计数-血清白蛋白浓度的ROC曲线
讨 论
本研究选取患者入院1~3天内的基本临床指标,探讨有ARDS倾向的早期危险因素。重症患者从发病到入院的中位时间为7(3~10)天,与轻症患者的5(3~10)天比较,差异有统计学意义(P=0.011),说明COVID-19患者一经确诊,应尽早进行临床干预,更有利于患者预后。重症组年龄高于轻症组,目前的研究也证实,高龄是COVID-19患者预后不良的潜在危险因素[6]。原因可能是随着年龄增加,机体各器官功能以及免疫能力均有不同程度的下降,肺组织弹性下降、毛细血管数量减少,肺泡扩散有效面积减少,且高龄患者常合并有心脑血管及呼吸系统疾病,增加死亡风险[7]。高NEUT和低LY也是重症患者进展为早期ARDS的危险因素,其中,中性粒细胞参与机体炎性反应,而淋巴细胞具有保护内皮细胞减轻炎性反应的作用,当机体内出现炎性激活因子NEUT水平增高而炎性调节因子LY水平降低时,机体炎性反应增强,严重者会造成肺部炎性损伤,出现ARDS[8]。
COVID-19重症组(氧合指数≤300mmHg)患者约占10.1%,入院6(3~7)天病情进展迅速,发展为ARDS,收集590例患者入院6天内采取的临床干预措施,在糖皮质激素和白蛋白的累积使用天数和剂量上两组比较,差异无统计学意义,说明在患者入院早期补充白蛋白和使用激素对其预后是否进展为ARDS并无影响,过早补充白蛋白和激素对于发病初期预防ARDS是没有意义的。
COVID-19患者的发病机制目前尚未明确,有研究表明,血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)很可能是2019-nCoV感染细胞的介导受体[9~11]。ACE2是机体的负调节因子,能够降低血管紧张素Ⅱ水平,这与另一研究提出的2019-nCoV感染患者血浆样本中血管紧张素Ⅱ水平显著升高结果一致,且该研究认为血管紧张素Ⅱ的水平与病毒载量和肺损伤呈线性相关[12]。正常肺组织中ACE2主要由Ⅰ和Ⅱ肺泡上皮细胞表达,且大多数(约83%)集中表达于Ⅱ型肺泡细胞[13]。因此,2019-nCoV感染会损伤机体大多数Ⅱ型肺泡细胞。
肺泡细胞损伤后,组织释放转化生长因子-β,将促进肺的修复,而病毒感染往往会导致转化生长因子-β通路的过度激活,一旦病情进展到后期,将使肺部正常结构消失,形成弥漫性肺纤维化,最终导致顽固性低氧血症。1例COVID-19死亡患者的病理解剖报告显示,死者肺组织切面可见大量黏稠分泌物从肺泡溢出,并可见大量纤维条索[14]。其他团队的病理解剖也发现下呼吸道内黏液栓的形成和肺泡腔巨噬细胞的聚集活化是COVID-19与以往肺炎的不同之处[15]。
糖皮质激素的主要作用是减轻肺泡渗出,以及降低毛细血管通透性而没有直接抑制病毒复制的作用,根据2019-nCoV感染的发病机制和病理解剖,COVID-19患者肺部病变主要表现为弥漫性肺泡损毁、肺泡间隔纤维组织增生、纤维组织增生所导致的实变,以及深部气道黏液栓的形成。这可能是早期使用激素干预病程进展为ARDS无意义的原因。这也提示笔者研究是否可以针对ACE2进行治疗,以及早期关注黏液栓的形成和影响,合理使用雾化和相应给氧疗法。
虽然糖皮质激素作为COVID-19的辅助治疗是否合理尚无定论,但激素应用于重症病毒性肺炎的治疗比较普遍[16]。一项针对COVID-19的描述性研究发现,将甲泼尼龙1~2mg/(kg·d)应用于严重混合感染的重症患者,可以缩短治疗时间[17]。目前没有针对COVID-19疗效确切的抗病毒药物,合理的使用激素可以帮助重症患者度过呼吸衰竭、炎性渗出期,但对于使用时长和剂量要谨慎把握,避免对机体造成过强的免疫抑制,引起二次感染。
综上所述,高龄、高NEUT、低LY、低ALB对COVID-19患者预后进展为早期ARDS有警示作用,这些指标临床获取方便,检测费用低,且报告时间短,利于尽早判断患者预后;发病初期过早使用糖皮质激素和补充白蛋白对预防ARDS是没有意义的,重症患者激素的使用应该严格把握剂量和使用时长,以减轻不良反应。
