黄芩苷对IL-1β诱导大鼠软骨细胞凋亡和炎症反应的抑制作用及相关机制研究①
2020-12-24杨增华许文胜
常 青 王 伟 杨增华 张 旭 李 红 武 莎 许文胜
(内蒙古科技大学包头医学院第一附属医院,包头 014010)
骨关节炎是中老年人常见的慢性退行性疾病,主要特征有细胞外基质减少、软骨细胞破损及关节滑膜的炎症反应等。遗传、肥胖、关节损伤和关节变形均能诱发关节炎。研究显示,60岁以上的老年人中有10%以上患有关节炎,表现为关节疼痛、行动不便。目前骨关节炎的治疗手段主要有手术治疗和药物治疗,常用的药物有非甾体药物和对乙酰氨基酚,但长期使用会造成消化系统和肾损伤。因此寻找有效且副作用小的骨关节炎治疗药物,研究骨关节炎发生机制具有重要意义。黄芩苷(baicalin,BA)是唇形科植物黄芩干燥根的重要有效成分之一,具有广泛的药理作用和重要的临床应用价值。研究发现BA具有抗菌、抗氧化、解热镇痛、抗炎、免疫调节及抗肿瘤等作用[1,2]。据报道,BA能有效抑制类风湿关节滑膜炎模型大鼠的炎症反应,且对蛋清、角叉菜胶诱发的大鼠足肿胀有抑制作用[3-5]。但BA对关节软骨细胞凋亡和炎症反应的影响以及分子机制均未见报道。本文通过分离培养大鼠软骨细胞,探究BA对白细胞介素1β(interleukin-1β,IL-1β)诱导后软骨细胞凋亡、炎症反应的影响及其潜在作用机制。
1 材料与方法
1.1材料
1.1.1药品 BA(纯度>98%,CAS:21967-41-9)购自百灵威科技公司。
1.1.2试剂 胎牛血清、DMEM培养基购自美国Hyclone公司;细胞计数试剂盒8(cell counting kit-8,CCK-8)购自碧云天生物公司;Annexin-V/PI双染细胞凋亡检测试剂盒购自上海生工;NO检测试剂盒购自北京索莱宝科技有限公司;大鼠IL-6、TNF-α、ELISA试剂盒购自南京森贝伽生物公司;大鼠前列腺素E2(prostaglandin E-2,PEG2) ELISA测定试剂盒购自上海通蔚生物科技公司;兔抗大鼠一抗基质金属蛋白酶1(metalloproteinase-1,MMP-1)、MMP-3、MMP-13、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、环氧合酶2(cyclooxygenase 2,COX-2)、聚蛋白多糖酶5(A disintegrin and metalloprote-inase with thrombospondin motif 5,ADAMTS-5)、磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)、p-AKT、AKT、p-p65、p65均购自美国CST公司;山羊抗兔二抗购自武汉三鹰公司。
1.1.3实验动物 雄性SD大鼠,4~6周龄,体质量180~200 g,购自内蒙古医科大学实验动物中心,许可证号:SCXK(蒙)2015-0001。
1.1.4仪器 酶标仪购自美国Thermo Labsystem公司;全自动酶标仪、流式细胞仪均购自美国BD公司。
1.2方法
1.2.1大鼠软骨细胞的分离与培养 将大鼠脱颈椎处死。经75%酒精浸泡后,置于无菌操作台,取下双侧膝关节。75%酒精浸泡30 s,PBS洗3次,转移至细胞操作台。眼科剪和手术刀除去肌肉和肌腱,剥离关节滑膜,手术刀削下透明软骨,PBS洗2次,剪碎后经0.3%胶原酶消化3 h,过200目细胞筛后离心收集细胞。用含20% FBS的DMEM培养基重悬,于37℃、5%CO2的培养箱中培养,贴壁后更换培养基,细胞融合度达90%时,0.25%胰酶消化后重悬传代。
1.2.2CCK-8检测细胞存活率 取软骨细胞调整细胞密度至3×104个/ml,接种100 μl至96孔板,分为8组,用不同浓度BA处理(0、1、2、5、10、25、50、100 μmol/L),每组设置3个复孔,各组细胞在相应培养基中培养24 h后,酶标仪检测波长450 nm处的吸光度值。选择无明显细胞毒性的2个BA浓度进行后续实验。
1.2.3流式细胞术检测细胞凋亡 根据CCK-8实验结果,将细胞分为Control组、IL-1β组、BA 5 μmol/L组和BA 10 μmol/L组。除Control组外,各组细胞均加入10 ng/ml的IL-1β处理24 h,然后在相应条件下继续培养48 h。胰酶消化,1 500 r/min离心5 min,PBS洗2次。加结合缓冲液,调整细胞密度至1×106个/ml,加入5 μl Annexin-V混匀,室温下避光反应10 min后,加5 μl 碘化丙啶混匀上机检测。
1.2.4ELISA试剂盒检测NO及炎症因子含量 分组和处理方法如1.2.3所述。胰酶消化收集各组细胞,加细胞裂解液冰上裂解,离心并收集上清。在酶标包被板中设置空白组、标准组和待检样品组。取50 μl样品至酶标孔板底部,轻轻摇晃混匀。封膜后置于37℃的环境中温育30 min,甩干,加入洗涤液静置30 s后弃去,重复5次。除空白组外每孔加50 μl酶标试剂,37℃温育30 min,洗5次。加50 μl显色液,混匀后37℃避光反应15 min,加50 μl终止液,450 nm处检测吸光度值。
1.2.5Western blot检测蛋白表达 分组和处理方法如1.2.3所述。胰酶消化收集各组细胞,加含蛋白酶抑制剂的细胞裂解液,冰上裂解后15 000 r/min离心10 min,收集上清。检测上清中蛋白浓度,加蛋白上样缓冲液制作蛋白样品,每孔上样30 μg蛋白。使用12%聚丙烯酰胺凝胶电泳分离蛋白,转膜后使用5%脱脂牛奶室温下封闭1 h;转移至一抗(1∶1 000),4℃孵育12 h,洗膜缓冲液洗3次;转移至二抗液(1∶2 000),室温下孵育1 h后,洗膜缓冲液洗3次,加显影液,于成像系统中曝光。以β-actin为内参,使用软件ImagePro plus6.0分析蛋白条带灰度。
1.3统计学分析 使用统计学软件SPSS18.0分析实验数据。两组间比较采用t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1不同浓度BA对大鼠软骨细胞存活率的影响 不同浓度BA作用于大鼠软骨细胞24 h后,细胞存活率如图1,当BA浓度低于10 μmol/L时,大鼠软骨细胞的存活率变化无统计学意义,经计算,BA对大鼠软骨细胞的半数抑制浓度为73 μmol/L。本文选择无明显细胞毒性的5、10 μmol/L进行后续实验。
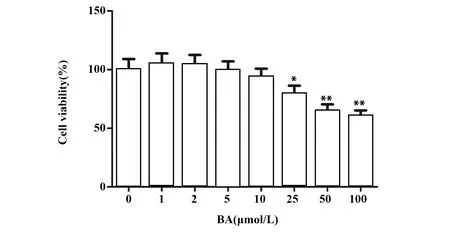
图1 CCK-8检测不同浓度BA对大鼠软骨细胞存活率的影响Fig.1 CCK-8 was used to detect effect of BA at different concentrations on survival rate of chondrocytes in ratsNote:*.P<0.05,**.P<0.01 vs BA.
2.2BA缓解IL-1β诱导的大鼠软骨细胞凋亡 IL-1β诱导24 h后,检测BA处理48 h对大鼠软骨细胞凋亡的影响,结果如图2,与Control组相比,IL-1β作用于大鼠软骨细胞后,细胞凋亡率显著升高(P<0.01);与IL-1β组相比,BA处理组大鼠软骨细胞凋亡率显著降低(P<0.01)。

图2 流式细胞术检测BA对IL-1β诱导的大鼠软骨细胞凋亡的影响Fig.2 Effects of BA on IL-1β-induced chondrocyte apoptosis in rats were detected by flow cytometryNote:**.P<0.01 vs Control group;##.P<0.01 vs IL-1β group.
2.3BA对IL-1β诱导的大鼠软骨细胞中NO和炎症因子含量的影响 IL-1β诱导24 h后,检测BA处理48 h对大鼠软骨细胞NO和炎症因子含量的影响,如图3,与Control组相比,IL-1β作用于大鼠软骨细胞后,细胞中NO、IL-6、PEG2和TNF-α的含量均显著升高(P<0.01);与IL-1β组相比,BA处理组大鼠软骨细胞中NO、IL-6、PEG2和TNF-α的含量均显著降低(P<0.01)。
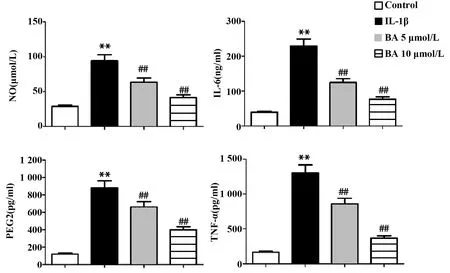
图3 BA对IL-1β诱导的大鼠软骨细胞中NO和炎症因子含量影响Fig.3 Effect of BA on content of NO and inflammatory cytokines in rat chondrocytes induced by IL-1βNote:**.P<0.01 vs Control group;##.P<0.01 vs IL-1β group.
2.4BA对IL-1β诱导的大鼠软骨细胞中基质降解蛋白表达水平的影响 IL-1β诱导24 h后,检测BA处理48 h对大鼠软骨细胞中基质降解蛋白表达水平的影响,如图4,与Control组相比,IL-1β作用于大鼠软骨细胞后,细胞中MMP-1、MMP-3和MMP-13表达水平均显著上升(P<0.01);与IL-1β组相比,BA处理组大鼠软骨细胞中MMP-1、MMP-3和MMP-13表达水平均显著降低(P<0.01)。
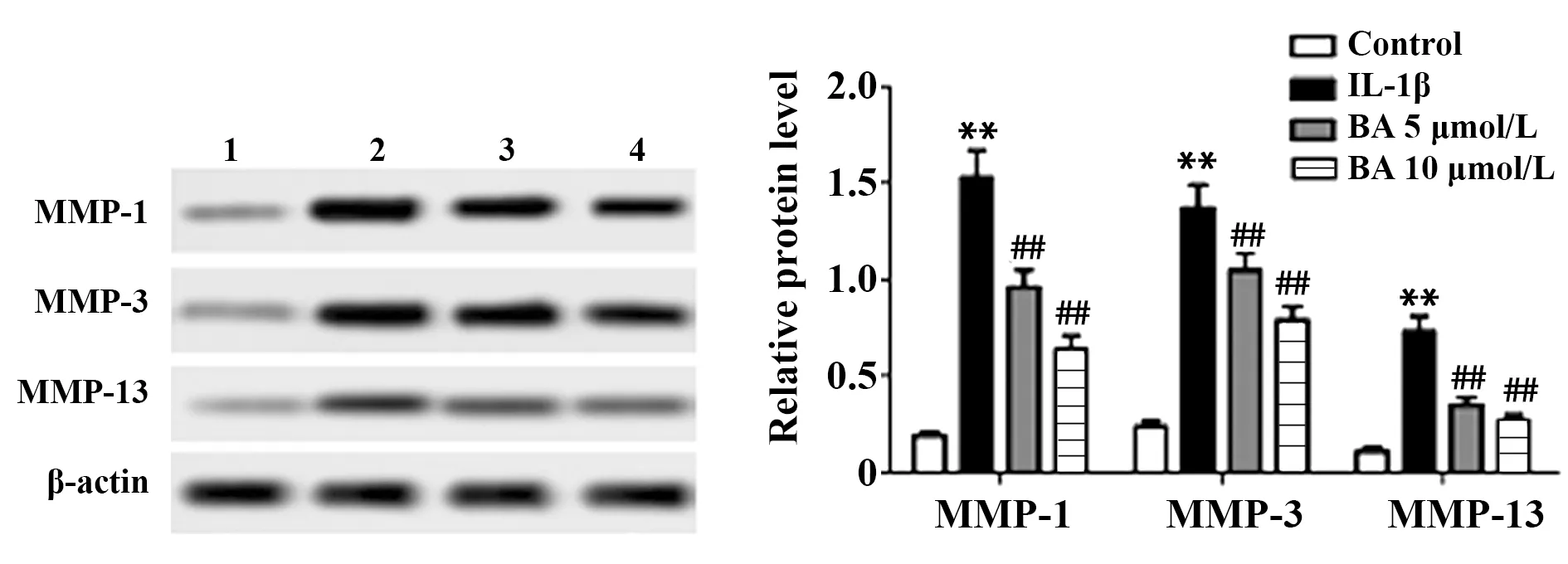
图4 Western blot检测BA对IL-1β诱导的大鼠软骨细胞中基质降解蛋白表达水平的影响Fig.4 Western blot was used to detect effect of BA on expression levels of matrix degradation proteins in rat chondrocytes induced by IL-1βNote:1.Control;2.IL-1β;3.BA 5 μmol/L;4.BA 10 μmol/L.**.P<0.01 vs Control group;##.P<0.01 vs IL-1β group.
2.5BA对IL-1β诱导的大鼠软骨细胞中iNOS、COX-2和ADAMTS-5表达水平的影响 IL-1β诱导24 h后,检测BA处理48 h对大鼠软骨细胞相关蛋白表达水平的影响,如图5,与Control组相比,IL-1β作用于大鼠软骨细胞后,细胞中iNOS、COX-2和ADAMTS-5的表达水平显著升高(P<0.01);而与IL-1β组相比,BA处理组大鼠软骨细胞中iNOS、COX-2和ADAMTS-5表达水平显著降低(P<0.01)。
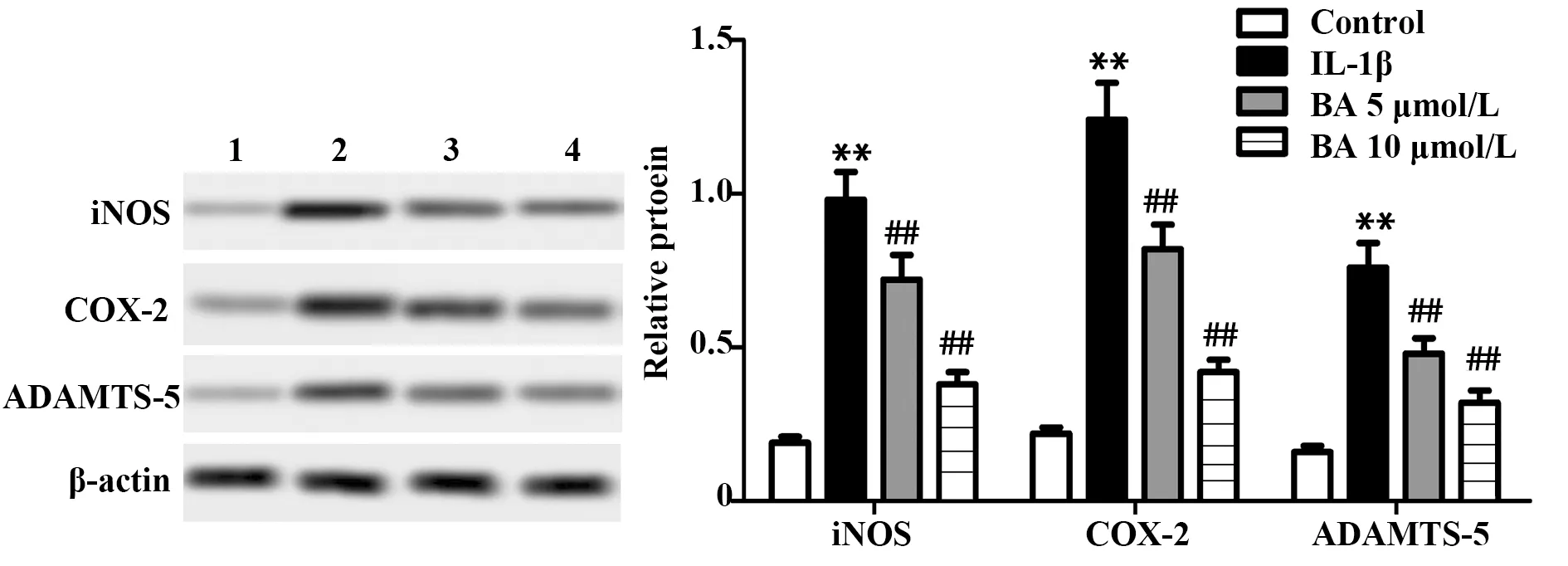
图5 Western blot检测BA对IL-1β诱导的大鼠软骨细胞中iNOS、COX-2和ADAMTS-5表达水平的影响Fig.5 Western blot was used to detect effect of BA on expression levels of iNOS、COX-2 and ADANTS-5 in rat chondrocytes induced by IL-1βNote:1.Control;2.IL-1β;3.BA 5 μmol/L;4.BA 10 μmol/L.**.P<0.01 vs Control group;##.P<0.01 vs IL-1β group.
2.6BA对IL-1β诱导的大鼠软骨细胞中PI3K/AKT通路相关蛋白表达水平的影响 IL-1β诱导24 h后,检测BA处理48 h对大鼠软骨细胞通路相关蛋白表达水平的影响,如图6,与Control组相比,IL-1β作用于大鼠软骨细胞后,细胞中PI3K、p-AKT/AKT和p-p65/p65的表达及比例均显著上升(P<0.01);与IL-1β组相比,BA处理组大鼠软骨细胞中PI3K、p-AKT/AKT和p-p65/p65的表达及比例均显著降低(P<0.01)。

图6 Western blot检测BA对IL-1β诱导的大鼠软骨细胞中PI3K/AKT通路相关蛋白表达水平的影响Fig.6 Effects of BA on expression level of PI3K/AKT pathway related proteins in IL-1β-induced rat chondrocytes were detected by Western blotNote:1.Control;2.IL-1β;3.BA 5 μmol/L;4.BA 10 μmol/L.**.P<0.01 vs Control group;##.P<0.01 vs IL-1β group.
3 讨论
关节软骨主要由软骨基质和少量软骨细胞组成,基质中的主要成分有胶原蛋白、多糖和水。软骨细胞是关节软骨中唯一的细胞成分,与软骨的形成、状态维护和修复过程密切相关。骨关节的退行性改变主要包括软骨细胞凋亡和细胞外基质降解。IL-1β能单独促进一系列炎症因子的分泌,临床研究显示,在骨关节炎患者的滑膜及软骨组织中,IL-1β表达水平均上升[6]。本研究结果显示,当BA的浓度高于10 μmol/L时,对大鼠软骨细胞活性有明显的抑制作用。因此在后续实验中选择浓度为5 μmol/L和10 μmol/L的BA作用于软骨细胞,以排除高浓度BA抑制大鼠软骨细胞活性对实验结果的影响。
软骨细胞凋亡是关节炎的重要病理因素之一,在骨关节炎患者软骨组织中常发现软骨细胞的异常凋亡。本研究结果显示,BA能抑制IL-1β诱导的大鼠软骨细胞凋亡。既往研究发现,BA通过调节NF-κB和热激蛋白72抑制脂多糖诱导的奶牛乳腺细胞的炎症反应和细胞凋亡[7]。此外,细胞中自由氧含量降低可能是软骨细胞凋亡率降低的重要原因。NO是内皮细胞舒张因子,能抑制线粒体呼吸链中的关键酶类,同时能氧化产生OH-和NO2自由基,进而产生细胞毒性,造成组织损伤。本研究结果显示,BA抑制IL-1β诱导的大鼠软骨细胞中iNOS表达,从而降低细胞中NO含量。
在关节炎发病过程中,软骨细胞产生过量炎症因子诱发炎症反应,导致软骨细胞凋亡和关节炎。本研究结果显示,BA抑制IL-1β诱导的大鼠软骨细胞中TNF-α、IL-6和PEG2表达。TNF-α能促进PEG2和MMPs的表达,从而对软骨细胞和细胞外基质造成损伤。IL-6能抑制软骨糖蛋白合成,促进基质降解。大量研究显示,BA具有抗炎作用,如改善咪喹默特诱导的小鼠银屑样炎症,缓解氧化应激和炎症反应诱导的动脉粥样硬化[8,9]。综合实验结果表明,BA抑制了IL-1β诱导的大鼠软骨细胞炎症反应,从而减轻炎症性损伤。
细胞外基质是软骨维持张力、抗压及降低摩擦阻力的关键,其主要由软骨细胞构成。MMP-3和MMP-13能特异性降解细胞外基质的主要成分——2型胶原蛋白和蛋白聚糖。在关节炎软骨组织中,MMPs常过表达,其表达抑制有益于关节炎的治疗。本研究结果显示,BA作用于IL-1β诱导的大鼠软骨细胞后,细胞中MMP-1、MMP-3和MMP-13表达水平显著降低。越来越多的研究表明,ADAMTS家族在骨关节炎患者软骨组织的降解过程中发挥重要作用。ADAMTS-5是降解聚蛋白多糖的关键酶。据文献报道,抑制或敲除ADAMTS-5对关节炎有预防和治疗作用[10,11]。本研究结果显示,BA抑制IL-1β诱导的大鼠软骨细胞中COX-2和ADAMTS-5的表达,进而减少大鼠软骨细胞外基质降解,从而维持关节正常结构。
NF-κB信号通路对炎症性疾病起重要作用,在骨关节炎细胞中,NF-κB p65磷酸化水平升高,AKT下游的NF-κB是调节细胞免疫的关键蛋白,能进一步调控下游TNF-α等炎症细胞因子和MMPs的表达。因此,抑制NF-κB的磷酸化激活,能有效抑制TNF-α、IL-1β等炎症细胞因子产生,从而改善炎症性损伤[12-14]。在对椎间盘的研究中发现,IL-1、IL-4和TNF-β的表达有助于基质降解、炎症发生及其神经传递,在椎间盘细胞凋亡中也发挥重要作用[15]。此外,抑制PI3K/AKT/NF-κB通路被认为是关节炎的治疗方法之一[16]。本实验结果显示,BA作用于IL-1β诱导的大鼠软骨细胞后,细胞中PI3K、p-AKT和p-p65的表达水平显著降低。Wang等[17]研究显示,远志皂苷通过抑制PI3K/AKT/NF-κB通路抑制IL-1β诱导的人软骨细胞炎症反应。
综上所述,本文通过IL-1β诱导大鼠软骨细胞模拟骨关节炎软骨细胞的炎症环境,结果显示BA抑制IL-1β诱导的大鼠软骨细胞凋亡和炎症反应,其作用机制可能与抑制PI3K/AKT/NF-κB通路磷酸化激活有关。本研究为BA的临床使用提供理论基础,但其在动物实验水平能否产生相应作用仍需深入研究。
