LncRNATUG1在甲状腺癌组织中的表达及其对细胞增殖和迁移的影响
2020-12-24赵芳芳汉中市人民医院内分泌科陕西汉中723000
赵芳芳,郭 红,陈 嘉(汉中市人民医院内分泌科,陕西汉中 723000)
甲状腺癌(thyroid carcinoma,TC)是来源于甲状腺上皮细胞的恶性肿瘤,约占全身恶性肿瘤的1%,其发病呈年轻化趋势,女性多发于男性[1]。临床上对TC 患者的治疗有肿瘤切除、药物靶向治疗、化疗放疗等手段,但治疗过程中仍然存在预后差等问题[2],对患者的健康和生活质量产生严重影响。因此,进一步了解和揭示TC 的发生发展机制,找寻更多特异性分子标志物及治疗靶点,对临床诊治意义重大。长链非编码RNA(long non-coding RNA,LncRNA)是一段长度大于200 个核苷酸的RNA 序列,已被证实是癌症发生发展的关键调节因子[3-4]。牛磺酸上调基因1(taurine upregulated gene 1,TUG1) 是位于染色体22q12的一种LncRNA[5],据报道LncRNA TUG1 已在多种癌症中表达上调,与癌症发生发展、细胞耐药及预后密切相关,如LncRNA TUG1 通过EZH2 调控LIMK2b 参与小细胞肺癌的细胞生长和化疗耐药性[6];Meta 分析显示,lncRNA TUG1 升高是肿瘤患者不良总生存期(overall survival,OS)的独立预后标志物[7];lncRNA TUG1 通过WNT/ catenin 通路促进上皮性卵巢癌细胞增殖和侵袭[8]。然而LncRNA TUG1 在TC 中的功能机制目前仍不清楚,因此,本研究探究了LncRNA TUG1 在TC 组织及细胞中的表达及其对细胞增殖、迁移、侵袭的作用,并初步探索其调控TC 发生发展的作用机制,为TC 的分子靶向治疗提供理论基础。
1 材料与方法
1.1 研究对象 收集2015年1月~2018年6月于我院进行肿瘤切除手术治疗并经病例确诊的36 例TC 组织标本(未分化癌5 例,滤泡状癌25 例,乳头状癌6 例)及其相对应正常的癌旁甲状腺组织。从ATCC 公司购买人TC 细胞株SW1736 和FTC-133 以及人正常甲状腺上皮细胞Nthy-ori 3-1,含10ml/dl 胎牛血清的Dulbecco 改良Eagle 培养基(DMEM)中培养。
1.2 试剂和仪器 酶联免疫检测仪购自美国 BioTek公司。PCR 扩增仪购自美国Thermo Fisher Scientific公司。Lipofectamine 2000 试剂盒及Trizol 试剂购自美国Invitrogen 公司。PrimeScript RT Reagent Kit 试剂盒及SYBR Prime Script RT-PCR Kit 试剂盒购自日本Takara 公司。DMEM 培养基购自美国 HyClone公司。6 孔板、96 孔板及Transwell 小室购自美国Corning 公司。E-cadherin 抗体、N-cadherin 抗体和GAPDH 抗体购自美国Abcam 公司。
1.3 方法
1.3.1 实时定量逆转录聚合酶链反应(qRTPCR):用Trizol 试剂提取组织和细胞的总RNA。使用PrimeScript RT Reagent Kit 根据说明书进行逆 转 录。 使 用SYBR Prime Script RT-PCR Kit 进行qRT-PCR。引物如下,LncRNA TUG1 正向:5’-CTATACTCAGCTTCAGTGTT-3’,反向:5’-TA CTGTATGGCCACCACTCC-3’;GAPDH 正向:5’-GAAGGCTGGGGCTCATTTGCAGGG-3’, 反 向:5’-GGTGCAGGAGGCATTGCTGATGAT-3’。对纯 化的RNA 进行qRT-PCR 分析,并用GAPDH 内参进行校正。
1.3.2 LncRNA TUG1 低表达细胞系模型构建:将shRNA 插入慢病毒质粒中构建LncRNA TUG1 低表达质粒(LV-shTUG1),以插入无意义序列的慢病毒载体(negative control)作为对照。使用LipofectamineTM2000 试剂盒(Invitrogen)按照说明书步骤将低表达质粒及对照质粒转染至细胞SW1736和FTC133 中。
1.3.3 MTT 实验和集落形成实验检测细胞增殖:MTT 法:将细胞接种于96 孔板培养24 h,利用pcDNA3.1 转染细胞,转染后0,24,48,72 和96 h,向每孔加入20 μl MTT 溶液,室温孵育4 h,除去培养基,每孔加入100 μl DMSO,于560 nm处测量吸光度(A)。集落形成实验:将细胞以500 个/孔浓度接种于6 孔板,在含10 ml/dl 胎牛血清的DMEM 中37 ℃温育两周,后固定细胞,0.1 g/dl 结晶紫染色,计数可见菌落数。
1.3.4 Transwell 试验检测细胞迁移:将含有5×104个细胞的细胞悬液置于Transwell 小室的上室,含10 ml/dl 胎牛血清的培养基加入Transwell 小室的下室,温育48 h,擦去残留在上膜中的细胞,用甲醇固定迁移过膜的细胞,下层细胞用0.1 g/dl 结晶紫染色并在显微镜下计数。
1.3.5 Western blot 检测EMT 相关蛋白表达:取转染后细胞,使用RIPA 裂解缓冲液提取细胞总蛋白,BCA 法测定蛋白浓度,将提取蛋白与上样缓冲液混合,于10 g/dl SDS-PAGE 电泳,转移至PVDF 膜,5 g/dl BSA 室温封闭2 h,加入E-cadherin(1∶2000),N-cadherin(1∶2 000)一抗,室温孵育4 h,TBST洗膜3 次;加入二抗,室温孵育2 h,TBST 洗膜3 次,每次15 min,使用增强的化学发光检测试剂盒检测信号,使用Tanon 5200 化学发光成像系统进行分析。
1.4 统计学分析 使用SPSS 20.0 软件进行统计学分析,LncRNA TUG1 在甲状腺癌组织及癌旁组织中的表达差异应用配对样本t 检验;各细胞组间差异比较采用独立样本t 检验进行分析,P <0.05 为差异具有统计学意义。
2 结果
2.1 LncRNA TUG1 在TC 组织及细胞中高表达 见图1。采用qRT-PCR 法检测显示,与癌旁正常组织相比,癌组织中LncRNA TUG1 表达(1.51±1.02 vs 6.90±1.19)显著升高,差异有统计学意义(t=20.634,P <0.000);与正常甲状腺上皮Nthy-ori 3-1 细胞相比,FTC-133 细胞(1.00±0.09 vs 4.61±0.15)和SW1736 细胞(1.00±0.09 vs 2.59±0.23)中LncRNA TUG1 水平明显升高,差异有统计学意义(t=35.744,P <0.000;t=11.150,P <0.000)。
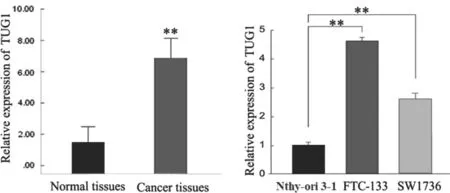
图1 qRT-PCR 法检测TC 组织及细胞中LncRNA TUG1 的表达水平(**P<0.01)
2.2 敲降 LncRNA TUG1 表达抑制TC 细胞的增殖 见图2,图3。MTT 和集落形成实验检测显示,与对照组相比,敲降LncRNA TUG1 表达后SW1736 细胞(1.31±0.19 vs 0.89±0.16)和FTC-133 细胞(2.17±0.09 vs 1.68±0.05)增殖能力明显降低,克隆形成数目明显减少,差异有统计学意义(t=2.929,P=0.021;t=8.243,P=0.001)。

图3 集落形成实验检测敲降LncRNA TUG1 表达对TC 细胞克隆形成能力的影响
2.3 敲降 LncRNA TUG1 表达抑制TC 细胞的迁移 见图4。以FTC-133 细胞为例,Transwell 实验检测显示,与对照组相比,敲降LncRNA TUG1表达后,FTC-133 细胞迁移能力(1 675.2±64.2 vs 898.1±156.4)显著降低,差异有统计学意义 (t=7.961,P=0.001)。

图4 敲降LncRNA TUG1 表达对FTC-133 细胞迁移的影响(*P<0.05)
2.4 敲降LncRNA TUG1 表达抑制TC 细胞EMT 的形成 见图5。采用Western blot 检测EMT 相关蛋白E-cadherin 和N-cadherin 的表达情况,结果显示:与对照组相比,敲降 LncRNA TUG1 表达后E-cadherin 表达量(0.74±0.06 vs 1.66±0.17)显著升高,N-cadherin 表达量(1.27±0.18 vs 0.39±0. 07)显著降低,差异有统计学意义(t=8.839,P <0.000;t=7.892,P=0.001)。提示LncRNA TUG1 促进TC细胞EMT 形成。

图5 LncRNA TUG1 调节EMT 相关蛋白的表达(**P<0.01)
3 讨论
TC 是由机体碘缺乏、辐射、遗传等因素引起的最常见的恶性肿瘤之一,近年发病率呈逐年上升趋势[1],但其具体的发病机制目前尚不清楚。LncRNA 通过多种途径调控基因表达及相关信号通路,进而调控肿瘤细胞的生物学行为,参与癌症的发生发展,被认为是多种癌症的关键调节因子[9]。深入研究LncRNA 与TC 发生发展间的关系,可以为TC 的分子诊断、靶向治疗及预测预后提供一定借鉴。
LncRNA 在表观遗传、转录和转录后水平上参与基因表达的调控[10],被广泛报道通过多种机制调节病理生理过程,如基因印记,组蛋白修饰,染色质重塑,转录激活[11]等。并发现LncRNA 可通过与微小RNA(miRNA)竞争性结合并因此抑制其功能(即阻断与靶mRNA 的相互作用)[11]。大量研究发现,LncRNAs 在众多不同疾病类型中均差异表达,通过多种途径参与调控肿瘤细胞增殖、侵袭及迁移等恶性生物学行为,诱导癌症的恶性进展,表现为原癌基因或抑癌基因发挥作用[12-16]。LncRNA TUG1 最初被鉴定为是由牛磺酸上调的转录物,在许多癌症中已经报道了LncRNA TUG1 的异常表达,发现TUG1 可通过招募某些RNA 结合蛋白,进而促进靶基因表达,影响肿瘤血管生成或充当竞争性内源性RNA(ceRNA)调控肿瘤的发生发展[5]。CAO 等[17]研究发现,LncRNA TUG1 是骨肉瘤患者存活的预后因素。LncRNA TUG1 高表达与膀胱癌和食管鳞癌细胞的增殖和转移有关[18-19]。NIU 等[6]研究发现,LncRNA TUG1 通 过EZH2调控LIMK2b 参与小细胞肺癌的细胞生长和化疗耐药性。LI 等[20]发现, LncRNA TUG1 通过与PRC2结合调节胃癌细胞增殖。WANG 等[21]研究发现,LncRNA TUG1 通过EMT 途径促进结肠直肠癌的转移。由此可见,LncRNA TUG1 在调节多种转录因子和生理过程中具有重要意义,提示TUG1 有望成为众多肿瘤诊断及预后的生物标志物或治疗新靶点。因此,研究LncRNA TUG1 在TC 中发挥的功能及其分子机制对寻找新的治疗靶点至关重要。
本研究应用qRT-PCR 检测发现TC 组织及细胞中LncRNA TUG1 表达水平较癌旁正常组织及正常甲状腺上皮细胞明显升高(P<0.05),提示LncRNA TUG1 与TC 的发生发展密切相关。将shRNA 插入慢病毒质粒构建LncRNA TUG1 低表达细胞系,采用MTT 法、集落形成实验、Transwell实验于细胞水平检测发现敲降LncRNA TUG1 表达明显抑制TC 细胞的增殖及迁移能力(P<0.05),提示TC 中LncRNA TUG1 扮演促癌基因。EMT 是上皮细胞获得迁移能力的有效方式,也是TC 细胞浸润转移的重要形式,因此本研究通过蛋白印迹探究了LncRNA TUG1 表达对TC 细胞EMT 形成的影响,发现敲降LncRNA TUG1 表达抑制了EMT 形成。表明LncRNA TUG1 在TC 中高表达,促进细胞的增殖及迁移,可能通过促进EMT 的形成进而发挥作用。本研究初步证明了LncRNA TUG1 通过调控EMT 形成参与TC 的发生发展,然而肿瘤的形成是一个复杂的调控过程,TUG1 调控肿瘤发生发展的方式多样,必定涉及多种基因或因子的相互调节及信号转导通路,其调控TC 恶性发展进程的分子机制还需进一步深入探究分析阐明。此外,包含TUG1 在内的多个LncRNA 近年被研究报道能够调控肿瘤能量代谢影响肿瘤恶性行为,其中LIN 等[22]在Hepatoligy 上报道TUG1 可调控肝癌细胞的糖酵解能力,影响癌细胞增殖、迁移。HAN 等[23]研究指出, LncRNA TUG1 通过调节糖酵解作用影响骨肉瘤细胞的存活率。徐苏娟等[24]通过Seahorse能量分析仪对卵巢癌OVCAR3 细胞糖酵解压力及线粒体压力变化,显示干扰TUG1 表达能显著降低癌细胞的线粒体呼吸和糖酵解通量,指出卵巢癌细胞的增殖及迁移可能与TUG1 调控肿瘤能量代谢有关。目前,糖酵解作为肿瘤能量来源已被广泛接受,且主流观点认为肿瘤细胞即使在足氧条件下,仍可通过糖酵解方式消耗大量葡萄糖以给肿瘤细胞供能,即瓦氏效应(Warburg effect)[25-26]。而TC 中LncRNA TUG1 是否也可通过调控能量代谢进而影响TC 的生物学行为本研究尚未触及,是本研究的不足和缺陷,但可将其作为后期研究的一个新的探究方向。
综上所述,LncRNA TUG1 在TC 中过表达,可能通过促进EMT 的形成进而促进癌细胞的增殖及迁移,可作为一种新的潜在癌基因,靶向抑制LncRNA TUG1 的表达可能是TC 治疗的一种新方法,对临床诊治及预测预后具有重要潜在价值。
