温度/pH响应性MPEG-b-PCL/PNVCL-b-PCL共聚物复合胶束的制备及载药性质
2020-12-23王绍森辛宇豪吴秋华张国林
张 萌,王绍森,辛宇豪,刘 学,吴秋华,张国林
(辽宁大学化学院,沈阳110036)
具有核-壳结构的聚合物胶束可以提高药物的溶解度、延长药物的循环时间,在药物控制释放领域具有广阔的应用前景[1~3].但这种胶束易受溶剂、温度、pH值和离子强度等环境因素的影响,结构遭到破坏,降低药物传递的有效性并限制其应用.因此,研究和开发具有更高灵敏性和稳定性的新型胶束越来越受到人们的关注[4~6].
基于氢键的超分子共聚物胶束不仅具有常规共聚物胶束的性质,而且其骨架中的氢键对外部刺激更敏感[7,8],具有快速响应和可控释放性质,赋予胶束更丰富的性质,为药物传递系统的构建提供了新途径[9~11].但氢键本身不稳定,使该类胶束的应用具有一定的局限性.共聚物复合胶束(CMs)是将具有不同性质或响应性(如温度及pH等)的ABC三嵌段共聚物或两个二嵌段共聚物AB和BC或AB和CD引入同一胶束中,使其具有复合的“核”或“壳”结构[12].与三嵌段共聚物相比,由两种不同二嵌段共聚物形成的共聚物复合胶束不仅结构可由两种嵌段共聚物的相对含量来控制,而且构成外壳的聚合物链段在不同条件下分别形成胶束的冠和通道,能更好地满足药物的控制释放[13~15].共聚物复合胶束虽然能够避免普通核-壳结构胶束因环境条件变化导致的解缔合,但在响应灵敏性方面存在一定的不足.我们[16]制备了以聚己内酯(PCL)为疏水核、亲水性聚乙二醇单甲醚(MPEG)和温敏性聚N-乙烯基己内酰胺(PNVCL)为混合壳、基于三重氢键的超分子共聚物复合胶束,研究了胶束在不同条件下的响应性和载药性能,对提高共聚物复合胶束的灵敏性具有一定作用.但基于氢键作用的自组装在制备和运输过程中存在一定的不稳定性,导致药物包封和传递效率降低.亚胺键是酸敏感化学键,在中性环境(pH=7.4)中比氢键更稳定,但在弱酸性环境(pH=5.0)中发生断裂[17~19].如果以亚胺键连接的嵌段共聚物为共聚物复合胶束的构筑单元,体系的灵敏度保持不变,稳定性会显著提高.
聚乙二醇单甲醚是一种具有良好生物相容性的聚合物,能赋予材料柔性、亲水性和抗巨噬细胞吞噬等功能,已广泛应用于生物材料等领域[20,21].聚N-乙烯基己内酰胺是一种温敏性聚合物,其低临界溶解温度(LCST)接近人体生理温度,由于PNVCL的酰胺基团直接连接在疏水性碳-碳主链上,因此水解后不会产生酰胺化合物,具有生物降解性和生物相容性[22~24].聚己内酯是由ε-己内酯开环聚合得到的疏水性高分子,具有生物降解性、生物相容性和良好的热稳定性,在生物医用材料等方面得到广泛应用[25~27].本文合成了基于亚胺键的聚乙二醇单甲醚-b-聚己内酯(MPEG-b-PCL)和聚N-乙烯基己内酰胺-b-聚己内酯(PNVCL-b-PCL)嵌段共聚物,并以其为构筑单元,制备了以PCL为核、MPEG和PNVCL为壳的共聚物复合胶束,并以对其性质进行了研究.PNVCL具有温度响应性,室温下其链段伸展,当进入血液和正常组织时,温度高于其LCST后会发生相变而塌缩在PCL核的表面,而亲水性MPEG仍然保持伸展状态,形成带有通道的核-壳-冠结构,避免因血液稀释作用导致胶束解体,阻止药物扩散释放.当复合胶束到达弱酸性肿瘤环境时,嵌段共聚物间的亚胺键断裂,胶束解体释放药物.通过改变两种嵌段共聚物的比例,可以方便地调节药物释放速率.以基于亚胺键的嵌段共聚物为构筑单元的温度/pH响应性共聚物复合胶束在药物控制释放领域有潜在的应用前景.
1 实验部分
1.1 试剂与仪器
ε-己内酯(ε-CL,分析纯)购自Alfa Aesar公司;偶氮二异丁腈(AIBN,化学纯,重结晶)购自上海四赫维化工有限公司;N,N′-二环己基碳酰亚胺(DCC,分析纯)和对二甲氨基吡啶(DMAP,分析纯)购自国药集团化学试剂有限公司;辛酸亚锡[Sn(Oct)2,分析纯]、对甲酰苯甲酸(p-CBA,分析纯)、N-(叔丁氧羰基)乙醇胺(Boc-NHCH2CH2OH,98%)、三氟乙酸(TFA,99%)、三乙胺(TEA,99%)、聚乙二醇单甲醚(MPEG,Mn=5000,分析纯)和N-乙烯基己内酰胺(NVCL,分析纯,重结晶)购自美国Sigma-Aldrich公司;巯基乙醇(HSCH2CH2OH,分析纯)购自美国Amresco公司;BGC-823细胞株购自上海盖宁生物科技有限公司;RPMI-1640培养基、胎牛血清(FBS)和青链霉素混合液购自美国Gibico公司;噻唑蓝(MTT,98%)购自北京鼎国昌盛生物技术有限公司;4′,6-二脒基-2-苯基吲哚(DAPI)和盐酸阿霉素(DOX·HCl,98%)购自北京伊诺凯试剂有限公司;透析袋(截留分子量8000)购自上海宝曼生物技术有限公司;其它试剂为分析纯,购自国药集团化学试剂有限公司.
Varian Mercury 300型核磁共振波谱仪(NMR,美国Varian公司),以CDCl3作溶剂,四甲基硅烷(TMS)为内标;Waters 1515型凝胶渗透色谱仪(GPC,美国Waters公司),以聚苯乙烯为标样,四氢呋喃(THF)作流动相,流速1.0 mL/min,测试温度30℃;JEM 2100型透射电子显微镜(TEM,日本电子株式会社);Malvern Nano ZS型纳米粒度及Zeta电位分析仪(英国Malvern公司);TU-1900型紫外-可见(UVVis)分光光度计(北京普析通用仪器有限责任公司);Nikon Ts2-FL型荧光倒置显微镜(日本Nikon公司);Tecan Infinite M1000 PRO型酶标仪(瑞士Tecan公司).
1.2 嵌段共聚物的合成
1.2.1 端醛基聚乙二醇单甲醚(MPEG-CHO)的合成参照文献[28]方法进行制备.将10 g(2 mmol)MPEG加入250 mL反应瓶中,用100 mL二氯甲烷溶解,然后将3 g(20 mmol)p-CBA、4.1 g(20 mmol)DCC和0.24 g(2 mmol)DMAP加入上述溶液中,磁力搅拌下于25℃反应24 h;过滤反应混合液,旋转蒸发浓缩滤液,将得到的固体用80 mL异丙醇溶解,于4℃放置12 h;过滤,所得固体分别用异丙醇和乙醚洗涤后,于25℃真空干燥24 h,得到白色固体,产率78%.
1.2.2 端醛基聚N-乙烯基己内酰胺(PNVCL-CHO)的合成将5.0 g(36 mmol)NVCL、0.081 g(0.495 mmol)AIBN和50 mL 1,4-二氧六环加入250 mL反应瓶中,搅拌溶解,充氮气30 min;将0.078 g(1.0 mmol)HSCH2CH2OH和5 mL 1,4-二氧六环的混合溶液加入上述反应液中,磁力搅拌下于68℃反应24 h;对反应混合液减压蒸馏以除去1,4-二氧六环,得到固体粗产物;将固体粗产物溶于20 mL二氯甲烷中,然后缓慢滴加到200 mL乙醚中得到白色沉淀,过滤;重复二氯甲烷溶解-乙醚沉淀-过滤操作3次后,将沉淀于25℃真空干燥24 h,得到白色固体端羟基聚N-乙烯基己内酰胺(PNVCL-OH),产率70%.
将2.05 g(0.4 mmol)PNVCL-OH置于250 mL反应瓶中,用50 mL二氯甲烷溶解;将0.6 g(4.0 mmol)p-CBA、0.82 g(4.0 mmol)DCC和0.12 g(1.0 mmol)DMAP加入上述溶液中,磁力搅拌下于25℃反应24 h;过滤反应混合液,将滤液滴入300 mL乙醚中沉淀,过滤;重复二氯甲烷溶解-乙醚沉淀-过滤操作3次后,将沉淀于25℃真空干燥24 h,得到白色固体PNVCL-CHO,产率68%.
1.2.3 端氨基聚己内酯(H2N-PCL)的合成参照文献[29]方法制备H2N-PCL.将0.48 g(0.48 mmol)Sn(Oct)2、6.8 g(60 mmol)ε-CL、0.24 g(1.5 mmol)Boc-NHCH2CH2OH和18 mL甲苯加入反应瓶中,搅拌均匀后用液氮冷冻、抽真空、通氮气循环操作3次后,于110℃反应12 h;反应结束后,将反应混合液滴入300 mL乙醚中得到白色沉淀;过滤,将所得固体真空干燥得端N-(叔丁氧羰基)氨基聚己内酯(BocNH-PCL);将BocNH-PCL在二氯甲烷/三氟乙酸(体积比1∶1)混合溶剂中室温搅拌12 h,然后将其滴入300 mL乙醚中得到沉淀,过滤,得到H2N-PCL固体;将上述固体在二氯甲烷/三乙胺(体积比为1∶1)混合溶剂中室温搅拌12 h,将反应混合液滴入300 mL乙醚中得到H2N-PCL沉淀,过滤、洗涤后于25℃真空干燥24 h,得到白色固体H2N-PCL,产率70%.
1.2.4 聚乙二醇单甲醚-b-聚己内酯(MPEG-b-PCL)嵌段共聚物的合成将2.57 g MPEG-CHO和2.48 g H2N-PCL溶于20 mL四氢呋喃中,磁力搅拌5 min,将所得混合液滴入300 mL乙醚中得到沉淀;重复四氢呋喃溶解-乙醚沉淀-过滤操作3次后,于25℃真空干燥24 h,得到白色固体MPEG-b-PCL,产率74%.
1.2.5 聚N-乙烯基己内酰胺-b-聚己内酯(PNVCL-b-PCL)嵌段共聚物的合成将2.20 g PNVCL-CHO和2.48 g H2N-PCL溶于20 mL四氢呋喃中,磁力搅拌5 min;将所得混合液滴入300 mL乙醚中得到沉淀;重复四氢呋喃溶解-乙醚沉淀-过滤操作3次后,于25℃真空干燥24 h,得到白色固体PNVCL-b-PCL,产率65%.聚合物合成路线如图S1(见本文支持信息)所示.
1.3 胶束的制备
将一定量MPEG-b-PCL、PNVCL-b-PCL(二者摩尔比分别为4∶6,5∶5,6∶4)和DOX·HCl溶解在N,N二甲基甲酰胺(DMF)中配制成1.0 mg/mL的聚合物溶液;在搅拌条件下,将上述聚合物溶液滴加到超纯水中,直至水溶液由无色透明变为泛着淡蓝光的乳白色溶液.将所得溶液透析除去DMF和未被负载的药物,得到载药共聚物复合胶束[CMs-DOX(4∶6,5∶5,6∶4)].采用同样方法制备空白CMs(4∶6,5∶5,6∶4).利用紫外-可见分光光度计测定DOX在485 nm处的吸光度,通过标准工作曲线得到DOX的浓度,利用下式计算胶束的载药量(DLC,%)和载药率(DLE,%):
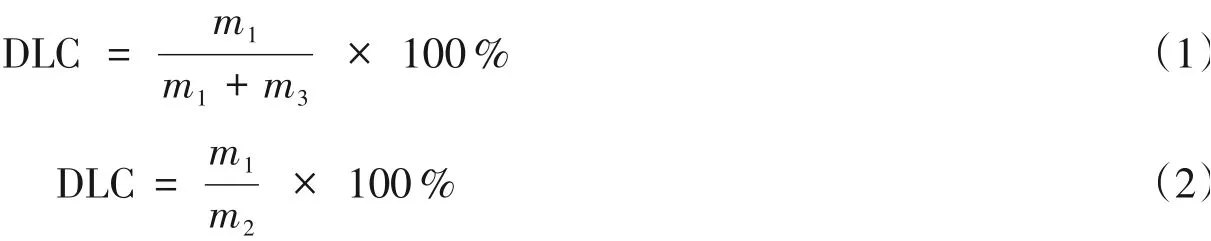
式中,m1(mg)为胶束中包载DOX的质量,m2(mg)为加入的DOX的质量,m3(mg)为共聚物载体的质量.
1.4 药物体外释放实验
药物体外释放实验分别在不同pH值的醋酸缓冲溶液(pH=5.0,0.05 mol/L)和磷酸缓冲溶液(PBS,pH=7.4,0.05 mol/L)中进行:将6 mL负载药物的胶束置于透析袋中,搅拌下置于不同温度的14 mL相应的缓冲溶液中,每隔一段时间取出4 mL溶液,然后向瓶中补充4 mL新的缓冲溶液,保证体系外溶液的体积恒定;利用紫外-可见分光光度计测定DOX在波长485 nm处的吸光度,通过标准工作曲线得到DOX的浓度,药物释放率(Er,%)按下式计算:

式中,Ve(mL)为补充的缓冲溶液体积,V0(mL)为缓冲溶液总体积,Ci(μg/mL)为第i次更换溶液的DOX浓度,Cn(μg/mL)为最后一次更换溶液DOX的浓度,mDOX(μg)为胶束中DOX的总质量.
1.5 细胞毒性实验
采用MTT方法评价细胞毒性.将所有样品用RPMI-1640培养基稀释成预设的浓度.在100μL RPMI-1640培养基中,将BGC-823细胞接种于96孔板后孵化24 h,保持每个孔板大约有1×105个细胞;用100 mL样品溶液代替原来的培养基,继续培养细胞48 h;向每个孔板中加入20μL 5.0 mg/mL MTT溶液,孵化4 h后移除MTT;将120μL二甲基亚砜(DMSO)加入培养基中溶解甲瓒晶体,轻轻摇动样品板10 min,利用酶标仪在492 nm下测定溶液的吸光度.
1.6 体外细胞内吞实验
在500μL RPMI-1640培养基中,将BGC-823细胞接种于12孔板中,保持每个孔板大约有1×105个细胞;孵化24 h后,将每个样品板的培养基用500μL含有CMs-DOX(5∶5)(10μg/mL)的新鲜培养基取代,分别孵化4,6和12 h;达到预定时间后除去培养基,将细胞核用DAPI染色,用500μL PBS缓冲溶液清洗3次,在荧光倒置显微镜下观察.
2 结果与讨论
2.1 MPEG-b-PCL嵌段共聚物的合成
图S2(见本文支持信息)给出MPEG-CHO的1H NMR谱图.δ3.37处的吸收峰为MPEG链段中甲基(—CH3)质子的化学位移,δ3.65处的吸收峰为MPEG链段中亚甲基(—O—CH2—CH2—)质子的化学位移,δ7.94和δ8.20处的吸收峰为苯环上质子的化学位移,δ10.10处的吸收峰为端醛基(—CHO)质子的化学位移,表明端羟基已经转化成端醛基.
图S3(见本文支持信息)是BocNH-PCL的1H NMR谱图.δ1.26处的吸收峰为叔丁氧羰基中甲基(—CH3)质子的化学位移,δ1.37处的吸收峰为PCL链段中亚甲基(—CO—CH2—CH2—CH2—)质子的化学位移,δ1.66处的吸收峰为PCL链段中亚甲基(—CH2—CH2—CH2—CH2—OH)质子的化学位移,δ2.32处的吸收峰为PCL链段中亚甲基(—CO—CH2—CH2—CH2—)质子的化学位移,δ3.48处的吸收峰为亚甲基(—NH—CH2—CH2—)质子的化学位移,δ3.65处的吸收峰为PCL链段中亚甲基(—CH2—OH)质子的化学位移,δ4.05处的吸收峰为PCL链段中亚甲基(—CH2—CH2—O—)质子的化学位移,δ4.13处的吸收峰为亚甲基(—NH—CH2—CH2—)质子的化学位移.图S4(见本文支持信息)是H2N-PCL的1H NMR谱图.δ1.37处的吸收峰为PCL链段中亚甲基(—CO—CH2—CH2—CH2—)质子的化学位移,δ1.66处的吸收峰为PCL链段中亚甲基(—CH2—CH2—CH2—CH2—OH)质子的化学位移,δ2.32处的吸收峰为PCL链段中亚甲基(—CO—CH2—)质子的化学位移,δ3.14处的吸收峰为亚甲基(H2N—CH2—CH2—O—)质子的化学位移,δ3.65处的吸收峰为PCL链段中亚甲基(—CH—OH)质子的化学位移,δ4.05处的吸收峰为PCL链段中亚甲基(—CH2—CH2—O—)质子的化学位移,δ4.32处的吸收峰为亚甲基(H2N—CH2—CH2—O—)质子的化学位移.图S5(见本文支持信息)是H2N-PCL的GPC谱图,可以看出其为单峰,表明产物里没有其它物质.综合1H NMR和GPC结果,证明得到了H2N-PCL目标产物,有关数据列于表1中.
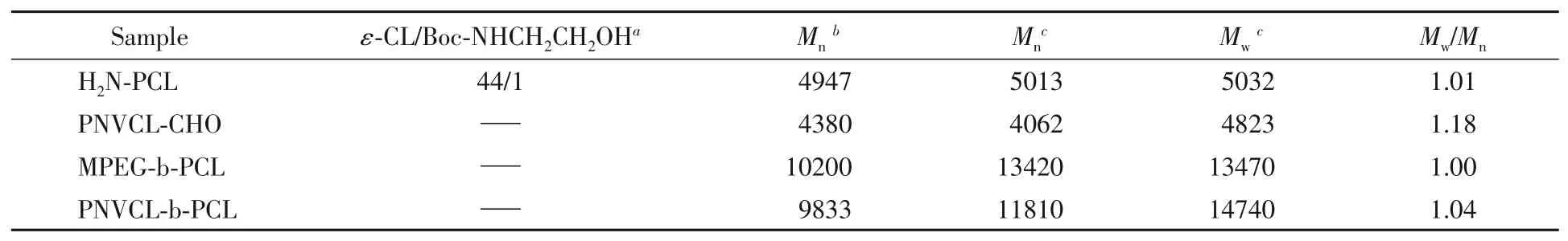
Table 1 Related data of polymers
图1(A)为MPEG-b-PCL的结构式,图1(C)为其1H NMR图.图1(C)中,δ1.36处的吸收峰为PCL链段中亚甲基(—CO—CH2—CH2—CH2—)质子的化学位移,δ1.63处的吸收峰为PCL链段中亚甲基(—CH2—CH2—CH2—CH2—OH)质子 的 化 学 位移,δ2.33处 的 吸收峰为PCL链段中亚甲 基(—CO—CH2—CH2—CH2—)质子的化学位移,δ3.38处的吸收峰为MPEG链段中甲基(—CH3)质子的化学位移,δ3.65处的吸收峰为MPEG链段中亚甲基(—O—CH2—CH2—)质子的化学位移,δ3.89处的吸收峰为PCL链段中亚甲基(—CH2—OH)质子的化学位移,δ4.08处的吸收峰为PCL链段中亚甲基(—CH2—CH2—O—)质子的化学位移,δ4.20处的吸收峰为亚甲基(—CH=N—CH2—CH2—O—)质子的化学位移,δ4.52处的吸收峰为亚甲基(—CH=N—CH2—CH2—O—)质子的化学位移,δ7.94和δ8.20处的吸收峰为苯环上质子的化学位移,δ10.10处的吸收峰为亚胺键(—CH=N—)上质子的化学位移.图1(E)是MPEG-b-PCL的GPC谱图.可以看出,谱线中只有一个单峰,没有出现其它峰,表明生成了嵌段共聚物,产物里没有其它物质.综合1H NMR和GPC结果,证明得到了MPEG-b-PCL目标产物,有关数据列于表1中.
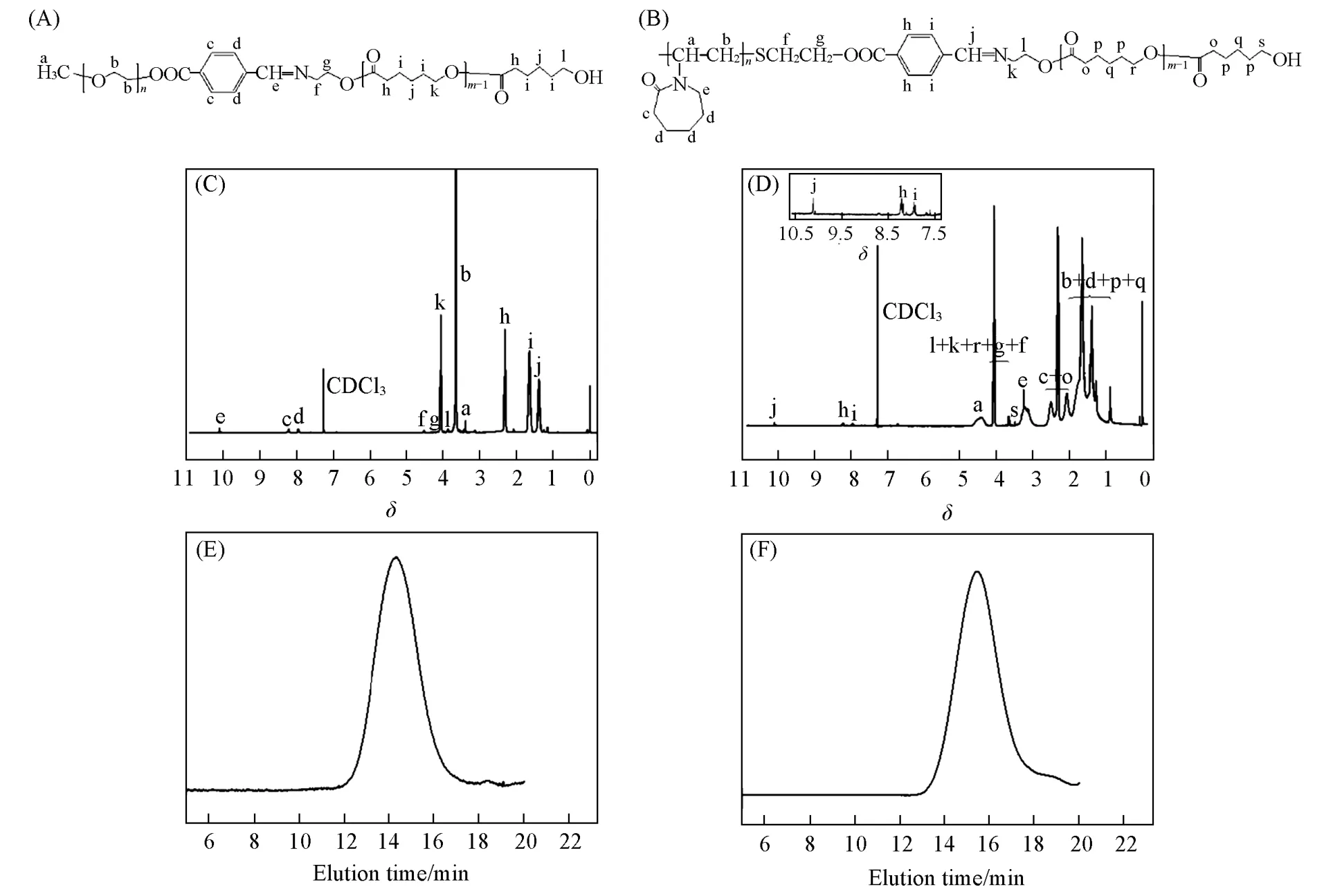
Fig.1 Chemical structures(A,B),1H NMR spectra(C,D)and GPC traces(E,F)of MPEG-b-PCL(A,C,E)and PNVCL-b-PCL(B,D,F)block copolymers
2.2 PNVCL-b-PCL嵌段共聚物的合成
图S6(见本文支持信息)是PNVCL-OH的1H NMR谱图.δ1.21~1.78处的吸收峰为聚乙烯链段中亚甲基(—CH—CH2—)和PNVCL环上亚甲基(—CH2—CH2—CH2—CH2—CH2—)质子的化学位移,δ2.50处的吸收峰为PNVCL环上亚甲基(—CO—CH2—)质子的化学位移,δ3.20处的吸收峰为PNVCL环上亚甲基(—N—CH2—)质子的化学位移,δ3.49处的吸收峰为亚甲基(—SCH2—CH2—OH)质子的化学位移,δ3.69处的吸收峰为亚甲基(—SCH2—CH2—OH)质子的化学位移,δ4.40处的吸收峰为PNVCL链段中次甲基(—CH—CH2—)质子的化学位移.图S7(见本文支持信息)给出PNVCL-CHO的1H NMR谱图.δ1.21~1.78处的吸收峰为聚乙烯链段中亚甲基(—CH—CH2—)和PNVCL环上亚甲基(—CH2—CH2—CH2—CH2—CH2—)质子的化学位移,δ2.50处的吸收峰为PNVCL环上亚甲基(—CO—CH2—)质子的化学位移,δ3.20处的吸收峰为PNVCL环上亚甲基(—N—CH2—)质子的化学位移,δ3.49处的吸收峰为亚甲基(—SCH2—CH2—OH)质子的化学位移,δ3.69处的吸收峰为亚甲基(—SCH2—CH2—OH)质子的化学位移,δ4.40处的吸收峰为PNVCL链段中次甲基(—CH—CH2—)质子的化学位移,δ7.90与δ8.20处的吸收峰为苯环上质子的化学位移,δ10.07处的吸收峰为醛基(—CHO)质子的化学位移.图S8(见本文支持信息)是PNVCL-CHO的GPC谱图.可以看出,PNVCL-CHO的GPC谱线呈单峰,表明产物里没有其它物质.综合1H NMR和GPC结果,证明得到了PNVCL-CHO目标产物,有关数据列于表1中.
图1(B)示出了PNVCL-b-PCL的结构式,图1(D)是其1H NMR谱图.δ0.87~2.07处的吸收峰为聚乙烯链段中亚甲基(—CH—CH2—)、PNVCL环上亚甲基(—CH2—CH2—CH2—CH2—CH2—)和PCL链段中亚甲基(—CH2—CH2—CH2—CH2—O—)质子的化学位移,δ2.30~2.48处的吸收峰为PNVCL环上亚甲基(—CO—CH2—)和PCL链段中亚甲基(—O=C—CH2—)质子的化学位移,δ3.20处的吸收峰为PNVCL环上亚甲基(—N—CH2—)质子的化学位移,δ3.44处的吸收峰为PCL链段中亚甲基(—CH2—OH)质子的化学位移,δ3.65~4.08处的吸收峰为亚甲基(—CH=N—CH2—CH2—O—,—SCH2—CH2—OOC—)和PCL链段中亚甲基(—CH2—O—)质子的化学位移,δ4.41处的吸收峰为聚乙烯链段中次甲基(—CH—CH2—)质子的化学位移,δ7.94和δ8.20处的吸收峰为苯环上质子的化学位移,δ10.10处的吸收峰为亚胺键(—CH=N—)质子的化学位移.图1(F)是PNVCL-b-PCL的GPC谱图,为单峰,表明产物里没有其它物质.综合1H NMR和GPC结果,证明得到了PNVCL-b-PCL目标产物,有关数据列于表1中.
2.3 PNVCL-b-PCL的温度响应性
图S9(见本文支持信息)是PNVCL-b-PCL水溶液的透过率-温度曲线.从插图中可以看出,当温度低于PNVCL-b-PCL的LCST时,聚合物水溶液呈澄清透明;当温度高于聚合物的LCST时,聚合物水溶液变浑浊,表明共聚物中的PNVCL链段发生相变,两亲性PNVCL-PCL链段变成疏水性,表现出温度响应性.通过测定不同温度下聚合物溶液的透过率,以温度对透过率作图,得到聚合物溶液的透过率-温度曲线,从曲线上得到PNVCL-b-PCL的LCST为35.3℃.
2.4 共聚物复合胶束的表征
图2给出CMs的TEM照片和DLS图.可以看出,胶束呈球形分布,粒径较均匀,CMs(4∶6),CMs(5∶5)和CMs(6∶4)的粒径分别为152,122和142 nm,多分散指数(PDI)分别为0.218,0.235和0.227.

Fig.2 TEM images(A—C)and DLS results(D—F)of CMs with different ratios of MPEG-b-PCL to PNVCL-b-PCL
图3是pH=5.0醋酸缓冲溶液中CMs(5∶5)的粒径随时间变化曲线.由图3(A)可以看出,CMs(5∶5)在pH=5.0缓冲溶液中发生聚集,半径在1 h内从130 nm增加到295 nm,4 h后约为1110 nm,24 h后达到1855 nm.由图3(B)可见,CMs(5∶5)溶液在pH=5.0的缓冲溶液中经过48 h后变得浑浊,而在pH=7.4的缓冲溶液中仍然保持澄清.这是由于pH=5.0时亚胺键发生断裂,导致胶束解体,疏水核聚集粒径变大;而在pH=7.4时亚胺键未断裂,胶束仍然稳定存在.(A)Time/h:a.0;b.1;c.4;d.24.(B)pH:a.7.4;b.5.0.
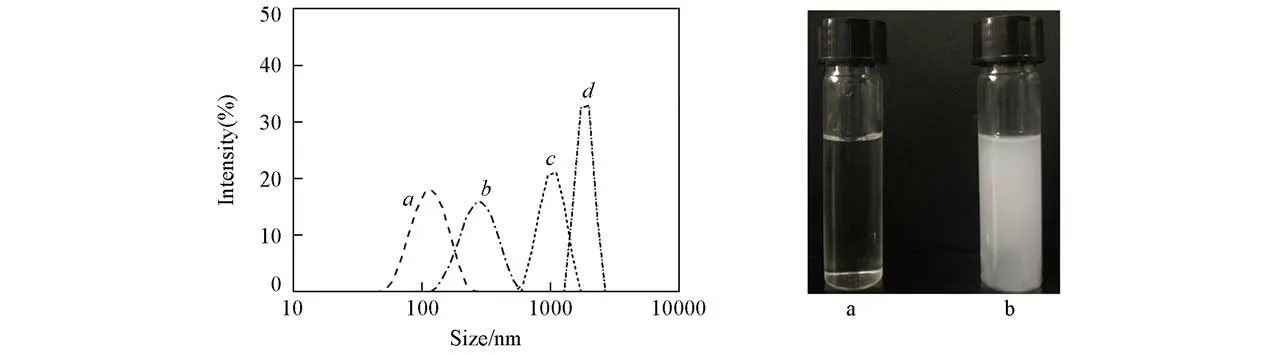
Fig.3 Change in size of CMs(5∶5)over time at pH of 5.0 and 25℃monitored by DLS(A)and photographs of CMs(5∶5)over 48 h at different pH values(B)
2.5 胶束的载药与释放
表2列出了共聚物复合胶束的载药率与载药量数据.从表2可以看出,CMs(5∶5)的载药率和载药量最佳,因此选择其作为体外释放模型胶束.
图4为不同条件下CMs-DOX的释放曲线.由图4(A)可见,在pH=7.4条件下,当温度为25℃时,DOX的释放速率大于其在37℃时的,这是因为PNVCL是亲水性温敏聚合物,在25℃时是水溶性,而在37℃时超过了PNVCL-b-PCL的LCST,PNVCL链段发生相变,形成不溶性链段塌缩在疏水性PCL核上,由PNVCL形成的复合胶束的壳通道关闭,因此释放速率降低[8].由4(B)可以看出,在37℃条件下,DOX在pH=5.0的缓冲溶液中的释放速率大于在pH=7.4的缓冲溶液中的,这是由于在酸性条件下亚胺键断裂,胶束被破坏,药物能更快地释放出来.由图4(C)可见,在pH=7.4及37℃条件下,DOX的释放速率随着MPEG-b-PCL与PNVCL-b-PCL摩尔比的减小而减降低.这是由于随着CMs体系中MPEG链段含量的减少,PNVCL的含量相对增加,MPEG通道的数量减少.

Table 2 Drug loading efficiency and drug loading content of micelles
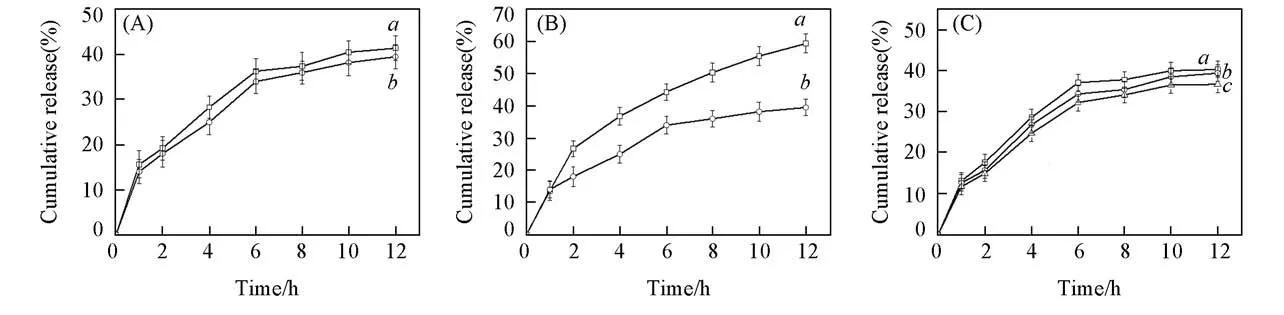
Fig.4 In vitro drug release profiles of DOX-loaded micelles under different temperature and pH conditions
根据药物体外释放结果和相关文献[13],我们认为共聚物复合胶束的形成可能按Scheme 1所示机理进行.MPEG-b-PCL和PNVCL-b-PCL在水中自组装形成以PCL为核、MPEG和PNVCL为混合壳的共聚物复合胶束,在室温下亲水性PNVCL链段伸展,当温度高于其LCST后发生相变,塌缩在疏水性PCL核的表面,而另一亲水性MPEG链段仍然保持伸展状态,形成带有通道的核-壳-冠结构.在弱酸性环境中,嵌段共聚物间的亚胺键断裂,胶束解体.

Scheme 1 Schematic representation of the structure and functioning mechanism of DOX-loaded composite micelles
2.6 体外细胞内吞作用
图5给出BGC-823细胞在CMs-DOX(5∶5)胶束中的内吞作用的荧光倒置显微镜照片.由图5可以看出,当BGC-823细胞在CMs-DOX(5∶5)中孵化2 h时,只有少量DOX释放,荧光强度较弱;孵化4 h后,荧光强度明显增强;当孵化12 h后,DOX持续释放,累积量越来越多,荧光强度进一步增强,并且
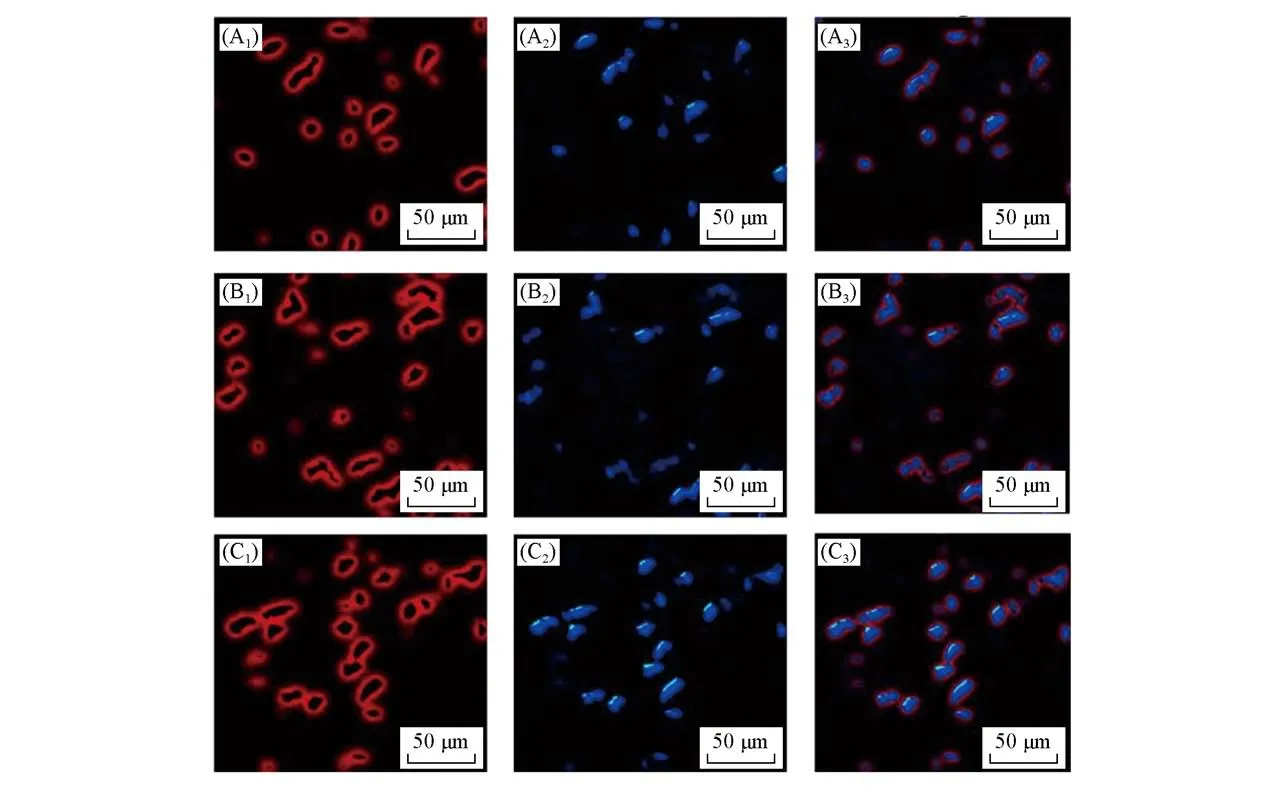
Fig.5 Inverted fluorescent microscopy images of BGC-823 cells after incubation with CMs-DOX(5∶5)at pH of 7.4 for 2 h(A1—A3),4 h(B1—B3)and 12 h(C1—C3),respectively
部分出现在细胞核中.由图5(A1~A3)和(C1~C3)可以看出,CMs-DOX(5∶5)通过内吞作用进入细胞内部,然后DOX通过细胞核间隙释放并扩散[11].
2.7 细胞毒性
图6(A)给出CMs(5∶5)对BGC-823细胞的毒性曲线.可以看出,经过48 h后,BGC-823细胞在CMs(5∶5)中的存活率基本在90%左右,当胶束浓度达到1.0 mg/mL时,细胞存活率仍接近90%,表明CMs(5∶5)对BGC-823细胞表现出较低的毒性,制备复合胶束的聚合物毒性较小.图6(B)给出DOX和CMs-DOX(5∶5)对BGC-823细胞的毒性曲线(孵化48 h).可以看出,空白DOX的IC50值(50%细胞被杀死的浓度)是1.52μg/mL,CMs-DOX(5∶5)的IC50值是4.16μg/mL.结果表明,CMs-DOX(5∶5)能够进入细胞中,具有比单纯DOX低的细胞毒性.这主要是由于DOX从胶束中缓慢释放延长了BGC-823细胞的内吞作用,这由DOX的体外释放也得到了证明.
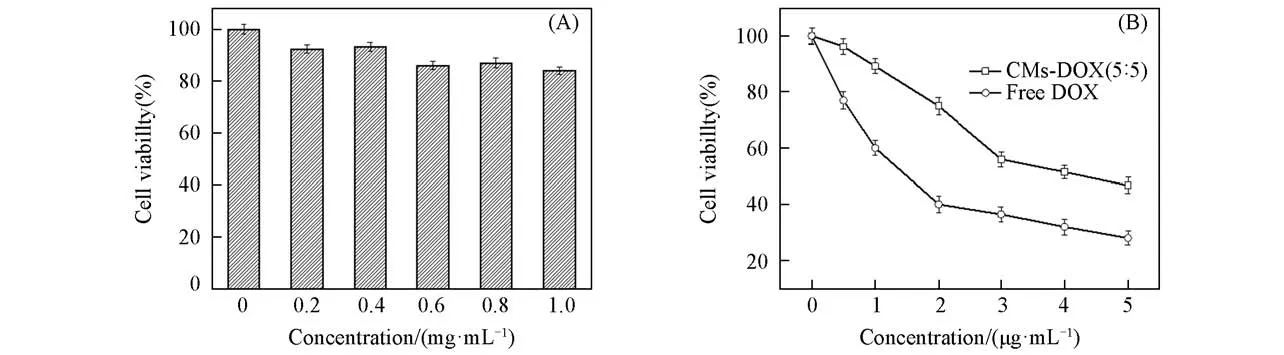
Fig.6 Cytotoxicity of BGC-823 cells against CMs(5∶5)(A)and free DOX and CMs-DOX(5∶5)(B)after cultured for 48 h with different micelle concentrations
3 结 论
MPEG-b-PCL和PNVCL-b-PCL嵌段共聚物能够形成以PCL为核、MPEG和PNVCL为壳的共聚物复合胶束(CMs),胶束呈球形,粒径在100~200 nm范围内.当MPEG-b-PCL与PNVCL-b-PCL的摩尔比为5∶5时,CMs的载药率和载药量最好.在正常生理温度下,温敏性PNVCL链段发生相变后塌缩在PCL核表面,亲水性MPEG链段形成可控通道,能够防止负载的药物迅速释放.亚胺键在正常生理条件下稳定,在弱酸性条件时发生断裂,胶束解体,促进药物释放.胶束具有较好的生物相容性,毒副作用较小,有望在药物载体方面得到应用.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20200378.
