基于SERS纳米探针的细胞内硝基还原酶检测
2020-12-23郑有为杨国海渠陆陆
郑有为,田 菲,张 倩,徐 迪,杨国海,渠陆陆
(江苏师范大学化学与材料科学学院,徐州221116)
癌细胞的增殖和生长会导致耗氧量的增加,进而使细胞处于缺氧环境[1].细胞缺氧会影响细胞的有氧呼吸,进而损害线粒体的氧化磷酸化,使得ATP的产生减少甚至停止,导致细胞受损,危害人体健康[2,3].因此,开发一种能够实时监测细胞缺氧产生和发展进程的有效方法,对癌症的早期诊断治疗具有重大意义.研究表明,细胞缺氧会导致细胞中某些还原酶,如硝基还原酶(NTR)、偶氮还原酶及心肌黄酶等[4,5]的含量异常增高.其中,对NTR的检测已经成为研究细胞缺氧的热点[6~8].NTR是一种能够催化还原芳香硝基为芳香胺的酶.在缺氧条件下,以还原型烟酰胺腺嘌呤二核苷酸(NADH)作为电子供体,可使细胞内NTR催化芳香硝基化合物发生单电子转移,产生硝基阴离子自由基,最终被还原为羟胺或氨基.细胞缺氧会导致细胞内NTR含量升高,因此NTR可作为检测肿瘤细胞缺氧状态的重要标志物.
近年来,已开发了一系列基于NTR催化还原反应的荧光探针用于缺氧检测[9~11].Zhang等[12]报道了一种用于监测缺氧环境和检测活体肿瘤细胞中NTR的双光子探针.Xu等[13]设计了一种新型的“开关”荧光探针,通过间接检测肿瘤细胞在低氧条件下的NTR含量来实现对肿瘤细胞的成像.Guo等[14]开发了一种长波长荧光探针,可在低氧条件下进行高灵敏、高选择性地NTR检测,并能在内源性干扰最小的情况下进行低氧细胞成像.但是,荧光探针存在稳定性差、易光漂白等缺陷,因此一些基于表面拉曼增强散射(SERS)的传感器被开发用于细胞缺氧的研究.SERS技术可以避免光漂白现象的产生,且能提供更准确的分子指纹信息[15~18].Jiang等[19]开发了一种SERS纳米传感器用于监测缺氧细胞的氧化还原电位.Ma等[20]利用可激活的SERS纳米探针对缺氧诱导的肺肿瘤细胞和组织的细胞内酸化进行定量监测,实现了对缺氧细胞内pH动态变化的监测.迄今,基于SERS技术传感对细胞缺氧的研究较多,但是用于缺氧细胞中NTR的研究较少.
本文设计了一种基于SERS技术的Au NPs@p-NTP纳米探针,该探针可用于检测缺氧细胞中的NTR,其制备过程和传感原理如Scheme 1所示.在NTR催化还原反应的基础上,选用对硝基苯硫酚(p-NTP)作为硝基芳族底物.由于金纳米粒子(Au NPs)具有高的SERS增强效应,因此将p-NTP修饰到Au NPs表面,制备了SERS纳米探针(Au NPs@p-NTP).在缺氧条件下,以NADH作为电子供体,可以将p-NTP还原为对氨基苯硫酚(p-ATP).NTR的活性和含量对催化还原反应具有一定影响,由于p-NTP和p-ATP在SERS光谱中呈现出不同的特征峰,所以可以通过观察SERS光谱的变化来监测氧化还原反应的发生,进而检测NTR的含量.

Scheme 1 Preparation of Au NPs@p-NTP nanoprobe(A)and sensing mechanism of Au NPs@p-NTP nanoprobe in cells(B)
1 实验部分
1.1 试剂与仪器
氯化钾(KCl)、氯化钠(NaCl)、氯化镁(MgCl2)、氯化钙(CaCl2)、氢氧化钠(NaOH)、硼酸(H3BO3)、磷酸(H3PO4)、磷酸二氢钾(KH2PO4)和磷酸氢二钠(Na2HPO4)均为分析纯,以及氯金酸三水合物(HAuCl4·3H2O,纯度≥99.9%)、柠檬酸钠(纯度98%)、对氨基苯硫酚(p-ATP,纯度≥90%)和对硝基苯硫酚(p-NTP,纯度95%)均购自阿拉丁试剂公司(上海);硝基还原酶(NTR,纯度≥90%)、L-络氨酸(L-tyrosine,纯度≥98%)、牛血清白蛋白(BSA,30%±2%)、葡萄糖氧化酶(GOD,100~250 U/mg)、辣根过氧化酶(HRP,≥250 U/mg)、L-还原型谷胱甘肽(GSH,纯度≥98%)、L-半胱氨酸(Cys,纯度≥98%)和β-烟酰胺腺嘌呤二核苷酸(NADH,纯度≥95%)购自美国Sigma Aldrich Chemicals公司;A549(肺腺癌上皮细胞)购自Key Gen Biotech有限公司(上海);磷酸盐缓冲溶液(PBS,pH 7.4)由KCl(2.7 mmol/L)、NaCl(136.7 mmol/L)、KH2PO4(1.41 mmol/L)和Na2HPO4(8.72 mmol/L)配制而成;实验中所用超纯水(电阻率>18 MΩ/cm)均由Milli-Q纯化系统(美国Mil-lipore公司)纯化所得.
NanoDrop 2000c型紫外-可见分光光度计(UV-Vis,美国Thermo Fisher公司)用来获得纳米结构的紫外-可见吸收光谱;使用JEM-2100型透射电子显微镜(日本JEOL公司)在200 kV加速电压下进行透射电子显微镜(TEM)成像;拉曼光谱用Via Renishaw型拉曼显微镜(英国Renishaw公司)测得(激发波长785 nm,激光功率2 mW,激光光斑尺寸2μm,曝光时间3 s);用680型酶标仪(美国Bio-Rad公司)进行噻唑蓝(MTT)测试.
1.2 实验过程
1.2.1 Au NPs的合成参照文献[21]方法,以柠檬酸盐为还原剂制备Au NPs.室温下,在100 mL去离子水中加入HAuCl4(4.8 mL,质量分数1.0%),剧烈搅拌下迅速将溶液加热至沸腾;将柠檬酸三钠溶液(10 mL,质量分数1.0%)逐滴加到沸腾溶液中,持续搅拌使溶液保持微沸至颜色不再变化,以确保HAuCl4被完全还原.将反应体系从热源移开并冷却至室温,制得的Au NPs溶液保存于4℃冰箱中,备用.
1.2.2 Au NPs@p-NTP纳米探针的制备将p-NTP溶液(500μL,5.0×10-4mol/L)逐滴加入到Au NPs(1 mL)溶液中,将混合溶液于室温静置1 h后,以8000 r/min转速离心10 min,以除去未与Au NPs结合的p-NTP,重新分散所得溶液即为Au NPs@p-NTP纳米探针溶液.
1.2.3 SERS检测为了保持酶活性,将NTR粉末溶解在超纯水中,并在-20℃条件下储存.将氮气分别通入NADH溶液、NTR溶液以及Au NPs@p-NTP纳米探针溶液中以除去溶液中的氧气.在缓冲液中加入除氧后的NADH溶液、NTR溶液和Au NPs@p-NTP纳米探针溶液各10μL,混合均匀后通入氮气除去氧气.分别对Au NPs@p-NTP纳米探针溶液、p-ATP溶液、p-NTP溶液以及反应后的混合溶液进行SERS检测.随后,将不同浓度的NTR溶液、NADH溶液和Au NPs@p-NTP纳米探针溶液在缓冲液中混合,对混合溶液除氧后进行SERS检测.
将Au NPs@p-NTP纳米探针溶液(10μL)分别与不同离子、活性物质(如NO,·OH,等)及其它生物样品混合,测定混合溶液的SERS光谱,以考察该探针的选择性.加入的干扰物质最终浓度为1μmol/L.通过亚硝酸钠与盐酸反应制备NO;将硫酸亚铁铵溶液(0.1 mmol/L)与H2O2(1 mmol/L)反应制备·OH;将焦性没食子酸(0.1 mL,1 mmol/L)滴加到2.98 mL Tris-HCl缓冲溶液中,在25℃的恒温水浴箱中孵育20 min制备
1.2.4 细胞培养及SERS信号收集在37℃下,将A549细胞株培养在含有DMEM介质的培养基中,并补以10%胎牛血清、青霉素(100μg/mL)和链霉素(100μg/mL).分别在常氧下的加湿培养箱(95%空气和5%CO2)和不同的缺氧(80%N2+15%O2+5%CO2;85%N2+10%O2+5%CO2;90%N2+5%O2+5%CO2;94%N2+1%O2+5%CO2)条件下培养.将Au NPs@p-NTP纳米探针添加到培养基中培养4 h;除去培养基后,分别对不同缺氧程度下细胞进行拉曼信号采集.
1.2.5 细胞毒性实验(MTT法)在96孔培养板中接种A549细胞,接种密度为1×105个细胞/孔,然后于37℃下培养24 h.弃去培养基后,将含有不同浓度梯度的Au NPs@p-NTP纳米探针溶液的培养液依次加入到每个孔中,分别孵育不同时间.然后,弃去孔中培养液,将各孔用PBS缓冲液洗涤3次,分别加入MTT试剂(10μL,5 mg/mL).将培养板继续在37℃下孵育4 h后,去除孔中的溶液,然后向每孔中分别加入100μL DMSO.为了溶解由活细胞形成的晶体,将96孔板在室温下振荡15 min.最后,置于酶标仪下于490 nm处读取每个孔的吸光度值,并通过公式(Atest/Acontrol)×100%计算相对细胞活性(%).
2 结果与讨论
2.1 Au NPs@p-NTP纳米探针的表征
由TEM照片[图1(A)]可以观察到Au NPs为球形结构,平均粒径约为70 nm.紫外-可见吸收光谱(UV-Vis)[图1(B)]显示,Au NPs的特征吸收峰在546 nm处,加入p-NTP后在280 nm处出现1个新峰,并且特征吸收峰红移至550 nm,表明Au NPs表面修饰了p-NTP.Zeta电位分析结果[图1(C)]显示,Au NPs的电位值为-42.59 mV,当p-NTP修饰在Au NPs上,p-NTP中吸电子基团—NO2导致电位值变为-20.21 mV,进一步证明p-NTP被修饰在Au NPs表面.
为了验证该探针可用于检测NTR,分别采集了Au NPs@p-NTP纳米探针以及在无氧且NADH存在条件下,加入NTR反应后的探针溶液的SERS光谱.由图1(D)可见,Au NPs@p-NTP纳米探针在855 cm-1(C—H伸缩模式),1076 cm-1(C—S伸缩模式),1344 cm-1(O—N—O伸缩模式)和1568 cm-1(酚环模式)处出现特征峰[22~24].加入NTR反应后,纳米探针在855,1344和1568 cm-1处的特征峰消失,1076 cm-1处的特征峰升高,在1486和1587 cm-1处出现新的特征峰,并且其与p-ATP的SERS光谱几乎一致.上述结果表明,在NTR的催化还原作用下,p-NTP的硝基被还原为氨基.
2.2 Au NPs@p-NTP纳米探针的重现性和稳定性

Fig.1 TEM image of Au NPs(A),UV-Vis spectra(B)and zeta-potentials(C)of Au NPs(a)and Au NPs@p-NTP nanoprobe(b),SERS spectra(D)of Au NPs@p-NTP nanoprobe(a),p-ATP(b)and mixed solution after adding probe and NTR(c)

Fig.2 SERS spectra of Au NPs@p-NTP nanoprobe continuously measured 26 times(A),SERS intensity at 1344 cm-1 in 26 measurements(B),SERS spectra of Au NPs@p-NTP nanoprobe in 1 h(C)and SERS intensity at 855 and 1344 cm-1 in 1 h(D)
纳米粒子聚合形成“热点”可以大幅增强SERS信号,但是“热点”的随机性分布会导致基底的重现性差,从而降低SERS技术的实际应用价值[25].因此,SERS信号的重现性是评估纳米探针的重要参数之一.因此,对Au NPs@p-NTP纳米探针进行了连续26次的SERS检测,以考察Au NPs@p-NTP纳米探针的重现性,发现在1344 cm-1处所获得的谱图均能很好地重叠,信号强度的相对标准偏差约为10.4%,表明制备的探针具有优异的重现性[图2(A)和(B)].进一步在正常条件下和高浓度GSH(2 mmol/L)生理条件下对制备的Au NPs@p-NTP纳米探针进行连续1 h的SERS检测,以考察该纳米探针的稳定性.结果[图2(C)和(D)及图S1(见本文支持信息)]表明,在不同时间内,在855和1344 cm-1处均可以观察到特征峰,并且信号强度无明显变化,说明Au NPs@p-NTP纳米探针具有良好的稳定性.
2.3 Au NPs@p-NTP纳米探针传感检测NTR
在缺氧状态及存在NADH的条件下,将不同浓度的NTR溶液与探针溶液均匀混合,对混合后的溶液进行SERS光谱检测.如图3(A)所示,随着NTR浓度的升高,1587 cm-1处的特征峰强度逐渐增大,1568 cm-1处的特征峰强度逐渐降低,且I1587/I1568与NTR浓度呈现良好的线性关系[图3(B)],检出限为18 ng/mL.因此,可以利用Au NPs@p-NTP纳米探针对NTR进行定量检测.
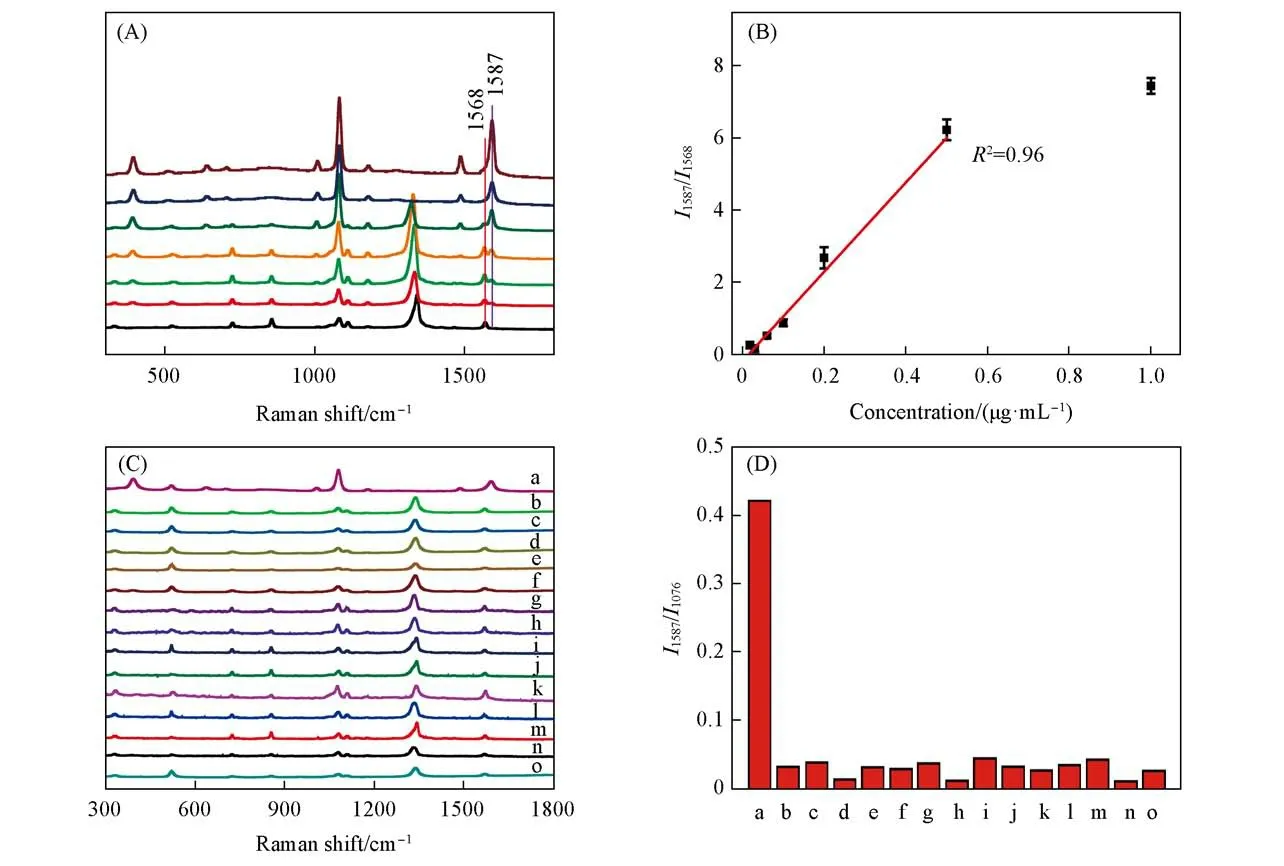
Fig.3 SERS spectra of Au NPs@p-NTP nanoprobe reacted with different concentrations of NTR(from bottom to top:0.018,0.03,0.06,0.1,0.2,0.5,1.0μg/mL)(A),linear relationship between SERS intensity ratio of 1587 cm-1 vs.1568 cm-1 and NTR concentration(B),SERS response of Au NPs@p-NTP nanoprobe in the presence of NADH and various species(C)and SERS intensity ratio of 1587 cm-1 vs.1076 cm-1 in various species(D)
此外,分别在Au NPs@p-NTP纳米探针溶液中加入NTR,Na+,K+,Mg2+,Ca2+,GOD,HRP,GSH,Cys,H2O2,NO,BSA,络氨酸,·OH及等多种阳离子,活性物质及其它生物相关样品,以考察Au NPs@p-NTP纳米探针对NTR的选择性.图3(C)为纳米探针溶液在添加不同样品后的SERS光谱.SERS谱峰强度和峰位移在加入不同样品后均未发生明显改变[图3(D)],而在加入NTR后,855及1344 cm-1处特征峰峰值明显下降,并在1486及1587 cm-1处出现新的特征峰,表明Au NPs@p-NTP纳米探针对NTR具有高度选择性.
2.4 缺氧细胞中的NTR检测
为了验证Au NPs@p-NTP纳米探针的细胞毒性,进行了MTT测试.将A549细胞与探针溶液孵育不同的时间后,测定每个时间点的吸光度,进行细胞相对存活率的计算,结果显示细胞与Au NPs@p-NTP纳米探针经过12 h孵育后存活率仍然高达91.4%(图4),证明Au NPs@p-NTP纳米探针的细胞毒性很低,适用于细胞内检测.
为了证明Au NPs@p-NTP纳米探针对肿瘤细胞内过表达NTR的检测应用能力,在37℃下,将A549细胞分别在常氧(20% O2)和不同的低氧(15%,10%,5%和1%O2)条件下生长,并在这些条件下分别与探针孵育4 h,随后进行SERS检测.如图5(A)所示,在常氧条件下,在1568 cm-1处的特征峰强度未发生明显降低.随着O2浓度的降低,在1587 cm-1处出现新的特征峰,并随着缺氧量的增加强度明显增加[图5(B)],说明该探针可以指示细胞内缺氧的程度.因此,可以在细胞中孵育Au NPs@p-NTP纳米探针后,采用SERS对细胞中NTR含量进行分析,从而判断细胞缺氧程度.
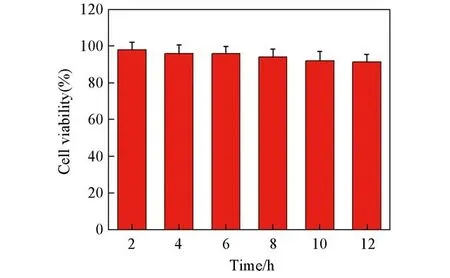
Fig.4 Cell viability after incubation of probe solution with A549 cells at different time
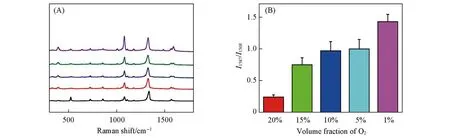
Fig.5 SERS spectra of Au NPs@p-NTP nanoprobe incubated with A549 cells under normoxic(20%O2)and different hypoxic(15%,10%,5%,and 1% O2)conditions for 4 h(A)and SERS intensity at I1587/I1568 as function of different hypoxic(B)
3 结 论
设计了一种基于SERS检测技术的Au NPs@p-NTP纳米探针,该探针通过将p-NTP修饰到Au NPs表面制备而成,并用于检测缺氧细胞中NTR的含量,通过SERS光谱的变化可测定低氧状态下NTR的含量及活性,并表现出优异的重现性和稳定性.Au NPs@p-NTP探针对A549具有较低的毒性,在细胞中孵育可以实现活细胞在缺氧状态下的NTR活性的特异性检测.本文设计的纳米探针能够监测NTR在缺氧细胞中的变化,为筛选和优化肿瘤药物提供了新的策略.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20200346.
