三维适形放疗、调强放疗和容积调强放疗在宫颈癌术后患者中的应用*
2020-12-23蒋军张利文廖珊陈默曾晓红何翰周菲菲闵燕飞邹育超黄荣
蒋军,张利文,廖珊,陈默,曾晓红,何翰,周菲菲,闵燕飞,邹育超,黄荣
佛山市第一人民医院 1肿瘤中心放疗科, 2物理室, 3统计室(广东佛山 528000)
宫颈癌居我国女性生殖系统恶性肿瘤的首位[1],严重威胁着女性的健康。虽然早期宫颈癌可以通过手术或放射治疗获得治愈的机会,但很大一部分患者选择了手术治疗。术后有中、高危因素的患者需接受放疗或放化疗。而三维适形放疗(three-dimensional conformal radiotherapy,3D-CRT)技术的放射野包含了大量的正常器官或组织。调强放疗(intensity-modulated radiotherapy,IMRT)技术的优势是增加肿瘤放射剂量,减少正常组织器官剂量和受照体积。容积调强放疗(volumetric-modulated arc therapy,VMAT)技术是在IMRT基础上发展起来的一种新型放射治疗技术。IMRT、VMAT及3D-CRT技术在宫颈癌术后患者中的疗效是否存在差异?IMRT和VMAT技术在不良反应方面是否一定优于3D-CRT技术目前仍存在争议。为进一步证实3种技术对宫颈癌术后患者的临床疗效和毒性不良反应是否存在差异,为宫颈癌术后患者的最佳放疗模式提供参考,本研究前瞻性分析了在我科行术后放疗的120例宫颈癌术后患者的临床资料。
1 资料与方法
1.1 一般资料 选取本院2017年1月至2019年12月收治的120例具有“高危因素”(如术后病理切缘阳性、宫旁浸润、盆腔淋巴结阳性)和“中危因素”(脉管浸润、深肌层浸润、原发肿瘤较大)的早期宫颈癌术后患者,按照随机数字表法平均分成3组,分别接受IMRT、VMAT及3D-CRT技术放疗。全部病例切缘干净、无伴远处转移,均接受同步化疗。见表1。
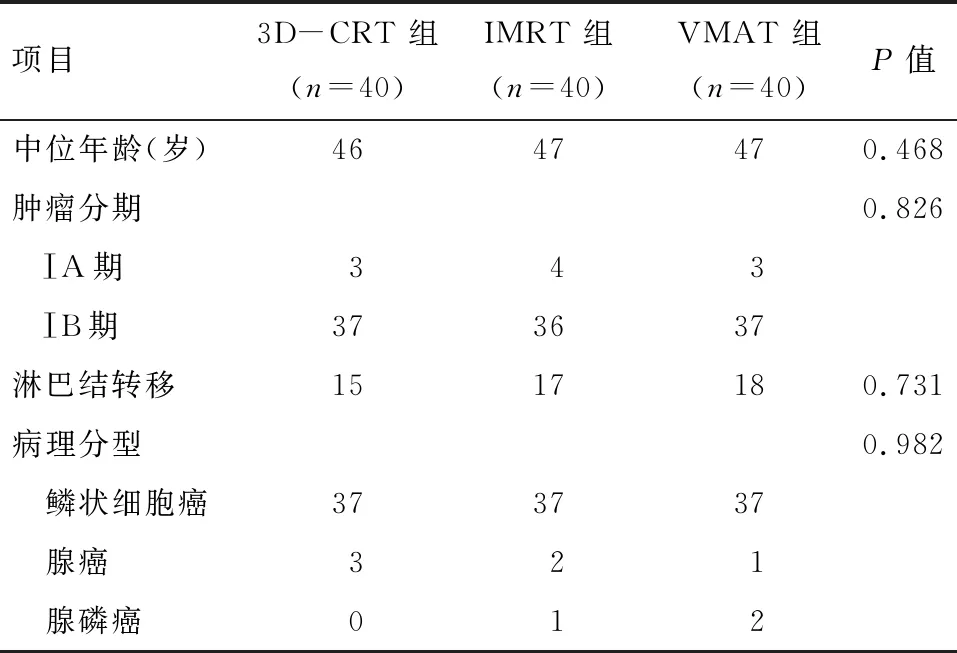
表1 3组不同治疗方式患者的临床特征 例
1.2 定位方法、靶区勾画 定位方法和靶区勾画见既往报道[2]。
1.3 治疗计划 放疗:采用Eclipse TPS 设计放疗计划。3D-CRT:采用四野盒式照射为主,入射野角度分别为0°、90°、180°和270°,根据剂量分布情况可以添加一个小野;IMRT:采用固定野动态调强技术,使用5 个照射野进行设计,优化选取计划;VMAT:采用旋转拉弧式适形技术,每2°给1 个照射野,共拉2个弧,于181°~179°顺时针方向拉一个弧,于179°~181°逆时针方向拉另一个弧,优化选取计划。采用6 MV X射线,处方剂量DT45.0 Gy/25fx;每例患者计划设定相同的优化目标(95%剂量曲线覆盖治疗靶区)和约束条件,如靶区的最大剂量、最小剂量,危及器官的最大剂量或接受最大剂量照射的最大体积等。
同步化疗方案:顺铂(20~30 mg/m2d1)+紫杉醇(45~50 mg/m2d1)(每周方案,共5周期)。
1.4 毒性不良反应评价标准 按National Cancer Institute-Common Toxicity Criteria for Events ver 5.0(NCI-CTCAE v5.0)标准评价毒性不良反应。
1.5 统计学方法 采用SPSS 19.0统计软件,毒性不良反应比较采用2检验,生存率的比较采用Kaplan-Meier法和Log-rank检验。以P<0.05为差异有统计学意义。
1.6 随访 所有病例均在治疗后1个月第1次随访,之后每3~4个月随访1次,直至治疗后满1年;1 年后每半年随访1次,末次随访时间为2019年12月,随访率为100%。总生存(overall survival,OS)为从初次治疗至死亡或末次随访。
2 结果
2.1 疗效 所有患者均完成了术后放疗,3D-CRT组患者1年、2年、3年生存率分别为100%、100%、83.3%;VMAT组患者1年、2年、3年生存率分别为100%、100%、87.5%;IMRT组患者1年、2年、3年生存率分别为100%、100%、85.7%。3组患者生存率比较差异均无统计学意义(P>0.05)。见图1。
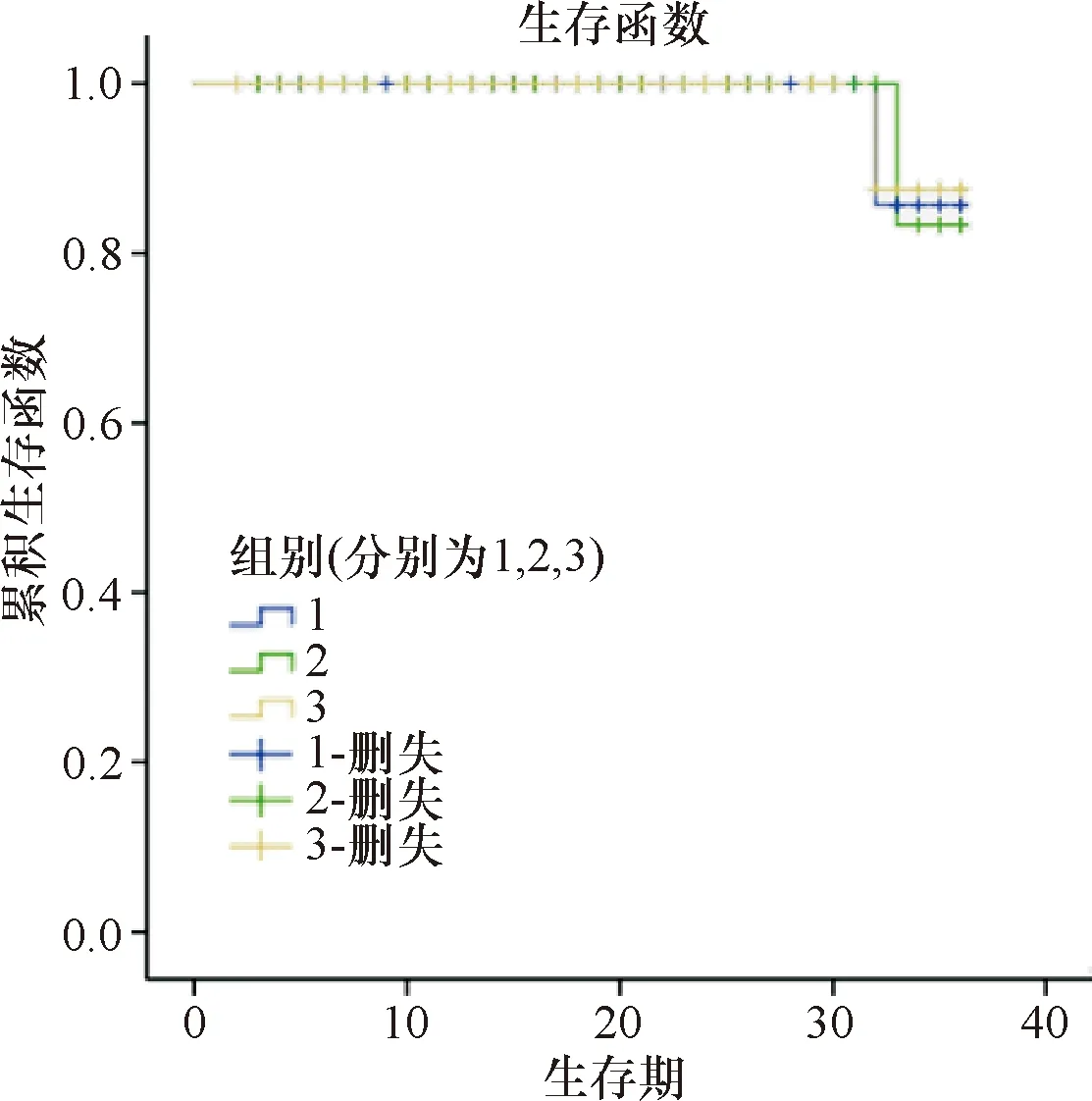
注:1为IMRT组;2为3D-CRT组;3为VMAT组
2.2 不良反应 VMAT、IMRT和3D-CRT组的膀胱反应发生率分别为25.0%、22.5%和57.5%(P<0.05),消化道反应发生率分别为42.5%、45.0%和87.5%(P<0.05),白细胞下降发生率分别为45.0%、47.5%和50.0%(P>0.05),放射性膀胱炎发生率分别为15.0%、12.5%和15.0%(P>0.05),放射性肠炎发生率分别为25%、27.5%和27.5%(P>0.05)。其中VMAT、IMRT和3D-CRT组在白细胞下降、放射性膀胱炎、放射性肠炎等方面未见明显差异(P>0.05)。VMAT和IMRT组在消化道反应、膀胱反应发生率等方面均比3D-CRT组低,差异有统计学意义(P<0.05),但VMAT和IMRT组在消化道反应、膀胱反应发生率方面差异无统计学意义(P>0.05)。见表2。
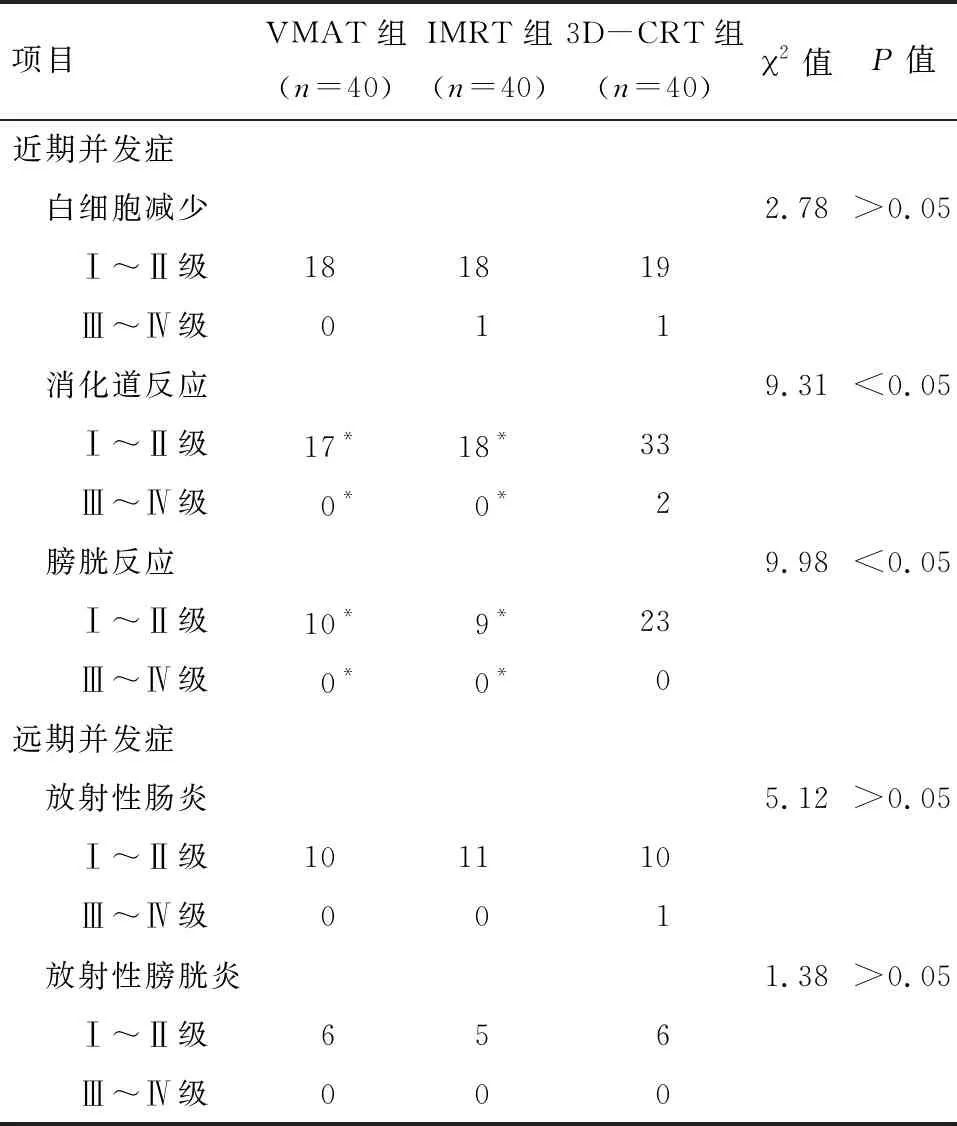
表2 3组不同治疗方式并发症的比较 例
3 讨论
早期宫颈癌术后具有“高危因素”和“中危因素”的患者需接受盆腔放疗。放疗范围主要包括术后瘤床、盆腔淋巴引流区和阴道残端等。目前,主要的放疗技术有3D-CRT、IMRT和VMAT等。3D-CRT技术适形度较差,放射野包含了大量的正常器官或组织。IMRT和VMAT技术是在3D-CRT技术上发展起来的新型放疗技术,由于它们独特的物理剂量分布优势,在保证宫颈癌术后患者靶区放疗剂量的同时,能够减少周围正常器官或组织的照射[2-5]。
物理剂量学优势是否一定可以转化成临床获益,是我们医护人员及患者共同关注的课题。
研究显示,在宫颈癌术后患者中,接受IMRT技术和3D-CRT技术患者的2年生存率分别为96.7%和86.7%,复发率分别为0.33%和13.33%,差异有统计学意义[6];采用VMAT技术和3D-CRT技术患者的1、2、3年生存率分别为100.0%、100.0%、97.62%和95.24%、85.71%、76.19%,差异有统计学意义[7]。但又有学者报道,对于宫颈癌术后患者,采用IMRT技术和3D-CRT技术患者的2~3年生存率及无疾病进展生存率无差异[4,8-9];IMRT技术与3D-CRT技术在疗效和复发率方面无差异[10];IMRT与VMAT技术复发率方面无差异[11];3D-CRT、IMRT与VMAT技术在生存率方面没有差异[12]。对于存在的争议。我们进行了前瞻性、随机研究,本研究结果显示,对于早期宫颈癌术后放疗患者,3D-CRT、IMRT、VMAT技术在临床疗效方面相当,未发现差异。从患者放疗计划物理剂量来分析,使用不同的放疗技术的处方剂量均为45.0 Gy,95%剂量曲线均覆盖了治疗靶区,临床疗效没有差异也不难解释。值得注意的是,我们为了保证3D-CRT治疗组95%剂量曲线能够覆盖整个治疗靶区,在4野盒式照射为主的基础上,根据剂量分布允许添加一个小野以改善剂量分布。
宫颈癌术后患者,在正常器官保护方面,研究显示,IMRT与VMAT技术不良反应相似[11-13];VMAT技术优于3D-CRT技术[12];发生急性胃肠道及膀胱反应概率,IMRT技术较3D-CRT技术有优势[4,6,8,10,12,14];放射性膀胱炎发生率,IMRT技术较3D-CRT技术有优势[4];放射性直肠炎发生率,IMRT技术较3D-CRT技术有优势[4,9-10,15];血液系统不良反应方面,IMRT技术较3D-CRT技术有优势[14]。但又有研究显示,在放射性膀胱炎方面,IMRT技术与3D-CRT技术无差异[10];血液系统方面也无差异[4,6]。更有研究显示,在血液系统(3级急性血液学)方面,IMRT技术较3D-CRT技术发生率更高[9]。在宫颈癌患者中,3D-CRT、IMRT、VMAT技术比较,在血液毒性方面,IMRT技术有优势[16]。因此,综合来看,IMRT和VMAT技术在不良反应方面相似。IMRT技术在急性胃肠道、泌尿道不良反应、放射性直肠炎发生率方面较3D-CRT有优势,在骨髓抑制、放射性膀胱炎发生率方面存在分歧。有限的数据显示VMAT技术优于3D-CRT技术。
本前瞻性研究结果显示,对于早期宫颈癌术后放疗患者,在不良反应方面,我们观察到,急性胃肠道反应和泌尿道反应,使用3D-CRT技术的患者比使用IMRT和VMAT技术的患者发生率要高,接受IMRT和VMAT技术的患者发生率相似。放射性直肠炎及膀胱炎的发生率,3D-CRT、IMRT、VMAT技术未发现差异。我们分析原因,发现发生放射性直肠炎及膀胱炎时,病灶主要集中在直肠前壁及膀胱后壁,内窥镜下表现为局部黏膜充血、糜烂、甚至溃疡、穿孔等。由于受照靶区与直肠、膀胱位置相邻,在物理剂量学方面,我们发现IMRT组、VMAT组与3D-CRT组的膀胱后壁、直肠前壁高剂量区域的差异无统计学意义,但IMRT、VMAT组膀胱前壁、 直肠后壁的V10、V20、V30、V40(接受10 Gy、20 Gy、30 Gy、40 Gy剂量照射的体积百分比)均低于3D-CRT 组。我们推测,由于IMRT、VMAT组在保护直肠后壁、膀胱前壁优于 3D-CRT组,但在膀胱后壁、直肠前壁高剂量区域无明显优势,使得IMRT组、VMAT组在急性胃肠道反应和泌尿道反应较3D-CRT组有优势,但在放射性直肠炎、放射性膀胱炎方面未见明显优势。我们也发现,在每次放疗时,绝大部分患者无法保证直肠、膀胱的充盈度与放疗前定位时直肠、膀胱的充盈度一致,如直肠与膀胱靠近计划靶区(planning target volume)的剂量热点,由于IMRT、VMAT适形度较高,可能导致直肠、膀胱受照剂量提高。因此,每次放疗时的膀胱、肠道准备应尽量与放疗前一致,以减少因膀胱、直肠的充盈状态不一致,导致在膀胱和直肠上出现剂量热点,加重膀胱、直肠的放射反应。
在骨髓抑制方面,我们未发现3D-CRT、IMRT和VMAT技术存在差异。骨盆骨是人体最重要的造血器官,可能由于我们在设计放疗计划时,未进行骨盆的剂量限制,使得血液毒性的差别不明显。有研究显示[17],骨盆骨的V10和V20与急性血液毒性发生率有关,骨盆骨受照剂量>30 Gy时会出现完全的增生不良,影响远期骨髓毒性。接下来的研究中,可把骨盆当成危及器官勾画并进行剂量限制,进一步明确3种技术在血液毒性上是否存在差异。
另外,VMAT技术的最大优势在于大大缩短治疗时间,减少患者放疗分次内的生物剂量和位移误差。文献报道[18],在治疗宫颈癌时,VMAT技术较IMRT技术可以提高效率,减少治疗次数。
综上所述,对于宫颈癌术后需接受放疗的患者,VMAT及IMRT技术优于传统的3D-CRT 技术,在保证临床疗效的同时,对周围的直肠、膀胱等危及器官有较好的保护作用;VMAT与IMRT技术的临床疗效及治疗相关毒性不良反应相似,但VMAT技术有治疗时间短的优势。在我国,由于放射治疗技术及设备分布不均衡,在没有VMAT及IMRT技术的单位,3D-CRT技术也不惜为一种选择。但本组病例为单中心研究、随访时间短,该技术的临床意义尚需积累更多、级别更高的临床试验进一步证实。
