七氟醚预处理对肺移植缺血再灌注损伤大鼠的保护作用及对氧化应激指标的影响
2020-12-23陈文娟薛永耐
陈文娟 薛永耐
(1.重庆市开州区人民医院麻醉科,重庆 405400)(2.武警重庆总队医院麻醉科,重庆 400061)
肺移植是治疗终末期肺疾病的有效手段,缺血再灌注损伤(Ischemia-reperfusion injury,IRI)是肺移植术后常见的并发症,是导致患者死亡的重要原因之一[1]。IRI是指组织器官缺血恢复血流后,不仅组织器官功能未恢复,反而使缺血引起的功能、代谢障碍和结构破坏进一步加重,甚至出现不可逆情况。目前为止,IRI的发病机制尚未明了,可能与免疫炎症、氧化应激损伤、细胞凋亡和基因等因素有关[2]。氧化应激在IRI中的作用是近年来研究的热点。氧化应激可以通过脂质过氧化、蛋白质变性、线粒体途径、内质网或死亡受体途径等介导组织损伤[3]。七氟醚是临床上常用的吸入性麻醉药物,有研究显示,七氟醚预处理可以缓解某些器官的IRI和移植后排斥反应,如肝脏和肾脏等[4-6]。七氟醚对IRI的保护作用与改善氧化应激损伤密切相关[7]。七氟醚预处理是否能缓解肺移植后 IRI,既往报道较少。Yamada等[8]发现,七氟醚预处理可以改善肺移植后原发性移植物功能障碍和急性排斥反应,并且明显下调肺组织和血浆中白细胞介素-6(Interleukin-6,IL-6)水平,提示七氟醚可能对肺移植后IRI有一定保护作用。本研究建立大鼠左肺原位移植模型,从凋亡和自噬两方面探讨七氟醚预处理对IRI的保护作用,及对肺组织和血清中氧化应激指标的影响,旨在为七氟醚在肺移植中的临床应用提供理论基础。
1 材料与方法
1.1 实验动物及分组
30只雄性SD大鼠购于北京维通利华实验动物技术有限公司,实验动物生产许可证号为 SCXK(京)2006-2009。动物饲养环境为温度(22±2)℃、相对湿度(50±10)%、明暗周期12 h/12 h,自由摄食和饮水。其中12只大鼠作为肺脏提供用鼠(6只的肺脏提供给B组,6只的肺脏提供给C组),剩余18只大鼠依据随机数字的方法分为A组(仅开胸,不做肺部移植)、B组(肺部移植)和C组(七氟醚预处理+肺部移植),每组均为6只。
1.2 试剂
戊巴比妥钠(上海斯信生物科技有限公司),低钾右旋糖酐溶液(北京普博斯生物科技有限公司),七氟醚(日本Maruishi公司),HE染色试剂盒(武汉博士德生物科技有限公司),碘化丙啶PI染色液(美国 Sigma公司),免疫组化 SP试剂盒(美国Inventrigen公司),兔抗 LC3-Ⅱ抗体和兔抗 LC3-Ⅰ抗体(美国Sigma公司),ELISA试剂盒(武汉博士德生物科技有限公司)。
1.3 原位左肺移植及七氟醚预处理
1.3.1 肺脏提供用鼠的左肺摘除:将计划提供C组肺脏的6只大鼠置于自制密闭麻醉箱(20 cm×12 cm×10 cm)中,暴露于1.5%七氟醚和50%氧气中,持续30 min[8];将计划提供B组的6只大鼠暴露于50%氧气中30 m in。之后将全部大鼠进行腹腔1%戊巴比妥(40 mg/kg体质量)注射,完成麻醉。固定大鼠后切开气管,连接呼吸机(型号R415,深圳瑞沃德生命科技有限公司生产;频率70次/min,潮气量10 mL/kg)。将左侧胸腔切开,游离左肺动脉、肺静脉和支气管。自右心室流出道插入导管至左肺动脉开口,低压灌注15 mL低钾右旋糖酐溶液,灌注完毕后,将供肺取出进行套管,顺序为肺动脉、肺静脉、支气管。用无菌注射器洗净支气管中的液体,然后充气使其处于半膨胀状态,随后用动脉夹夹住。用湿纱布包裹供肺,放入4℃的低钾右旋糖酐溶液中保存。供肺热缺血时间为2~3 min,总缺血时间为1 h左右。
1.3.2 B组与C组大鼠的左肺移植:B组与C组大鼠麻醉和气管插管过程与肺脏提供大鼠相同。将大鼠开胸后暴露肺门,向近心端和远心端游离支气管、肺动脉和肺静脉。从支气管和肺静脉间穿入2根7号丝线,把左肺向外牵拉,于近心端先结扎支气管和肺动脉,随后结扎肺静脉。从远心端切除左侧肺脏并带出肺门结构。用连续外翻褥式缝合法吻合支气管膜部、肺动脉和肺静脉,进行左肺原位移植[9]。A组大鼠仅作开胸。本研究所有大鼠术后均存活。
移植成功的标准为:肺部充气和弹性回缩良好,呈粉红色,血管吻合口未见渗血,并且气管无漏气[10]。等待移植肺完全扩张后,用无菌棉签将其回纳入胸腔,给予持续2 cm H2O的呼气末正压,以防止肺不张。再灌注后2 h放血处死 A、B、C组的全部大鼠,收集全部大鼠的股动脉血,收集A组大鼠的左肺以及B组、C组大鼠的移植肺。
1.4 观察指标
1.4.1 动脉血气分析:用ABL90 FLEX血气分析仪(上海生科仪器有限公司)分析动脉血氧合指数(PaO2/FiO2)、肺内分流率(Qs/Qt)。取上1/3肺组织,用滤纸吸干表面液体,称取湿质量。随后置入80℃烤箱中,48 h后称干质量,计算肺湿干比。
1.4.2 移植肺组织病理学观察:将中间1/3肺组织置于甲醛溶液中固定,用石蜡包埋,切片,随后进行HE染色。用CX43显微镜(日本奥林巴斯公司)观察肺泡出血、水肿等情况。根据肺泡观察结果进行评分:1分为无损伤;2分为损伤25%;3分为损伤50%;4分为损伤75%;5分为弥漫性损伤[11]。
1.4.3 碘化丙啶染色观察肺组织细胞凋亡:取肺组织切片,脱蜡、水化,抗原修复后用BSA封闭。用碘化丙啶(PI,红色,50μg/mL)及 4,6-二氨基-2-苯基吲哚(DAPI,蓝色,50μg/mL)染色 5 min,甘油封片后显微镜下观察。PI标记凋亡细胞,DAPI标记细胞核。
1.4.4 免疫组化SP法检测自噬蛋白Beclin-1水平:取肺组织切片,脱蜡、水化,抗原修复后用 BSA封闭。滴加一抗,4℃孵育过夜,PBS洗去抗体,随后加入二抗,温室孵育 15 min,加入 SP液 37℃15 m in,进行 DAB显色,细胞质有蓝颗粒沉着为阳性。
1.4.5 Western-blot检测自噬蛋白 LC3-Ⅱ和 LC3-Ⅰ表达水平:取下1/3肺进行组织匀浆,加入蛋白裂解液,冰上裂解 25 min后,15 000转/m in离心15 min,将上清液转移至EP管中。样品中加入SDS缓冲液煮沸5 min使蛋白变性。SDS-PAGE电泳后将蛋白转移至PVDF膜上,用5%脱脂奶粉封闭1 h,逐次孵育一抗和二抗。ECL显色,以GAPDH作为内参,计算目的蛋白条带与GAPDH灰度比值。
1.4.6 ELISA检测肺组织和血清氧化应激相关蛋白水平:用ELISA法检测肺组织匀浆液和血清中超氧化物岐化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、活性氧(reactive oxygen species,ROS)和丙二醛(malondialdehyde,MDA)水平。实验步骤严格按照ELISA试剂盒说明书进行操作。
1.5 统计方法
采用SPSS 20.0进行数据分析。呈正态分布计量数据用(±s)表示,3组呈正态分布计量数据间的比较采用单因素方差分析,两两比较用SNK-q法。P<0.05为差异有统计学意义。
2 结果
2.1 3组血气分析及肺组织湿干比的比较
3组的 PaO2/FiO2、Qs/Qt、肺湿干比数据差异均具有统计学意义(F=23.335,21.056,17.756,P<0.05),PaO2/FiO2的数值为A组高于C组,C组高于B组(P<0.05),Qs/Qt、肺湿干比的数值均为B组高于 C组,C组高于A组(P<0.05),见表1。
表1 3组血气分析及肺组织湿干比的比较(±s)Table 1 Comparison of blood gas analysis and lung tissue wet-dry ratio between the three groups(±s)
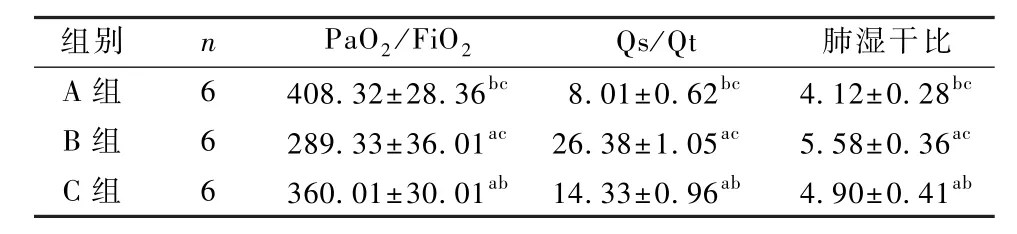
表1 3组血气分析及肺组织湿干比的比较(±s)Table 1 Comparison of blood gas analysis and lung tissue wet-dry ratio between the three groups(±s)
注:与 A组比较,aP<0.05;与 B组比较,bP<0.05;与 C组比较,cP<0.05Note:Compare with group A,aP<0.05;Compare with group B,bP<0.05;Compare with group C,cP<0.05
组别 n PaO2/FiO2 Qs/Qt 肺湿干比A 组 6 408.32±28.36bc 8.01±0.62bc 4.12±0.28bcB 组 6 289.33±36.01ac 26.38±1.05ac 5.58±0.36acC 组 6 360.01±30.01ab 14.33±0.96ab 4.90±0.41ab
2.2 3组肺组织病理学变化及评分的比较
3组的HE染色肺病理损伤评分数据差异均具有统计学意义(F=15.323,P<0.05),HE染色肺病理损伤评分为B组高于C组,C组高于 A组(P<0.05),见表 2和图 1。
表2 3组HE染色肺病理损伤评分(±s,分)Table 2 Pulmonary injury scores with HE staining in the three groups(±s,score)
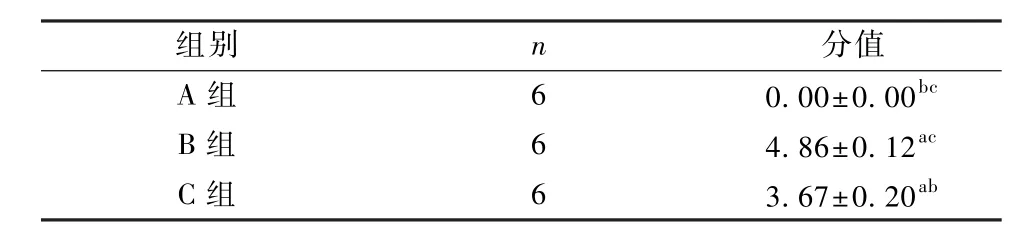
表2 3组HE染色肺病理损伤评分(±s,分)Table 2 Pulmonary injury scores with HE staining in the three groups(±s,score)
注:与 A组比较,aP<0.05;与 B组比较,bP<0.05;与 C组比较,cP<0.05Note:Compare with group A,aP<0.05;Compare with group B,bP<0.05;Compare with group C,cP<0.05
组别 n 分值A 组 6 0.00±0.00bcB 组 6 4.86±0.12acC 组 6 3.67±0.20ab
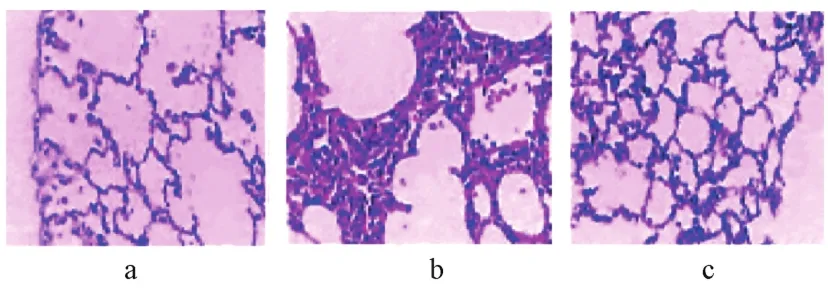
图1 3组肺组织HE染色(×200)注:a:A组大鼠肺泡结构清晰,肺泡壁薄且完整,未见出血或水肿;b:B组大鼠肺泡结构破坏,部分肺泡代偿性肺气肿,肺泡内有渗出物,肺泡隔增厚,镜下可见大量炎细胞浸润;c:C组大鼠组织损伤比B组轻,肺泡隔较薄,炎细胞浸润也较少Fig.1 HE staining of lung tissue in three groups(×200)Note:a:rats in group A had clear alveolar structure,thin and complete alveolar walls,and no bleeding or edema was observed;b:the alveolar structure of rats in group B was damaged,partial alveolar compensatory emphysema was found,exudate was found inalveoli,alveolar septum was thickened,and a large number of inflammatory cells were seen under the microscope;c:rats in groupC suffered less tissue damage than those in group B,with thinner alveolar septum and less inflammatory cell infiltration
2.3 3组肺组织凋亡情况的比较
3组的肺组织细胞凋亡率数据差异均具有统计学意义(F=18.866,P<0.05),肺组织细胞凋亡率为B组高于C组,C组高于 A组(P<0.05),见图2和表3。
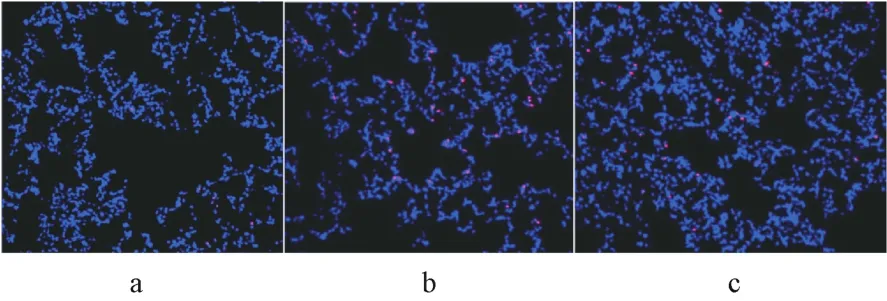
图2 PI染色观察肺组织细胞凋亡率(×200)注:a:A组大鼠;b:B组大鼠;c:C组大鼠;凋亡细胞染为红色,细胞核染为蓝色Fig.2 The apoptosis rate of lung tissue was observed by PI staining(×200)Note:a:rats in group A;b:rats in group B;c:rats in group C;The apoptotic cells were stained red and the nuclei were stained blue
表3 3组肺组织凋亡情况的比较(±s,%)Table 3 Comparison of lung tissue apoptosis in the three groups(±s,%)
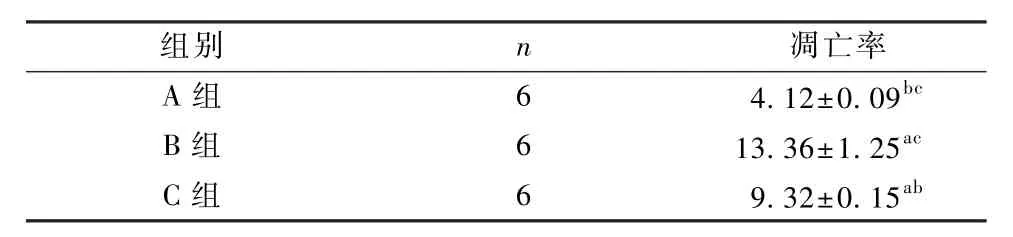
表3 3组肺组织凋亡情况的比较(±s,%)Table 3 Comparison of lung tissue apoptosis in the three groups(±s,%)
注:与 A组比较,aP<0.05;与 B组比较,bP<0.05;与 C组比较,cP<0.05Note:Compare with group A,aP<0.05;Compare with group B,bP<0.05;Compare with group C,cP<0.05
组别 n 凋亡率A 组 6 4.12±0.09bcB 组 6 13.36±1.25acC 组 6 9.32±0.15ab
2.4 3组肺组织自噬情况的比较
3组的 Beclin-1阳性细胞数、LC3-Ⅱ/LC3-Ⅰ数据差异均具有统计学意义(F=20.007,19.531,P<0.05),Beclin-1 阳性细胞数、LC3-Ⅱ/LC3-Ⅰ的数值均为A组高于C组,C组高于B组(P<0.05),见图 3、图 4和表 4。

图3 肺组织Beclin-1阳性免疫组化图(×200)注:a:A组大鼠;b:B组大鼠;c:C组大鼠Fig.3 Immunohistochemicalmap of beclin-1 positive lung tissue(×200)Note:a:rats in group A;b:rats in group B;c:rats in group C

图4 Western-blot检测LC3-Ⅰ和 LC3-Ⅱ蛋白表达水平Fig.4 Western b lot detection LC3-Ⅰand LC3-Ⅱprotein expression levels
表4 3组肺组织自噬情况的比较(±s)Table 4 Com parison of au tophagy of lung tissue in the three groups(±s)
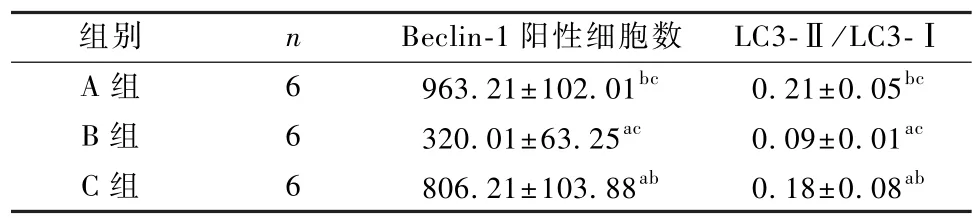
表4 3组肺组织自噬情况的比较(±s)Table 4 Com parison of au tophagy of lung tissue in the three groups(±s)
注:与 A组比较,aP<0.05;与 B组比较,bP<0.05;与 C组比较,cP<0.05Note:Compare with group A,aP<0.05;Compare with group B,bP<0.05;Compare with group C,cP<0.05
组别 n Beclin-1阳性细胞数 LC3-Ⅱ/LC3-ⅠA 组 6 963.21±102.01bc 0.21±0.05bcB 组 6 320.01±63.25ac 0.09±0.01acC 组 6 806.21±103.88ab 0.18±0.08ab
2.5 3组肺组织匀浆液中氧化应激指标水平的比较
3组肺组织匀浆液中的 SOD、GSH-Px、CAT、ROS、MDA数据差异均具有统计学意义(F=15.336、22.253、14.536、15.097、25.337,P<0.05),SOD、GSH-Px、CAT的数值为 A组高于 C组,C组高于B组(P<0.05),ROS、MDA的数值均为B组高于C组,C组高于A组(P<0.05),见表5。
表5 3组肺组织匀浆液中氧化应激指标水平的比较(±s)Table 5 Com parison of oxidative stress index levels in lung tissue homogenate between three groups(±s)

表5 3组肺组织匀浆液中氧化应激指标水平的比较(±s)Table 5 Com parison of oxidative stress index levels in lung tissue homogenate between three groups(±s)
注:与 A组比较,aP<0.05;与 B组比较,bP<0.05;与C组比较,cP<0.05Note:Compare with group A,aP<0.05;Compare with group B,bP<0.05;Compare with group C,cP<0.05
组别 n SOD/(U/mL) GSH-Px/(μmol/L) CAT/(U/mL) ROS/(U/mL) MDA/(nmol/L)A 组 6 16.12±1.01bc 26.20±2.69bc 22.33±4.85bc 15.26±2.87bc 22.68±3.63bcB 组 6 11.01±3.62ac 10.32±2.10ac 16.36±1.11ac 19.32±3.02ac 26.23±2.34acC 组 6 15.13±2.27ab 24.30±1.90ab 19.82±2.96ab 17.33±1.00ab 23.05±1.17ab
2.6 3组血清中氧化应激指标水平的比较
3 组血清中的 SOD、GSH-Px、CAT、ROS、MDA 数据差异均具有统计学意义(F=27.693、31.025、17.753、18.357、20.367,P<0.05),SOD、GSH-Px、CAT的数值为 A组高于 C组,C组高于 B组(P<0.05),ROS、MDA的数值均为B组高于C组,C组高于 A组(P<0.05),见表6。
表6 3组血清中氧化应激指标水平的比较(±s)Table 6 Comparison of serum Levels of oxidative stress in three groups(±s)

表6 3组血清中氧化应激指标水平的比较(±s)Table 6 Comparison of serum Levels of oxidative stress in three groups(±s)
注:与 A组比较,aP<0.05;与 B组比较,bP<0.05;与C组比较,cP<0.05Note:Compare with group A,aP<0.05;Compare with group B,bP<0.05;Compare with group C,cP<0.05
组别 n SOD/(U/mL) GSH-Px/(μmol/L) CAT/(U/mL) ROS/(U/mL) MDA/(nmol/L)A 组 6 6.05±0.32bc 13.25±1.01bc 12.42±0.34bc 4.13±0.20bc 3.69±0.51bcB 组 6 4.03±0.20 ac 7.32±1.01acC 组 6 5.14±0.61ab 12.63±0.85ab 9.01±0.10ab 6.20±0.69ab 4.11±0.17abac 11.36±1.20ac 8.32±0.89ac 8.47±0.35
3 讨论
IRI是一个极为复杂的过程,与免疫炎症、氧化应激损伤、细胞凋亡和细胞自噬等密切相关[2,12]。IRI导致的肺损伤一直是肺移植后早期发病和死亡的重要原因之一。严重的IRI会增加急性排斥反应和移植后阻塞性支气管炎的风险,并且导致远期移植物的功能障碍[13]。本研究发现七氟醚预处理可以明显改善PaO2/FiO2和Qs/Qt,缓解肺病理损伤,提示七氟醚预处理对肺移植IRI有一定保护作用。
七氟醚是临床上常用的吸入性麻醉药物,除了具有良好的麻醉效应外,还能明显改善多种器官的IRI,如心肌、大脑、肺、肾、肝[4-5]。七氟醚对 IRI的保护作用可能与改善免疫炎症和氧化应激损伤、调控micro-RNA表达、调节细胞凋亡和自噬等有关[14-15]。本研究从凋亡和自噬两方面探讨七氟醚对肺移植后IRI的保护作用。细胞凋亡是细胞死亡的形式之一,以核固缩、胞膜发泡和凋亡小体形成为特征,是维持机体自身稳定的一种重要机制。IRI细胞凋亡的发生机制尚未阐明,可能与氧自由基、钙超载、细胞因子、线粒体等有关[16]。自噬在 IRI中的作用越来越受到重视,在缺血阶段,自噬发挥保护细胞的作用,而在再灌注阶段,自噬可能会加重细胞损伤甚至导致细胞死亡[17]。Liu等[18]建立了大鼠原位肺移植模型,并采用自噬抑制剂(3-甲基腺嘌呤)进行干预,结果证实自噬在肺移植IRI中有重要作用。本研究发现,七氟醚预处理可以改善移植肺组织的凋亡和自噬。在心肌细胞缺氧/复氧(H/R)损伤的研究中,Lu等[19]同样发现七氟醚预处理可以改善H/R诱导的心肌细胞凋亡和自噬,并且抑制Beclin-1/PI3KC3复合物的形成。
IRI可引起器官氧化应激损伤。研究发现,肺移植IRI可以使肺组织和血清ROS和MDA水平升高,SOD、GSH-Px和 CAT水平降低。七氟醚改善IRI诱导的氧化应激损伤已有报道。与本研究结果类似的是,有研究发现七氟醚可以明显缓解IRI时心肌组织SOD、GSH和MDA水平。有趣的是,氧化应激损伤与凋亡和自噬有关。氧化应激可通过线粒体、死亡受体、内质网应激等途径介导细胞凋亡和自噬[20]。可以推测,七氟醚可能通过抗氧化应激损伤改善凋亡和自噬,进而发挥肺移植IRI保护作用。
本研究的局限性为:(1)仅检测了七氟醚预处理对氧化应激指标水平的影响,未进行深入的机制研究;(2)本研究只分析肺移植前七氟醚预处理对大鼠的影响,未分析后处理或预处理联合后处理对大鼠的影响。
综上所述,通过建立大鼠左肺原位移植再灌注肺部损伤模型,证实七氟醚预处理可以通过抗凋亡和自噬对肺移植IRI起到保护作用,七氟醚还可以改善移植肺组织和外周血清中氧化应激指标的水平。由于七氟醚是临床常用的吸入性麻醉药物,也为临床预防IRI提供了思路,未来需要进一步深入研究。
