高脂饲养联合链脲佐菌素注射建立2型糖尿病大鼠模型的骨骼肌特征分析∗
2020-12-23杨中亚
王 继 杨中亚 张 龙
(六盘水师范学院体育学院,六盘水 553004)
伴随高能量饮食习惯和缺乏运动的生活方式盛行,2型糖尿病的患病率在世界范围呈逐年上升趋势。2型糖尿病的发病进程与肥胖和胰岛素抵抗密切相关,这种早期的症状若未得到有效控制,机体长期的高血糖和高血脂导致糖毒性、脂毒性将进一步诱导胰岛B细胞凋亡,导致胰岛素分泌下降,最终产生严重的糖脂代谢紊乱[1]。
未得到良好控制的2型糖尿病最终将表现出葡萄糖、脂质和蛋白质代谢全面受损的特征,在骨骼肌受损方面主要表现为损伤后不易愈合和骨骼肌萎缩[2]。骨骼肌作为外周摄取葡萄糖的重要组织,其质量和功能的降低将进一步加剧2型糖尿病的代谢障碍[3]。严重的糖尿病肌萎缩常出现在2型糖尿病发病后期,但自发性2型糖尿病相关并发症的发展常需要数十年。因此,在科研和临床上迫切需要在短时间内建立符合2型糖尿病临床特征的动物模型用于2型糖尿病代谢障碍及其并发症治疗方法的探索。
高脂饮食联合链脲佐菌素注射(HFD/STZ)是最常用的实验性非自发性糖尿病模型。通过高脂饲养引起高胰岛素血症,在机体产生胰岛素抵抗和/或葡萄糖不耐受后,腹腔注射胰岛B细胞毒素STZ,快速导致B细胞数量减少和功能降低,从而在更短的时间内模拟出2型糖尿病的病理过程[4-6]。
本研究拟通过9周高脂饲养联合腹腔小剂量STZ注射建立2型糖尿病大鼠模型,观察建模后2型糖尿病大鼠的基本代谢情况,分析评价骨骼肌的变化特征,以期为快速建立2型糖尿病骨骼肌并发症动物模型提供理论依据。
1 材料与方法
1.1 材料
SPF级雄性 Sprague-Dawley大鼠39只,体质量(214.1±7.7)g,由北京维通利华实验动物技术有限公司提供[SCXK(京)2016-0006],饲养于北京体育大学实验中心 SPF级动物房[SYXK(京)2016-0003]。高脂饲料能量比为:脂肪60%、碳水化合物20%、蛋白质20%,购于北京华阜康生物科技股份有限公司[11003800009547]。实验通过北京体育大学运动科学实验伦理委员会批准。
链脲佐菌素(streptozotocin,STZ)购于 Sigma公司(S0130);大鼠胰岛素酶联免疫试剂盒购于Mercodia公司(10-1250-01);甲苯胺蓝溶液购于北京索莱宝科技有限公司(G3668);221(2-amino-2-methyl-1-propanol)缓冲液、ATP二钠盐购于 Sigma公司;其余分析纯试剂均购于国药集团化学试剂有限公司。血糖仪购于强生(上海)医疗器材有限公司(稳择易®血糖仪),酶标仪购于 BIO-RAD公司。
1.2 方法
1.2.1 建立2型糖尿病肌萎缩模型:所有大鼠以普通饲料适应性喂养5 d,随机取15只大鼠为对照组(Control group,C组),给予普通饲料饲养9周;其余24只大鼠为高脂饲料组,给予高脂饲料饲养9周。高脂饲料组于9周饲养后间隔3 d空腹状态下连续注射2次STZ(25 mg/kg体质量),对照组腹腔注射等量枸橼酸钠缓冲液。以STZ注射后第3天空腹血糖≥11.1 mmol/L作为2型糖尿病大鼠成模标准[7],剔除不成模大鼠,最终得到2型糖尿病模型组(Diabetes group,D组)大鼠20只,建模率为83.3%。继续饲养6周,观察模型稳定性,在2型糖尿病代谢指标稳定状态下分析骨骼肌萎缩情况。
1.2.2 样本测试分析:血样测试与计算:STZ注射前后,将所有大鼠禁食12 h后取尾血,血糖仪检测空腹血糖浓度(Fasting blood glucose,FBG),酶联免疫吸附法(ELISA)检测血清胰岛素(Fasting serum insulin,FINS)水平。以此计算大鼠胰岛素抵抗和敏感性指数,胰岛素敏感性指数ISI=1/FBG(mmol/L)×FINS(IU/L),胰岛素抵抗指数 HOMA-IR=FINS(IU/L)×FBG(mmol/L)/22.5。
骨骼肌样本采集:对每只实验大鼠称重后腹腔注射10%水合氯醛(0.4 mL/100 g体质量)麻醉,腹主动脉取血;分离比目鱼肌,在腹肌处切成0.5 cm×0.3 cm×0.3 cm长块状放入OCT模具中,样本于液氮预冷的异戊烷中进行固定,用于制备切片。
肌纤维类型染色与分析:每组随机抽取12只大鼠的比目鱼肌样本用于制取8μm厚度的冰冻切片。参考王月丽等[8]改良的ATP-ase染色方案鉴别肌纤维类型:室温环境复温5 min,预孵育液中室温预孵育2 min,Tris缓冲液洗2 m in×3次,甩干,孵育液中室温孵育15 min,1%CaCl2·2H2O水溶液中换洗三次(每次提拉切片3~4次),终止ATP-ATPase反应。0.1%甲苯胺蓝水溶液染色90 s,流水冲洗切片10~20 s,依次于95%乙醇、无水乙醇、无水乙醇中快速脱水(每次提拉切片3~5次),二甲苯透明,中性树胶封片。数码体视显微镜拍片,在200倍视野下每个样本随机采集4个图像用Image-Pro Plus 6.0统计不同类型肌纤维平均横截面积。
1.3 统计方法
数据以(±s)表示。采用SPSS 19.0软件进行数据统计。组间数据比较采用独立样本t检验,以P<0.05为显著差异,P<0.01为极显著差异。
2 结果
2.1 2型糖尿病大鼠体质量变化规律
高脂饲养9周后,模型组大鼠体质量和对照组无显著差异(P>0.05),之后对模型组进行腹腔注射STZ。STZ注射后,模型组大鼠体质量呈逐渐下降趋势,且2~6周极显著低于对照组(P<0.01),至注射后第6周趋于稳定。见表1。
2.2 2型糖尿病大鼠血糖变化情况
高脂饲养9周后,模型组大鼠血糖显著高于对照组(P<0.05);在 STZ注射后,模型组大鼠血糖进一步升高,且2~6周极显著高于对照组(P<0.01)。模型组稳定性显示,至注射后第4周逐步趋于稳定,见表 2。
2.3 2型糖尿病大鼠胰岛素水平和胰岛素敏感性变化情况
分别于STZ注射前、STZ注射后2周和6周对大鼠血清胰岛素水平进行测试,计算 HOMA-IR和ISI。模型组大鼠的FINS水平在STZ注射前极显著高于对照组(P<0.01),注射后极显著低于对照组(P<0.01),HOMA-IR在 STZ注射前后均极显著高于对照组(P<0.01),ISI均极显著低于对照组(P<0.01)。FINS水平在 STZ注射后2周极显著降低(P<0.01),并趋于稳定,HOMA-IR和 ISI在 STZ注射前后较为稳定,无显著变化,见表3。

表1 STZ注射前后各组大鼠体质量变化情况Table 1 Changes of body weight before and after STZ injection in rats of each group

表2 STZ注射前后各组大鼠血糖变化情况Table 2 Changes of blood glucose before and after STZ injection in rats of each group

表3 STZ注射前后各组大鼠FINS、HOM A-IR和ISI变化情况Table 3 Changes of FIN,HOM A-IR and ISI before and after STZ injection in rats of each group
2.4 2型糖尿病大鼠骨骼肌纤维萎缩的特征分析
ATP-ase染色结果显示,Ⅰ型肌纤维呈浅蓝色,Ⅱ型肌纤呈深蓝色,为消除染片不同批次间色彩饱和度(纯度)的差异,统一去色。去色后灰色为Ⅰ型肌纤维,黑色为Ⅱ型肌纤维。见图1。
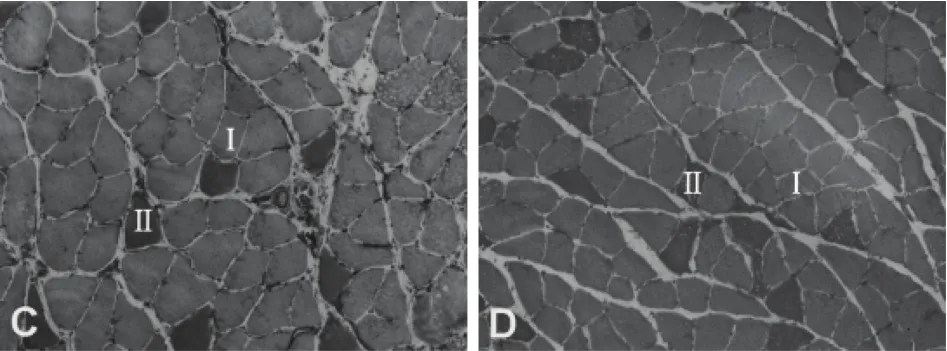
图1 比目鱼肌肌纤维类型染色结果(×20)注:C:对照组;D:2型糖尿病组Fig.1 Staining results of soleusmuscle fiber types(×20)Note:C:Control group;D:Type 2 Diabetes group
与对照组相比,模型组大鼠Ⅰ型和Ⅱ型肌纤维平均横截面积均显著降低,其中Ⅰ型肌纤维平均横截面积降低幅度达到34.8%(P<0.01),Ⅱ型肌纤维平均横截面积降低幅度为14.1%(P<0.05),骨骼肌萎缩现象明显。见表4。

表4 比目鱼肌肌纤维平均横截面积变化情况Table 4 Changes of mean cross-sectional area of soleusmuscle fiber
3 讨论
3.1 HFD/STZ建立2型糖尿病大鼠模型的基本特征分析
Reed等[9]在2000年率先报道了一种快速建立的新型2型糖尿病大鼠模型,先通过高脂饲养2周诱导胰岛素抵抗,然后一次性注射大剂量胰岛B细胞特异性毒素STZ(50 mg/kg体质量)来快速建立胰岛素抵抗和血糖升高的2型糖尿病模型(HFD/STZ)。为了保障该模式下2型糖尿病模型的稳定性和成模率,逐渐发展为以较长的高脂饲养时间联合小剂量STZ连续多次注射来建立2型糖尿病模型[10-13]。在本研究中,9周高脂饲养已经明显诱导模型组大鼠空腹血糖和胰岛素水平升高,外周胰岛素抵抗程度增加,胰岛素敏感性降低。通过9周高脂饲养诱导模型组大鼠体质量出现上升趋势,但要达到体质量显著增加则需要更长的饲养时间,提示高脂饲养的时间对HFD/STZ建立2型糖尿病大鼠模型的特征有较大影响。
本研究在胰岛素抵抗的基础上,采用连续注射2次小剂量STZ(25 mg/kg)最终建立2型糖尿病模型,建模率达83.3%。模型组大鼠体质量显著下降,血糖显著升高,并在成模后4周后逐步稳定;建模后胰岛素水平始终处于较低水平,胰岛素抵抗明显、胰岛素敏感性显著下降。进一步验证了高脂饲养联合STZ注射能有效建立符合2型糖尿病代谢特征的实验动物模型,具有建模周期短、疾病特征明显等优势,但建模后2型糖尿病基本特征的稳定需要一段时间(约4周)。
3.2 HFD/STZ建立2型糖尿病大鼠的骨骼肌特征分析
根据代谢特征的不同,可以将骨骼肌纤维简单地分为氧化型肌纤维(Ⅰ型)和酵解型肌纤维(Ⅱ型)。Ⅰ型肌纤维主要依靠有氧代谢途径提供能量,由于毛细血管和线粒体丰富、有氧代谢酶活性较强,Ⅰ型肌纤维持续氧化供能和抗疲劳能力较强;Ⅱ型肌纤维主要依靠糖酵解代谢途径来供能,由于线粒体数量和氧化酶含量较少,氧化供能和抗疲劳能力较差[14]。
在本研究中,模型组大鼠整体指标在STZ注射后4周基本稳定,在第6周时检测了大鼠比目鱼肌的不同类型肌纤维的变化情况。ATP-ase染色显示模型组大鼠存在明显的肌萎缩现象,具体表现为Ⅰ型和Ⅱ型肌纤维平均横截面积均显著降低,其中Ⅰ型肌纤维萎缩程度更明显,平均横截面积降低幅度达到34.8%,Ⅱ型肌纤维平均横截面积降低幅度为14.1%。
Ⅰ型肌纤维中糖有氧氧化关键酶活性、胰岛素受体和葡萄糖转运蛋白4(Glucose transporter
protein 4,GLUT-4)的表达量均高于Ⅱ型肌纤维,因此Ⅰ型肌纤维对葡萄糖转运和利用的贡献率更高[15]。而骨骼肌的萎缩,尤其是葡萄糖代谢能力强的Ⅰ型肌纤维的萎缩,是进一步加剧2型糖尿病代谢障碍的重要原因之一。在2型糖尿病环境下,长期脂质堆积和慢性炎症导致肌卫星细胞增殖分化能力降低、细胞凋亡增加、收缩蛋白合成和降解失衡,导致骨骼肌细胞呈现数量降低和横截面积的下降,最终发展成肌萎缩[3]。
自发性2型糖尿病肌萎缩模型建模周期一般很长,在本研究建立的模型中,STZ注射后4周整体指标表现较为稳定,在第6周时已出现明显的肌萎缩现象,同时表现出Ⅰ型肌纤维萎缩更为明显的典型特征。该建模方法具有建模时间短、状态稳定和特征明显的优势,是进一步研究运动和药物干预治疗2型糖尿病肌萎缩、提高骨骼肌容量和功能,改善2型代谢障碍较为理想的模型。
