Protectin DX对老年大鼠肺损伤相关炎性因子和氧化损伤的保护作用
2020-12-23魏敬军魏崇莉张永霞戴沛军
魏敬军 魏崇莉 张永霞 戴沛军
(1.联勤保障部队第九四〇医院检验科,兰州 730070)(2.联勤保障部队第九四〇医院预防控制科,兰州 730070)(3.联勤保障部队第九四〇医院呼吸内科,兰州730070)
胸科手术中肺损伤发生率较高,其中肺叶切除术是引起肺损伤的常见胸科手术之一,肺叶切除手术会导致氧自由基及炎性因子的产生和释放,甚至会引起相关肺损伤的发生[1]。迄今为止有关肺叶切除术后的肺损伤的机制尚未被完全阐明,且暂无确切有效的治疗措施。近几年有研究发现抑制肺叶切除术过程中氧化应激和炎症反应,可以明显降低肺损伤的发生和发展,进而改善患者预后[2-3]。Protectins是一种具有明显抑制炎症反应作用的特异性促炎症消退介质[4]。Protectin DX(PDX)是 Protectins的重要成员[5],研究表明,PDX可以明显减轻氧化应激反应[6],抑制促炎症因子及中性粒细胞的聚集,促进巨噬细胞功能[7-8]。而肺叶切除术多应用于局部肺叶内的不可逆性病变,考虑到临床实践中接受肺叶切除手术的患者多为老年人,本研究将选用老年大鼠构建肺叶切除术后肺损伤模型,用PDX进行干预治疗,初步探讨PDX对老年大鼠肺叶切除术后肺损伤的保护作用及可能机制。
1 材料与方法
1.1 实验动物及分组
30只SPF级健康老年雄性SD大鼠购于北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2017-0007,10月龄,体质量为360~420 g。饲养于SPF级环境中,12 h/12 h明暗交替,温度为22~25℃,相对湿度为45%~60%,自由进食和饮水,适应性喂养1周后进行实验,本实验通过本院动物伦理委员会审批。
1.2 主要仪器及试剂
低温冷冻离心机3K15(美国 Sigma公司),Varioskan LUX多功能酶标仪(美国Thermo公司);PDX(美国 Cayman公司),大鼠 IL-1β、TNF-α、IL-6 ELISA试剂盒(北京索莱宝科技有限公司),OH-1、NF-κB等抗体(美国 CST公司),山羊抗兔二抗(武汉安特捷生物技术有限公司),细胞总蛋白及核蛋白提取试剂盒(上海碧云天生物技术有限公司)、BCA蛋白定量试剂盒(美国 Thermo公司)、MDA、SOD、ROS试剂盒(南京建成生物工程研究所)等。
1.3 大鼠肺损伤模型制备及分组
30只SD老年大鼠按照随机数字表分为假手术组、手术组和PDX处理组,每组10只。所有大鼠于实验前禁食12 h后腹腔注射50 mg/kg体质量戊巴比妥钠,待麻醉成功后将其仰卧位固定于手术台上,并于右侧第 4~5肋间备皮,开胸。手术组和 PDX处理组大鼠去除第4~5肋部分肋骨,暴露右侧肺,分离结扎血管及支气管后行右下肺叶切除术;假手术组除不进行右下肺叶切除术外,其余操作同手术组及PDX处理组。所有大鼠术后进行右胸腔闭式引流。术后待大鼠苏醒后,放回笼中继续饲养。于造模1 h后假手术组和手术组大鼠腹腔注射300μL生理盐水,PDX处理组腹腔注射300μL PDX(500 ng)。24 h后采用过度麻醉法处死大鼠,收集各组大鼠肺组织及肺泡灌洗液,备用。
1.4 肺组织病理损伤评分标准
收集各组大鼠的右肺上叶,使用4%多聚甲醛将肺组织固定24 h后进行脱水,透明处理,石蜡包埋,常规切片(5μm),将切片脱蜡后行苏木精-伊红(HE)染色,使用普通光学显微镜观察肺组织损伤情况。参照美国胸科学会公布的肺组织损伤评分标准[9]对肺损伤程度进行评定。
1.5 肺组织干湿质量比(W/D)
收集并称量各组大鼠新鲜的右肺中叶组织质量,然后将肺组织放入恒温烤箱中,烘干至恒重后再次称重并记录。两次肺组织的质量之比即为肺组织的W/D。
1.6 肺泡灌洗液中蛋白浓度检测
结扎大鼠右肺后,使用生理盐水灌洗左肺,每次1 mL,共3次。采集各组大鼠的肺泡灌洗液,每组设3个复孔,按照 BCA试剂盒说明书(BCA Protein Assay Kit)检测肺泡灌洗液中的蛋白浓度。
1.7 酶联免疫吸附法(ELISA)检测肺泡灌洗液中相关炎性因子水平
取各组大鼠肺泡灌洗液适量,每组设3个复孔,按照ELISA试剂盒说明书检测肺泡灌洗液中IL-1β、IL-6和 TNF-α 水平。
1.8 3组大鼠肺组织中氧化应激水平的检测
取各组大鼠肺组织匀浆,每组设3个复孔,参照SOD、MDA、ROS试剂盒说明书对各组肺组织中SOD活性、MDA及ROS含量进行检测。
1.9 蛋白免疫印迹法检测肺组织中HO-1、核转录因子-κB(NF-κB)蛋白水平
取贮存于-80℃冰箱中的各组大鼠肺组织适量,采用RIPA试剂盒及核蛋白提取试剂盒提取肺组织总蛋白及核蛋白,采用BCA试剂盒检测各组样本的蛋白浓度。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行电泳,每个泳道加40μg总蛋白。湿法转膜将蛋白转移至PVDF膜上,用5%脱脂奶粉室温封闭1.5 h。随后将膜分别置于含HO-1(1 ∶1000)、NF-κB(1 ∶1000)、核内参 Lamin B(1∶1000)及肺组织蛋白内参GAPDH(1 ∶1000)的一抗稀释液中于4℃下孵育过夜。次日回收一抗,用TBST漂洗3次,10 m in/次,随后将膜置于用辣根过氧化物酶标记的二抗(1∶5000)稀释液中室温下孵育1.5 h,随后用 TBST洗膜,采用超敏 ECL化学发光试剂盒进行显影曝光。以Lamin B作为NF-κB的参照、GAPDH作为 HO-1蛋白的参照,应用Image J对目的蛋白条带进行灰度值分析。
1.10 统计方法
采用SPSS 22.0软件进行统计学处理,计量资料结果使用均数±标准差(±s)表示,组间采用单因素方差分析比较,计数资料采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠肺组织病理形态分析
假手术组老年大鼠肺组织肺泡壁结构完整,肺泡间隔无增厚且无炎性细胞浸润;与假手术组相比较,手术组老年大鼠肺组织结构明显受损,肺泡间隔明显增厚且可见大量肺泡融合,肺泡间隔及肺泡腔内发现大量炎症细胞浸润等,而PDX处理组损伤程度明显减轻,肺泡间隔及肺泡腔内发现少量炎症细胞浸润。肺组织病理评分与镜下观察结果一致(P<0.01),见表1、图1。
表1 各组老年大鼠肺组织损伤评分(±s,分)Table 1 Lung tissue in jury scores of aged rats in each group (±s,points)

表1 各组老年大鼠肺组织损伤评分(±s,分)Table 1 Lung tissue in jury scores of aged rats in each group (±s,points)
注:与假手术组相比,∗∗P<0.01;与手术组比较,##P<0.01Note:Compared with sham group,∗∗P<0.01;Compared with surgery group,##P<0.01
组别肺损伤评分 F P假手术组0.287±0.142 5.217 /手术组0.594±0.203∗∗ 6.032 0.006 PDX 处理组 0.376±0.217## 5.469 0.009

图1 各组肺组织HE染色(×200)Fig.1 HE staining of lung tissue in each group (×200)
2.2 3组的肺组织W/D和肺泡灌洗液中蛋白浓度对比结果
由实验结果可知:与假手术组相比,手术组大鼠肺组织W/D比值和肺泡灌洗液中的蛋白浓度明显增加(P<0.01);与手术组相比较,PDX处理组大鼠的W/D比值和肺泡灌洗液中的蛋白浓度明显下降(P<0.01),见表 2。

表2 3组大鼠W/D比值及肺泡灌洗液中的蛋白浓度分析Table 2W/D ratio of three groups of rats and analysis of protein concentration in alveolar lavage fluid
2.3 3组大鼠肺泡灌洗液中相关炎症因子分析
采用酶联免疫吸附法检测各组大鼠肺泡灌洗液中 IL-1β及TNF-α、IL-6水平。由实验结果可知:手术组大鼠肺部的 IL-1β、TNF-α、IL-6水平高于假手术组(P<0.05,P<0.01);与手术组相比,PDX处理组的IL-1β、TNF-α、IL-6水平明显下降(P<0.05,P<0.01),见表 3。
2.4 3组大鼠肺组织中氧化应激评价
由实验结果可知:与假手术组相比较,手术组老年大鼠肺组织中MDA和ROS含量显著升高(P<0.05),而SOD活性明显降低(P<0.05);与手术组老年大鼠相比较,PDX处理组老年大鼠肺组织中MDA和ROS含量显著减少(P<0.05),而 SOD 活性明显上调(P<0.05),见表4。
表3 各组大鼠的肺组织灌洗液中的IL-1β、TNF-α及IL-6 水平分析(±s,pg/mL)Table 3 Analysis of IL-1β,TNF-αand IL-6 levels in lung tissue lavage fluid of each group of rats(±s,pg/mL)
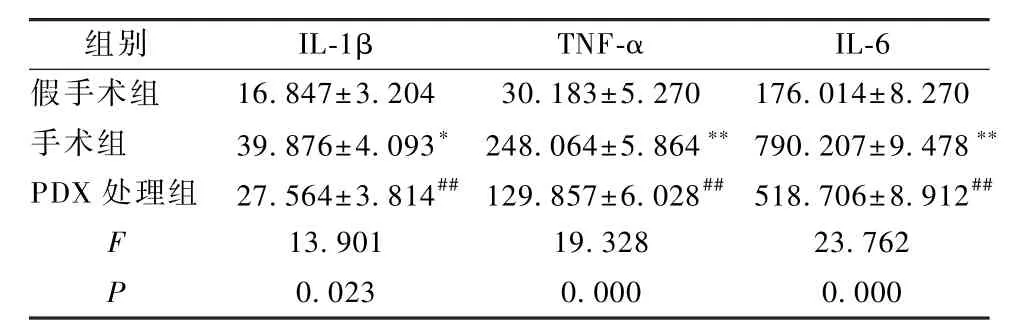
表3 各组大鼠的肺组织灌洗液中的IL-1β、TNF-α及IL-6 水平分析(±s,pg/mL)Table 3 Analysis of IL-1β,TNF-αand IL-6 levels in lung tissue lavage fluid of each group of rats(±s,pg/mL)
注:与假手术组相比,∗P<0.05,∗∗P<0.01;与手术组比较,##P<0.05Note:Compared with sham group,∗P<0.05,∗∗P<0.01;Compared with surgery group,##P<0.05
组别 IL-1β TNF-α IL-6假手术组 16.847±3.204 30.183±5.270 176.014±8.270手术组 39.876±4.093∗ 248.064±5.864∗∗ 790.207±9.478∗∗PDX 处理组 27.564±3.814##129.857±6.028## 518.706±8.912##F 13.901 19.328 23.762 P 0.023 0.000 0.000
表4 各组老年大鼠的肺组织中M DA、ROS 及 SOD 表达水平(±s)Table 4 MDA,ROS and SOD expression levels in lung tissue of aged rats in each group(±s)
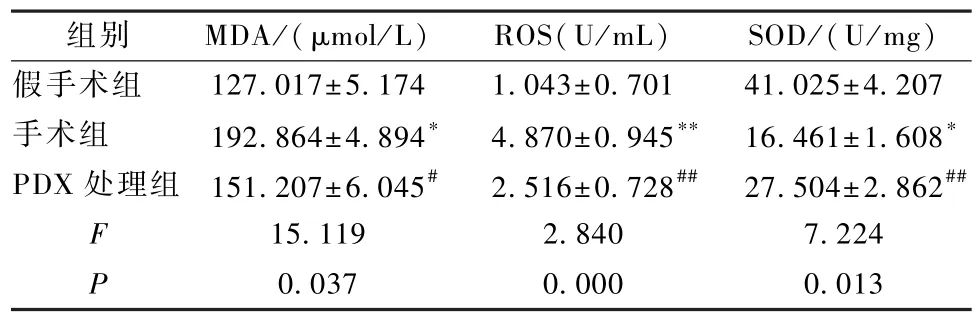
表4 各组老年大鼠的肺组织中M DA、ROS 及 SOD 表达水平(±s)Table 4 MDA,ROS and SOD expression levels in lung tissue of aged rats in each group(±s)
注:与假手术组相比,∗P<0.05,∗∗P<0.01;与手术组比较,#P<0.05,##P<0.01Note:Compared with sham grou,∗P < 0.05,∗∗P < 0.01;Compared with surgery,#P<0.05,##P<0.01
组别 MDA/(μmol/L) ROS(U/mL) SOD/(U/mg)假手术组 127.017±5.174 1.043±0.701 41.025±4.207手术组 192.864±4.894∗ 4.870±0.945∗∗ 16.461±1.608∗PDX 处理组 151.207±6.045# 2.516±0.728## 27.504±2.862##F 15.119 2.840 7.224 P 0.037 0.000 0.013
2.5 3组老年大鼠肺组织中HO-1、NF-κB蛋白的表达情况
由Western blot检测结果可知:与假手术组相比较,手术组大鼠肺组织中NF-κB蛋白的表达水平显著上调(P<0.05),HO-1蛋白的相对表达水平明显下调(P<0.05);与手术组相比较,PDX处理组大鼠肺组织中 NF-κB蛋白的表达水平明显降低(P<0.05),HO-1蛋白的相对表达水平显著提高(P<0.05),见表5、图2。

表5 各组大鼠的肺组织中HO-1及NF-κB蛋白的相对表达水平Table 5 Relative exp ression levels of HO-1 and NF-κB protein in lung tissue of rats in each group

图2 各组大鼠的肺组织中HO-1及NF-κB蛋白的相对表达水平Fig.2 Relative expression levels of HO-1 and NF-κB protein in lung tissue of rats in each group
3 讨论
迄今为止,有关肺叶切除术后肺损伤发生的确切机制尚未被完全阐明,但有大量研究表明肺叶切除手术后氧化应激损伤和炎性因子的大量产生是导致肺损伤主要因素。PDX作为特异性促炎症消退介质,具有强大的抗氧化应激反应和抑制相关炎症因子释放的作用[10-12],但目前尚无有关报道分析PDX对老年大鼠肺叶切除术后肺损伤的保护作用。
本研究通过肺叶切除术构建老年大鼠肺损伤模型来初步探索PDX对老年大鼠肺叶切除术后肺损伤的保护作用,评估肺叶切除术后肺组织的损伤程度,衡量肺组织微血管的通透性和肺组织的水肿程度。实验结果表明,老年大鼠肺叶切除术后存在明显肺损伤现象,而PDX的干预可改善肺损伤的程度,提示PDX对老年大鼠肺叶切除术后肺损伤具有一定的治疗作用。
过度的炎症反应是老年大鼠肺叶切除术后肺损伤发生的重要原因之一,本实验结果表明,肺叶切除术可以使肺组织中的 IL-6、TNF-α、IL-1β均明显升高,提示大鼠肺叶切除术后会产生过度的炎症反应,表现为大量的促炎症因子释放,从而加重肺损伤。PDX的干预可以明显抑制相关炎性因子的释放,减轻肺损伤。有研究表明,肺叶切除术后肺组织会发生明显的氧化应激反应,表现为氧化因子和抗氧化因子水平的异常,过度的氧化应激反应是导致肺损伤的主要诱因之一[13]。本研究结果发现,与假手术组相比较,手术组老年大鼠肺组织中SOD活性降低,ROS和 MDA含量升高(P<0.05),当给予 PDX干预后SOD活性升高,ROS和MDA含量降低,提示PDX可以通过抑制肺组织氧化应激损伤来减轻肺组织损伤。
在机体处于正常的生理条件下,IκBα与 NF-κB的p65亚单位结合形成复合物[14]以无活性的结合型存在于细胞质内。当受到细胞因子、活性氧等刺激后,IκBα发生降解,NF-κB被激活且随之转移到细胞核中,促进基因转录,从而调节炎症信使参与炎症反应[15]。研究发现氧化应激是促进NF-κB 活化的重要因素[16-17],而HO-1是人体内血红素代谢途径中的限速酶,其间接代谢产物具有强大的抗氧化功能[18]。HO-1作为一种保护性蛋白,其抗氧化、抗炎等多种功能已经得到证实[19-20],HO-1对急性肺损伤的炎症反应和氧化应激反应也具有负调节作用[21]。
因此推测PDX对老年大鼠肺叶切除术后肺损伤的保护作用可能与 NF-κB和 HO-1的表达有关。本研究结果表明,肺叶切除术后老年大鼠肺组织中HO-1蛋白的表达较假手术组显著降低(P<0.05),NF-κB蛋白的表达明显增加,PDX的干预可促进HO-1的表达,同时抑制 NF-κB的表达。这提示PDX的干预可抑制机体的氧化应激反应和炎症反应,且这种作用可能与促进HO-1的表达和抑制NF-κB的表达密切相关。
综上所述,老年大鼠肺叶切除术后的肺损伤与机体氧化应激和炎症反应密切相关,且PDX可以通过促进HO-1表达和抑制NF-κB表达减轻老年大鼠肺叶切除术后的氧化应激反应和炎症反应。
