纤维二糖差向异构酶的研究与应用概述
2020-12-23徐铮诸亚锋
徐铮,诸亚锋
(南京工业大学 食品与轻工学院,江苏 南京,211816)
差向异构体是指一对旋光异构体中只有一个手性碳的构型不同,如D-葡萄糖和D-甘露糖,而执行差向异构反应的酶即为差向异构酶(epimerase)[1]。纤维二糖差向异构酶(cellobiose 2-epimerase,CE酶,EC 5.1.3.11)可以有效催化多个底物,如催化纤维二糖产生4-O-β-D-吡喃葡萄糖基-D-甘露糖和4-O-β-D-吡喃葡萄糖基-D-果糖,或催化D-葡萄糖为D-甘露糖和D-果糖,或催化乳糖为乳果糖和依匹乳糖[2]。其中,产物乳果糖(lactulose)其浓缩液形式可作为治疗便秘和肝性脑病的非处方药物[3-7],也可以作为肠道益生元促进结肠中的双歧杆菌和乳酸菌生长,同时抑制沙门氏菌和梭菌等有害菌繁殖[8-11],具有实际应用价值。乳果糖的工业化生产长期以来依靠化学催化法,即通过强碱性的试剂如氢氧化物、硼酸、偏铝酸钠等催化乳糖来实现异构化[12-15],其存在的问题包括转化率低(如使用氢氧化物催化,转化率一般不超过30%)、产生污染、色素和副产物多和产品下游分离困难(如使用硼酸和偏铝酸钠,除硼或除铝则较为困难)等问题[16]。比较而言,生物法制备技术更具有优势。早期发现,β-半乳糖苷酶通过转糖苷作用可以催化乳糖和D-果糖产生乳果糖,但转化率较低,不具备产业化前景[17]。近年来发现CE酶可作为生物法制备乳果糖的工业酶,具有高效、反应条件温和、无污染等优点,已得到了业内的广泛关注。
1 常温型CE酶的研究
常温型CE酶的催化温度较低,一般在30~50 ℃,已报道的酶源包括Ruminococcusalbus、Bacteroidesfragilis、Cellulosilyticumlentocellum、Dyadobacterfermentans、Dysgonomonasgadei、Flavobacteriumjohnsoniae、Pedobacterheparinus、Eubacteriumcellulosolvens、Saccharophagusdegradans等[18-23],这类CE酶催化乳糖的产物只有依匹乳糖(表1)。由于依匹乳糖尚没有商业用途,因此针对这类酶的开发停留在实验室阶段。KREWINKEL等[22]尝试使用常温型CE酶(C.lentocellum和D.gadei来源)催化牛奶超滤液中的乳糖来产生依匹乳糖,催化形式为固定化酶膜反应器EMR,低温(8 ℃)反应,催化28 h后转化率达29.9%。SABURI等[24]利用R.albusNE1来源的CE酶催化乳糖获得依匹乳糖,催化完成后经过4个步骤成功纯化获得了纯度91.1%的依匹乳糖,包括:(1)浓缩结晶法去除大部分乳糖;(2)β-半乳糖苷酶水解剩余乳糖;(3)酵母发酵去除水解产生的单糖;(4)Na-型阳离子交换树脂纯化出依匹乳糖,4个步骤获得依匹乳糖的总收率为42.5%。以上研究表明,利用常温型CE酶制备依匹乳糖的工艺路线已经建立,而针对依匹乳糖性质的研究又表明其具有一定的益生元功效[25-27]。因此,依匹乳糖在未来也可能被开发为一种肠道益生元而为人类健康做出贡献。
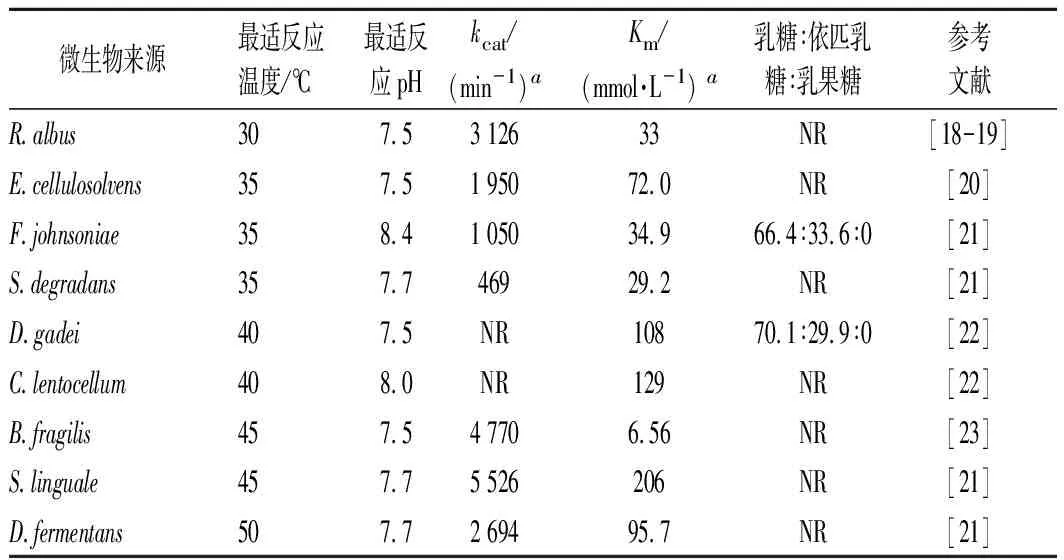
表1 部分常温型CE酶的性质比较Table 1 Comparison of the properties of mesophilic CE enzymes
2 嗜热型CE酶的研究
嗜热型CE酶的催化温度较高,一般在60~85 ℃;已报道的酶源有Caldicellulosiruptorsaccharolyticus、Caldicellulosiruptorobsidiansis、Dictyoglomusturgidum、Dictyoglomusthermophilum、Rhodothermusmarinus、Thermoanaerobacteriumsaccharolyticum等几例[28-37],主要来自于热解纤维素果汁杆菌属、网团菌属、嗜热厌氧杆菌属等(表2)。C.saccharolyticusCE酶简称CSCE,该酶是最早被发现的嗜热型CE酶。PARK等[28]首先发现CSCE可以催化单糖反应,如催化D-葡萄糖产生D-甘露糖以及D-果糖;KIM[29]研究发现CSCE对乳糖的催化效率较高,并且生成了醛酮糖异构化产物乳果糖和差向异构化产物依匹乳糖,这是首次发现β-半乳糖苷酶以外的酶源可以生成乳果糖,而且拥有较高的效率。纯酶酶活力为30 U/mg,仅催化2 h对质量浓度700 g/L乳糖的转化率就达到58%;乳果糖质量浓度为408 g/L,生产强度可达204 g/(L·h),即4.9 kg/(L·d)。如此高的效率表明CE酶已具备商业化应用的潜力,然而该反应会同时产生一定量的副产物依匹乳糖,需要在产品下游分离过程中去除。例如CSCE可以产生15%的依匹乳糖,质量为浓度107 g/L,生产强度54 g/(L·h)[29]。进一步研究发现在催化体系中加入硼酸可以降低依匹乳糖含量,原因是硼酸与乳果糖形成络合物致其脱离反应体系,加速反应平衡向乳果糖生成方向移动,部分依匹乳糖也会转化为乳果糖[33]。然而硼酸的加入量相对较大才能取得显著效果,在下游分离步骤中去除硼的难度大,因此经济性仍有待考察。KIM等[31]挖掘了D.turgidum来源的CE酶(DTCE),该酶最适催化温度70 ℃,最适pH 7.0,催化乳糖产物中依匹乳糖占比12.8%,乳果糖占比54.3%。在70 ℃下的活性半衰期为55 h,kcat为89.4 min-1,Km为79.6 mmol/L,kcat/Km为1.12 L/(mmol·min)。CHEN等[32]研究了C.obsidiansis来源的CE酶(COCE),该酶最适催化温度70 ℃,最适pH 7.5,催化乳糖产物中依匹乳糖占比11%,乳果糖占比54%,其依匹乳糖含量在已报道文献中较低,具有一定的优势。XIAO等[34]通过数据库筛选和计算机模拟分析选择了D.hermophilum来源CE酶(Dith-CE)并进行研究,结果表明Dith-CE的最适催化温度85 ℃,最适pH 7.0,在70 ℃下的活性半衰期为99 h,体现了很强的热稳定性。对已挖掘的嗜热型CE酶,研究者进行了催化工艺的开发,其中全细胞催化是一种较为便捷的方法。WANG等[38]利用乙醇透性化的重组大肠杆菌BL21(DE3)细胞催化生产乳果糖,细胞表达有CSCE基因。反应体系经优化后设为:催化温度80 ℃,pH 7.5,酶用量12.5 U/mL,底物质量浓度600 g/L。乳果糖最高转化率为65.1%,产物质量浓度390.59 g/L,研究还表明反应体系中加入磷酸盐可以降低依匹乳糖的含量。

表2 部分嗜热型CE酶的性质比较Table 2 Comparison of properties of thermophilic CE enzymes
除以上产乳果糖为主的嗜热型CE酶外,R.marinus、Spirochaetathermophila和T.saccharolyticum等来源CE酶也具有较高的催化温度,但产物仅发现依匹乳糖[35-37]。因此,这类嗜热酶催化乳糖后只发生了差向异构化反应,而不具有醛酮糖异构活性,其机理尚未可知。OJIMA等[36]研究了R.marinus来源CE酶(RMCE),该酶最适反应温度80 ℃,最适pH 6.3。该酶对底物乳糖的催化效率高于纤维二糖,分别为3.85和2.97 L/(mmol·s)。PARK等[37]表征了S.thermophila来源CE酶(STCE),该酶最适反应温度60 ℃,最适pH 7.0,在60 ℃的活性半衰期为124 h,催化乳糖后可产生依匹乳糖。CHEN等[35]报道了T.saccharolyticum来源CE酶(Thsa-CE),该酶的最适反应温度60 ℃,最适pH 7.0,纯酶对乳糖的比酶活力为13.5 U/mg。催化200 mmol/L乳糖4 h可产生50 mmol/L依匹乳糖。有趣的是,嗜热型CE酶还可以催化D-葡萄糖来获取D-甘露糖,同时产生副产物D-果糖。显然,这表明嗜热型CE酶对单糖也同时具有差向异构和醛酮糖异构2种活性。PARK等[28]发现CSCE酶催化500 g/LD-葡萄糖后,可获得75 g/L的D-甘露糖与47.5 g/L的D-果糖。近期研究表明D-甘露糖具有较高的抗癌活性[40],因此其具备一定的商业价值,利用嗜热型CE酶生产D-甘露糖的工艺还需要更多的基础研究。
3 CE酶的结构生物学研究
解析酶的结构对于正确理解酶的催化机理,掌握其结构改造规律至关重要。许多工业酶的晶体结构获得了解析,而具有相似性的不同来源酶结构也可以实现以分子模建为手段的计算机辅助分析。CE酶的首个晶体结构由FUJIWARA等[40]完成解析(分辨率2.6 Å,图1),是来源于R.albus的CE酶(RACE),该酶是单亚基酶,实测分子质量43.1 kDa。其总体结构为(α/α)6,即在内部含有6个α螺旋,外部为6个与之反向平行排列的α螺旋,形状接近正六边形;酶的直径55 Å,厚度40 Å,且其中的一侧具有较多的loop状结构(图1中绿色部分),因此具有很大的柔性,活性中心口袋即位于此侧。FUJIWARA等[41]也解析了嗜热型CE酶的RMCE的晶体结构,其中包含多个酶-小分子配体的复合物结构,如依匹乳糖(产物)、纤维二糖醇(底物类似物)、葡萄糖基甘露糖(底物类似物)等。通过复合物晶体结构分析发现RMCE属于烯二醇中间体催化机制,推测其催化纤维二糖的过程如下:在反应开始时,通过H390作为广义酸或碱来打开葡萄糖基糖环(底物为乳糖时同样打开葡萄糖基糖环);开环后再由H390残基夺取糖链中C-2位的质子形成烯二醇中间体(C1-C2间形成双键),然后再由H259提供质子使得中间体发生转化形成开环的产物,最终再经过闭环反应成为终产物;H200也起到了稳定反应中间体的作用[41]。相比较而言,RACE中组氨酸同样是催化残基:H243和H374扮演了广义酸碱催化剂的角色,H184也被发现对催化起到关键作用。因此CE酶的底物催化过程主要是由3个组氨酸残基配合完成的,组氨酸的不同质子化状态使得反应能够以可逆的方式进行[40]。进一步对常温型和嗜热型CE酶在序列上进行了比较(图2,包括RaCE、DgCE、FjCE、EcCE、CoCE、CsCE、DtCE、RmCE),结果表明2种类型的CE酶在序列特征上并没有显著差异。FUJIWARA等[41]认为嗜热型CE酶RMCE在高温下较为稳定是因为酶内部具有较强的疏水相互作用,而且在表面具有较强的亲水相互作用;这分别是因为RMCE具有很高比例的脯氨酸以及精氨酸所致。

图1 RACE的晶体结构Fig.1 Crystal structure of RACE

图2 常温型和嗜热型CE酶的一级序列比较Fig.2 Amino acid sequence analysis among mesophilic and thermophilic CE enzymes
4 CE酶的改造研究
蛋白质工程改造是提升野生型酶性能的有效手段,可通过基于高通量筛选的定向进化或酶结构分析的理性设计方法。已发表文献针对CE酶的改造研究主要集中在提升酶活力、改善热稳定性和降低副产物比例等几个方面,对酶活性中心的重要残基功能进行了预测与验证,结果如表3所示。SHEN等[42]对CSCE酶进行了定向进化改造,利用显色法测定酶活力的步骤作为筛子,筛选到了突变体“G4-C5”。该突变体即五点突变体R5M/A12S/I52V/F231L/K328I,具有3倍于野生型酶的比酶活力(30 U/mg),证明定向进化可以有效提升CE酶的活性。ITO等[43]分析了RACE(该酶以依匹乳糖为催化产物)的重要氨基酸残基,结果表明无论底物是纤维二糖还是乳糖,R52、H243、E246、W249、W304、E308和H374残基都是催化必需残基,F114和W303也对催化有重要贡献。PARK等[44]分析CSCE酶活性中心与甘露糖基团C-2位的作用情况,选择Y114和N184两个残基位点进行饱和突变研究,结果表明在所得突变体中,Y114E催化200 g/L乳糖生产乳果糖的转化率为43.5%(产物浓度质量86.9 g/L),尽管转化率不高但依匹乳糖的质量浓度仅为4.6 g/L(转化率2.3%),这可能是因为突变体丧失了大部分的差向异构化能力。针对热稳定性的突变研究也有报道,SHEN等[45]发现双位点突变E161D/N365P在高温下的活性半衰期提高了4倍,最适反应温度也从80 ℃提高到87.5 ℃,对底物乳糖的催化效率kcat/Km上升了29%。
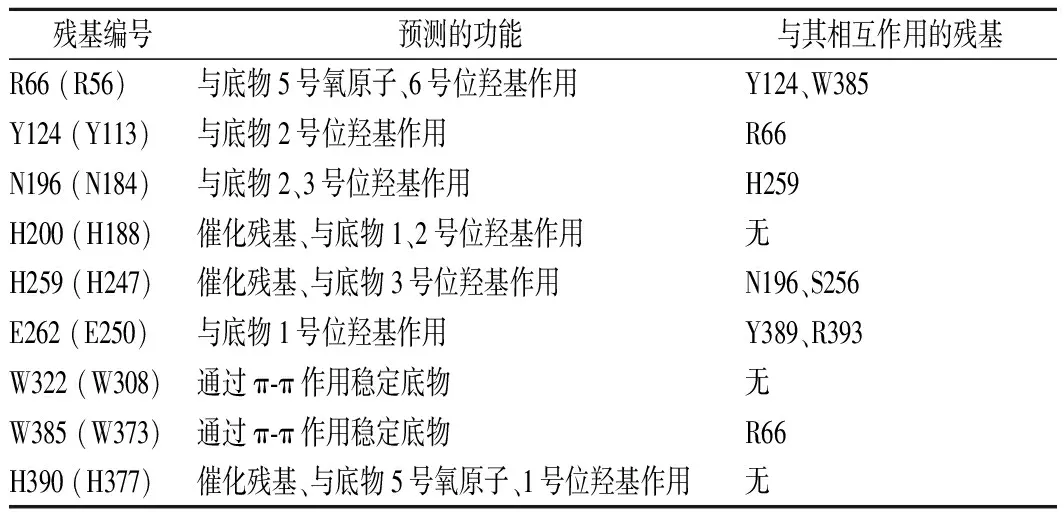
表3 CE酶的分子改造研究结果Table 3 Results of protein engineering on CE enzymes
5 CE酶的固定化研究
固定化酶一般具有远高于游离酶的活性半衰期,因此可以批次使用来实现成本的大幅下降;而且将固定化酶填充于反应器中可以方便操作,提升效率。固定化方法一般有吸附法、包埋法、交联法和共价结合法等,常使用商业化树脂、多孔玻璃珠、海藻酸钠、卡拉胶和聚丙烯酰胺等材料作为固定化载体[46]。针对CE酶,已报道文献主要通过商业化树脂或非常规方法进行固定化。如WANG等[47]利用商业化的陶氏公司DuoliteTMA568树脂固定化CSCE酶,这种树脂属于弱阴离子型,功能基团为-N-(R)2,颗粒大小为150~600 μm。由于CE酶的等电点一般偏酸性,因此在中性条件下带负电可与阴离子树脂结合,并进一步使用戊二醛进行交联。该固定化酶在50 ℃下孵育12 h并未发现活性损失,表现出良好的稳定性。重复使用15个批次以后,固定化酶保留了90%的活性。在催化过程中,固定化酶并未表现出低于游离酶的反应速率,在催化约4 h后反应进入化学平衡状态,最终获得58.3%的转化率,乳果糖质量浓度350 g/L。除常见载体外,微生物孢子也可以作为固定化CE酶的材料,GU等[48]将枯草芽孢杆菌孢子作为载体,利用孢子吸附CSCE酶,1011个孢子的吸附量可达1.47 mg。在4 h内催化乳糖可以获得395 g/L的乳果糖,该固定化酶体系使用8次后可以保留70%的酶活力。WU等[49]利用枯草芽孢杆菌表达系统分泌式表达CSCE酶,并将其固定化于EMR膜反应器,该固定化酶系统具有较好的催化效率及稳定性,以乳清中的乳糖作为底物,经过催化后转化率达到58.5%,并能够批次重复使用10次。以上结果表明CE酶的固定化可以获得良好的效果,但使用批次与商业化的固定化酶相比还有差距,需要进一步的优化研究。
6 不同宿主对CE酶的表达研究
由于大肠杆菌产内毒素而且易感染噬菌体,因此用于生产医药产品或食品会带来一系列问题;开发食品级表达宿主具有重要的学术和经济价值,常见的此类宿主包括枯草芽孢杆菌、毕赤酵母、酿酒酵母、解脂耶氏酵母和乳酸菌等。除了安全性问题以外,开发胞外分泌型表达系统对工业酶的应用极为重要;这是因为胞内酶需要破胞过程才能够更好的实现催化,而破胞后胞内可溶性物质(蛋白质、核酸、脂类等)逸出会污染催化产物,其去除过程费时费力。逸出的蛋白质会加重反应过程中的美拉德反应,给产品下游分离带来困难。常见的分泌型表达系统包括酵母、丝状真菌和枯草芽孢杆菌等,其中丝状真菌的操作难度较大,而酵母和枯草芽孢杆菌具有很大的潜力,针对这类底盘微生物系统的表达研究将是助力CE酶应用的关键问题。其中,韩亮等[50]将CSCE基因在毕赤酵母中表达,获得了有活性的发酵液,诱导144 h后的发酵液上清液酶活力达到0.42 U/mL。对重组酶纯化后发现酶学性质并没有显著变化,证明毕赤酵母系统既可以实现分泌表达又能够保留CE酶的活性。王鑫淼等[51]将嗜热网球菌(D.thermophilum)来源的CE酶基因通过pBSuL3载体转化枯草芽孢杆菌并获得表达,摇瓶最高酶活力达到12.3 U/mL,进一步在3 L发酵罐中获得了56 U/mL的胞内酶活力,比摇瓶提高了8倍。在此基础上添加20 U/mL的酶液催化400 g/L的乳糖能够获得51%的转化率,由此证明枯草芽孢杆菌也是适用于CE酶表达的微生物宿主。
7 展望
CE酶作为近几年来才受到系统性研究的工业酶,已经展现出了规模化应用的潜质。随着我国对环保事业的重视,污染较大的化学法工艺将被逐渐淘汰,利用酶法制备乳果糖的技术进展迅速,有望在不远的将来成为乳果糖的主要制备方法。CE酶具有易表达、稳定性好、催化机理清晰等优势,但也存在酶活力仍不够高,野生型酶易产生副产物依匹乳糖等缺点。因此仍然需要更深入的研究,尤其是广泛挖掘不同来源的CE酶,从中筛选出催化活力更高的酶源。CE酶具有较为独特的催化特性,如常温型CE酶在长时间催化后也可以产生乳果糖,其中的机制尚未有充分的解释;而不产乳果糖的CE酶与高产乳果糖的酶源在一级序列上存在不低的相似度,因此活性口袋中残基位点的区别造成了这种差异,还需要深入的研究。异构酶在工业酶中的成功实例相对较少,其中最知名的是葡萄糖异构酶(glucose isomerase,GI酶)制备果葡糖浆的工艺。根据这项工艺的经验,以固定化酶形式进行催化是非常必要的,主要原因在于异构酶的酶活力在工业酶中并不突出,一般低于水解酶或氧化还原酶等,因此酶的用量较大。制备成固定化酶后可以实现多批次使用,如GI酶固定化后最高可获得数百天的活性半衰期,这对于异构酶工艺的制酶成本控制极为重要[52]。总之,CE酶作为新兴的工业酶,已展现出了巨大的应用潜力,相信该领域的科学研究将为乳果糖等产品的生物法技术提供坚实的理论基础,在不远的将来通过CE酶制备的乳果糖产品能够为医药与食品行业做出贡献。
