河豚鱼皮胶原肽螯合锌的组成与急性毒性研究
2020-12-23郭洪辉陈晖俞云方华陈思谨洪专
郭洪辉,陈晖,俞云,方华,陈思谨,洪专*
1(自然资源部第三海洋研究所 海洋生物资源开发利用工程技术创新中心,福建省海洋生物资源开发利用协同创新中心,福建 厦门,361005)2(南京中医药大学 药学院,江苏 南京,210023)
我国是水产加工和消费大国,水产品总量约占世界总产量的1/3,生产加工过程中会产生大量的鱼副产物,如鱼皮、鱼骨、鱼鳞、鱼头、内脏、碎肉等,约占原料鱼的50%[1]。这些鱼副产物中含有丰富的胶原蛋白,是良好的天然蛋白质来源,如果直接废弃,不仅浪费资源还会增加环境的压力[2]。目前,已有越来越多的研究关注从鱼副产物中提取胶原蛋白、胶原肽并加以开发利用,提高水产加工高值化利用率[3-4]。
水产源胶原蛋白不同于传统工业牲畜类胶原蛋白,往往具有更高的食用安全性[5]。当与钙、锌、铁等微量元素形成螯合物后,可更好地促进微量元素在人体内的吸收利用[6-7],缓解微量元素缺乏所引起的并发症。此外,螯合物还具有抗氧化、抗菌、增强免疫力、降血脂和降血糖等活性,有良好的开发应用前景[8]。
多肽-金属元素螯合物属于新型的有机金属螯合物,尽管构成螯合物的微量元素和多肽都是可食用和安全的,但是也有必要对其毒理学安全性进行科学评估[9]。过量的微量元素摄入会对机体产生危害,如带鱼蛋白亚铁螯合肽在高剂量组会出现试验小鼠死亡[10],通过急性毒性试验得到其半数致死量(lethal dose 50%,LD50)为7.454 8 g/kg。蛋氨酸锌在急性毒性试验期间,高剂量组大鼠全部死亡; 中剂量组大鼠出现部分死亡,测得蛋氨酸锌的LD50值为2.000 g/kg,属于低毒级别[11]。目前关于多肽-金属螯合物的安全性评价数据仍比较缺乏,本研究对河豚鱼皮中提取的胶原多肽与锌的螯合物进行了组成成分分析,并根据《中药、天然药物急性毒性研究技术指导原则》,对其毒理学安全性进行初步评价,为河豚鱼皮胶原肽螯合锌的进一步开发利用提供参考。
1 材料与方法
1.1 材料与试剂
河豚鱼皮胶原肽(CP)、河豚鱼皮胶原肽螯合锌(CP-Zn),实验室自制[12];Superdex peptide10/300GL凝胶色谱柱,美国GE 公司;氨基酸分析柱AminoPacPA10 (2 mm×250 mm)、保护柱AminoPacPA10 (2 mm×50 mm),美国赛默飞世尔科技公司; ICR小鼠(体重18~20 g,实验动物合格证号SCXK (沪) 2013-0006),上海杰思捷实验动物有限公司;标准氨基酸、标准蛋白样品,Sigma公司;其他化学试剂均为分析纯。
1.2 仪器与设备
1.3 实验方法
1.3.1 成分测定
水分含量:直接干燥法(GB/T 5009.3—2010)。灰分含量:马弗炉灰化法 (GB/T 5009.4—2010)。粗蛋白含量:微量凯氏定氮法(GB/T 5009.5—2016)。锌含量:原子吸收光谱法(GB/T 5009.14—2017)。
1.3.2 胶原肽分子质量的测定
1.3.3 基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry, MALDI-TOF MS) 检测
将1 μL 10 mg/mL的样品水溶液与1 μL基质 [20 mg 2,5-二羟基苯甲酸(2,5-dihydroxybenzoic acid,DHB)溶解于1 mL的体积分数50%乙腈-水溶液中]混匀后,滴于不锈钢靶上,室温自然干燥,推入离子源中测定[14]。质谱条件:所用激光为337 nm N2激光光源,激光脉冲3 ns, 加速电压19.0 kV,反射电压15.4 kV。谱图采集模式为正离子反射模式,每张谱图累计600次。
1.3.4 氨基酸组成检测
称取0.1 g样品,用10 mL的6 mol/L的盐酸消化完全后,稀释200倍,用0.44 μm的滤膜过滤备用。采用离子色谱对样品的氨基酸组成进行分析[15],以1 mol/L醋酸钠、250 mmol/L NaOH水溶液为流动相,进样量10 μL,测定样品的氨基酸组成和含量。
1.3.5 急性毒性试验
经预试验,找出0%、100%动物死亡量后,取健康ICR小鼠50只,体质量18~20 g,雌雄各半。随机分为5组,每组10只,各组的河豚鱼皮胶原肽螯合锌(CP-Zn)的剂量为4.513 5、5.506 8、6.723 8、8.209 8、10.024 2 g/kg。给药前,实验小鼠分笼,全价颗粒饲料喂养,自由饮水,室温20~25 ℃,实验室相对湿度60%~70%。试验前禁食(不禁水)12 h,各组分别按上述剂量一次灌胃给药10 mL/kg。观察14 d内动物所发生异常反应、死亡情况及死亡原因,未死亡动物于2周后处死进行尸检。
1.3.6 统计方法
2 结果与分析
2.1 成分分析
由表1可知,CP的蛋白质质量分数为(92.00±1.20)%,在与锌离子螯合后,蛋白质质量分数下降为(82.04±0.68)%,含锌质量分数为(12.86±1.24)%,其蛋白质和锌的含量相对较高,说明CP与锌离子有较强的结合能力[16]。

表1 CP和CP-Zn的主要组成成分Table 1 Main composition of CP and CP-Zn
2.2 分子质量分析
采用凝胶色谱对CP和CP-Zn的分子质量分布进行测定,如图1所示。图1-a是5种标准蛋白的分子质量分布图,按照出峰顺序,从左到右分别为细胞色素 C (M=12 384)、抑肽酶 (M=6 512)、杆菌肽 A (M=1 422)、甘氨酸-甘氨酸-甘氨酸 (M=189)、甘氨酸(M=75)。采用标准蛋白分子质量的对数值对洗脱体积做标准曲线,得到回归方程:lgM=-0.23V+6.490 2 (R2=0.991 1)。通过洗脱体积可计算样品的分子质量分布。由图1-b和图1-c可知,CP的分子质量组成处在标准相对分子质量的低段,主要集中在1 000 Da以内,为小分子的胶原肽,峰值位置为16.1 mL,其分子质量在600 Da附近。从出峰位置判断,CP-Zn的分子质量范围明显要大于CP的分子质量,分子质量分布在200~3 000 Da,峰值位置为14.3 mL,通过回归方程可估算其所在的分子质量约为1 500 Da。图2是CP和CP-Zn的MALDI-TOF 质谱图,通过质谱图可以对CP和CP-Zn的分子质量做进一步的判断。谱图中的纵坐标为离子丰度,横坐标为离子的质荷比。经MALDI-TOF 质谱仪测定CP的准分子离子峰[M+H]+均小于1200, 即CP的相对分子质量主要在1 200 Da内,这与凝胶色谱的测定结果较为吻合[17]。图2-a所示,CP的主峰为质荷比643.243 的离子,对应为[M +H]+,而与锌离子形成螯合物后,在CP-Zn的质谱图中,形成了一个电荷的质荷比为707.404 的特征峰,对应为[M-H+Zn]+。对比得出,多肽[M+H]+结合一个锌变为质荷比为707.404 的峰[M-H+Zn]+,这也表明了多肽螯合锌的生成[18]。
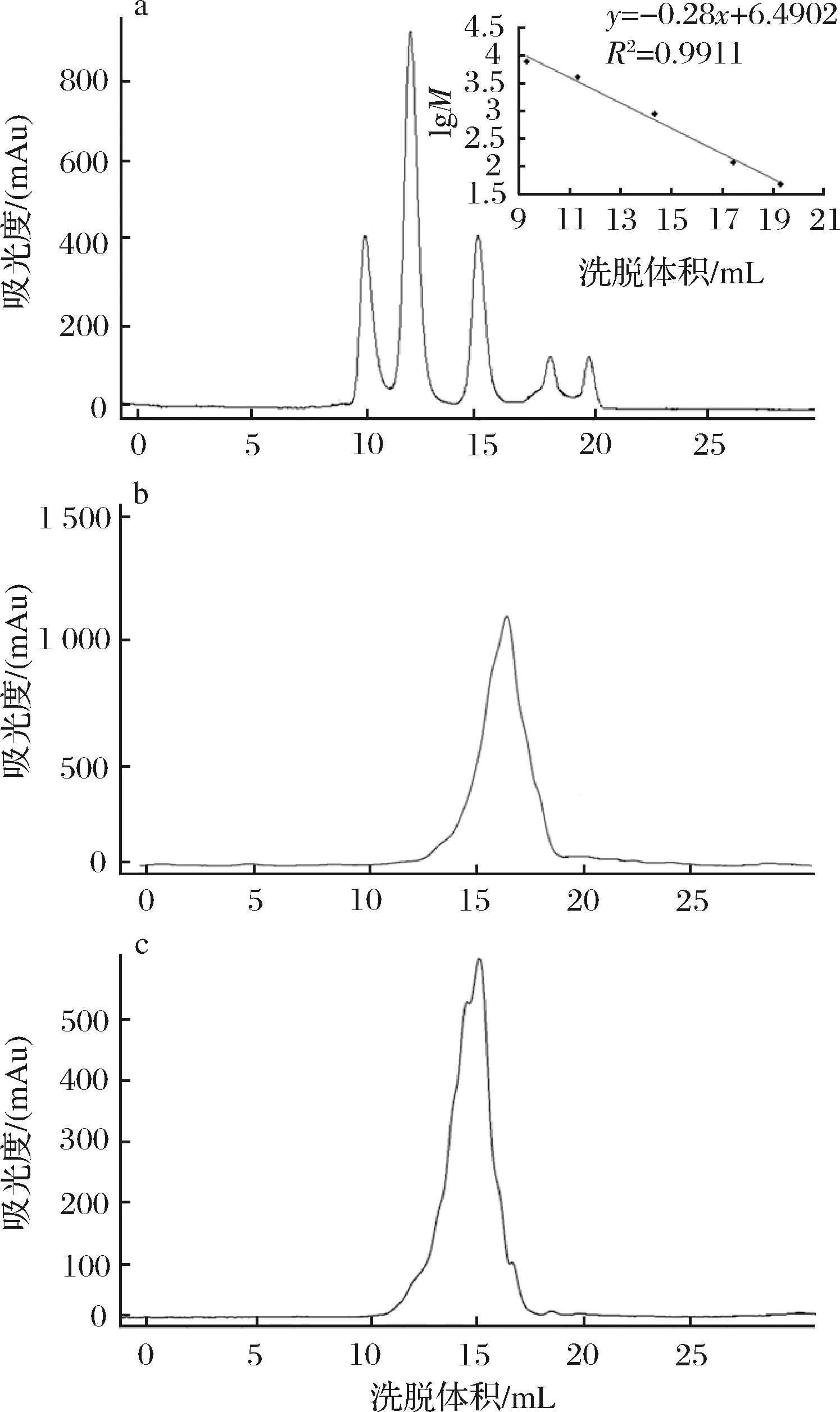
图1 标准蛋白(a), CP(b)和CP-Zn(c)的分子质量分布Fig.1 Molecular weight distribution of standard proteins(a), CP(b) and CP-Zn(c)

图2 CP(a)和CP-Zn(b)的MALDI-TOF 质谱图Fig.2 MALDI-TOF mass spectra of CP (a) and CP-Zn(b)
2.3 氨基酸组成分析
CP和CP-Zn的氨基酸组成及比例测定结果如表2所示。CP和CP-Zn中均能检测出18种氨基酸,其中含量较高的氨基酸分别为甘氨酸、羟脯氨酸、谷氨酸和天冬氨酸。CP中的甘氨酸含量为12.28%,羟脯氨酸的含量为21.65%,占总氨基酸的比例分别为13.67%和24.09%,与Zn2+螯合后,此2种氨基酸的含量也是较为丰富,这基本符合胶原蛋白的氨基酸组成特点[19]。但是从分析结果上看,河豚鱼皮胶原肽中含有丰富的酸性氨基酸,其中天冬氨酸的比例最高为26.16%,谷氨酸为9.27%,与锌螯合后,其比例均有所增加。由于酸性氨基酸侧链的羧基具有较强的金属结合能力,因此天冬氨酸和谷氨酸的羧基很可能成为CP与Zn2+的结合位点[20-21]。CP中总的氨基酸含量为89.86%,而CP-Zn中的氨基酸总含量显著下降,为81.44%, 这是由于CP-Zn中含有大量的锌离子所致[16]。
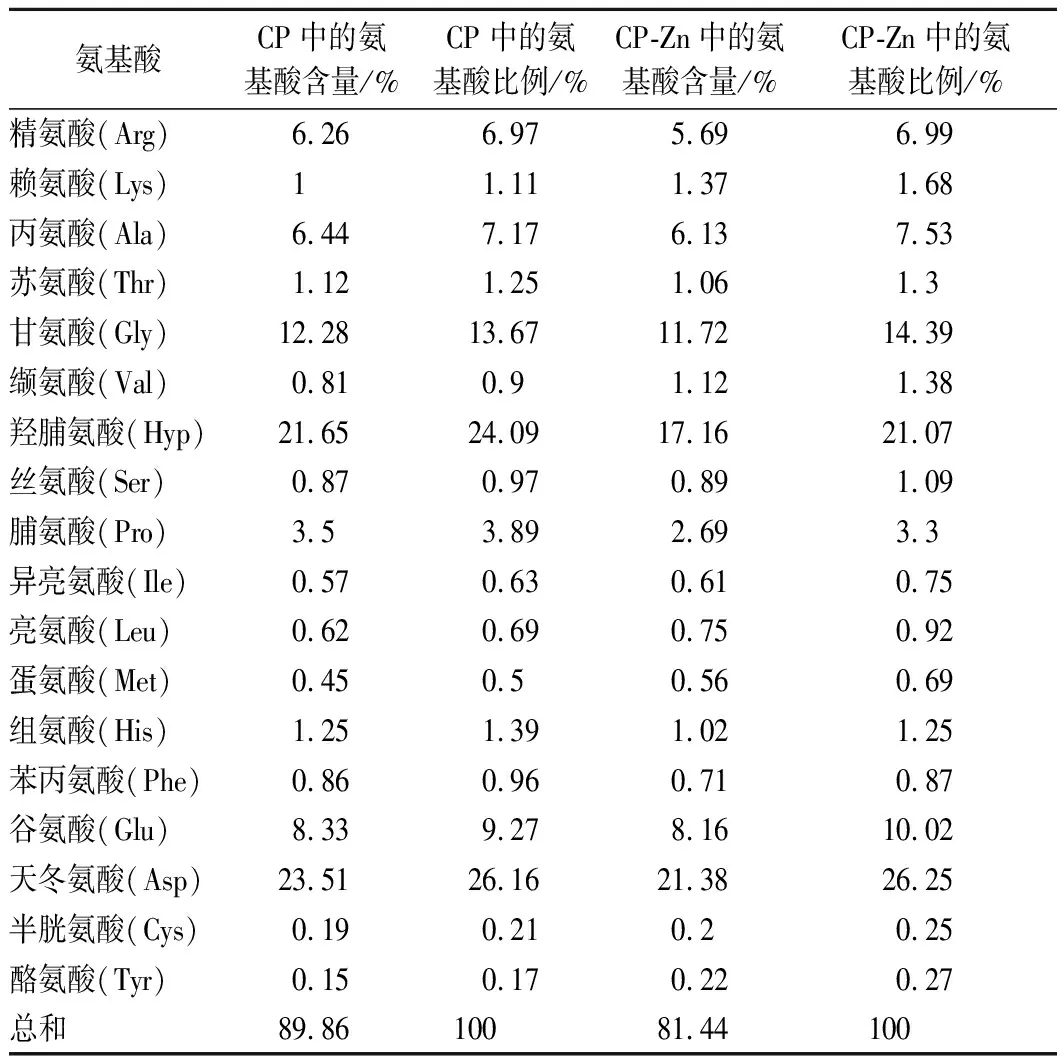
表2 CP和CP-Zn的氨基酸组成及比例Table 2 Amino acid composition and proportion of CP and CP-Zn
2.4 急性毒性试验
给予小鼠CP-Zn后,观察并记录小鼠体质量变化以及各组小鼠的死亡数。由表3可知,在观察期间,小鼠的体质量均有明显增长,但是随着给药剂量的增加,小鼠体质量的总增加量呈减少的趋势。按不同剂量给药的各组小鼠,除4.513 5 g/kg剂量组外均开始有动物死亡(表4),而高剂量组(10.024 2 g/kg)的小鼠在给药后出现活动减少等症状并全部死亡;剂量组5.506 8 ~8.209 8 g/kg也出现小鼠不同程度的死亡,给药剂量增大,小鼠的死亡数也增多。4.513 5 g/kg剂量组的小鼠表现正常。对各剂量组死亡的小鼠及时尸检,肉眼未见心、肝、脾、肺、肾等脏器的异常改变。各组连续观察14 d,计算各组动物死亡总数,按Bliss法计算小鼠的LD50及其95%的可信限,得出CP-Zn的LD50为6.847 9 g/kg,95%的可信限为6.122 4~7.676 5 g/kg。根据《保健食品检验与评价技术规范》(2003年版) 中的急性毒性分级标准,LD50在5.001~15.000 g/kg为实际无毒级别,因此CP-Zn的急性毒性属于实际无毒。对比补锌剂ZnSO4的LD50为0.583 2 g/kg[22],乳酸锌的LD50为0.977~1.778 g/kg[23],蛋氨酸锌的LD50值为2.00 g/kg[11],葡萄糖酸锌的LD50值为2.50 g/kg[24],L-赖氨酸锌的LD50值为3.512 4 mg/kg[25],可看出有机锌的毒副作用明显较无机锌小,而CP-Zn的LD50值较大,说明其具有更高的食用安全性,适合进一步开发用于锌补充剂。
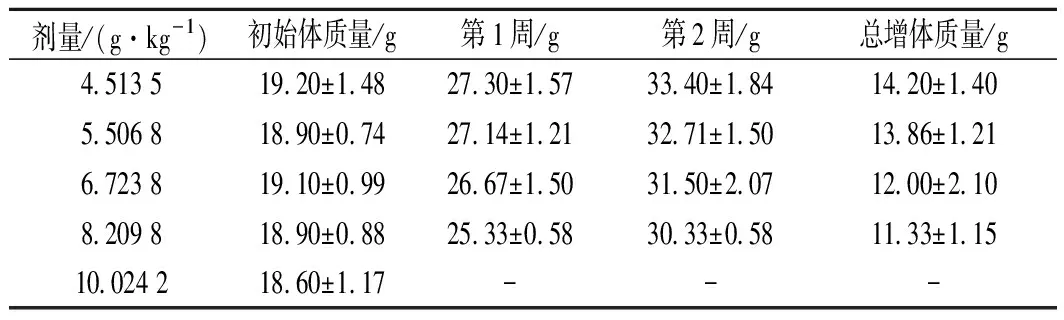
表3 CP-Zn对小鼠体重的影响Table 3 Effect of CP-Zn on body weight of mice
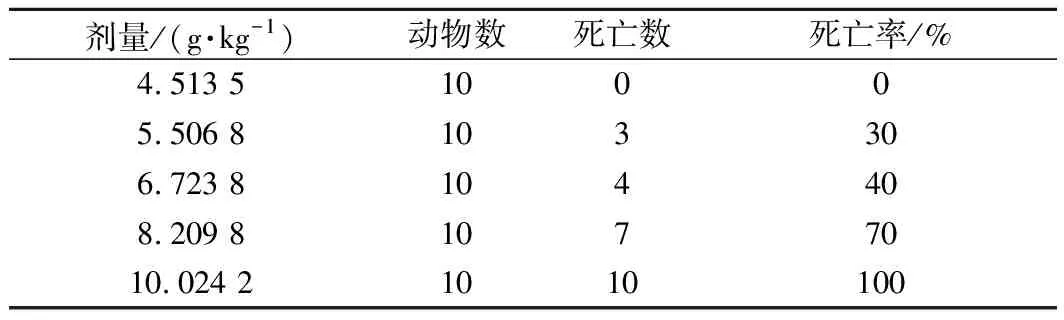
表4 CP-Zn的小鼠经口急性毒性试验结果Table 4 Acute oral toxicity test of CP-Zn on mice
3 结论
从河豚鱼皮中提取制备胶原肽,并与锌螯合得到河豚鱼皮胶原肽螯合锌。河豚鱼皮胶原肽的分子质量基本在1 000 Da以下,主要集中在600 Da附近,为小分子的胶原寡肽,其蛋白质含量为(92.00±1.20)%。氨基酸组成分析显示,河豚鱼皮胶原肽富含甘氨酸、羟脯氨酸、天冬氨酸和谷氨酸。河豚鱼皮胶原肽螯合锌的分子质量分布范围明显要大于胶原肽,其蛋白含量为(82.04%±0.68)%,锌含量为(12.86±1.24)%,MALDI-TOF 质谱图可以说明肽-锌螯合物的生成。急性毒性试验结果显示,河豚鱼皮胶原肽螯合锌的LD50为6.847 9 g/kg,95%的可信限为6.122 4~7.676 5 g/kg,属于实际无毒级,与传统补锌剂ZnSO4、葡萄糖酸锌相比,具有更高的食用安全性,有望进一步开发河豚鱼皮胶原肽螯合锌在食品和医药领域中的应用。
