鼠李糖乳杆菌JS-SZ-2-1抗幽门螺杆菌感染的临床效果评价
2020-12-23张美怡翟齐啸赵建新张灏陈卫
张美怡,翟齐啸,赵建新,张灏,陈卫
(江南大学 食品学院,江苏 无锡,214122)
幽门螺旋杆菌(Helicobacterpylori)感染是消化性胃溃疡、慢性胃炎甚至胃癌等多种消化道疾病的主要致病因素。全球范围内H.pylori的感染率超过50%,且发展中国家的感染率(70%~90%)远高于发达国家(25%~50%)[1-2]。目前,国内外主要采用三联和四联疗法作为H.pylori的治疗方案。但由于抗生素的广泛使用,H.pylori的耐药性、治疗过程中的不良反应、胃肠功能紊乱等问题一直存在[3-4]。因此,寻求非抗生素物质来治疗或辅助治疗H.pylori感染十分重要。研究显示,益生菌、生物活性蛋白、抗氧化剂、植物提取物等膳食成分具有完善或改进现有治疗方案的作用效果[5]。
诸多研究表明鼠李糖乳杆菌、植物乳杆菌、嗜酸乳杆菌和罗伊氏乳杆菌等具有降低H.pylori感染的功效[6-8]。鼠李糖乳杆菌LGG可以体外抑制H.pylori生长,辅助三联治疗可以提高临床H.pylori的根除率[9]。本实验室前期从江苏省昆山市健康人粪便筛选到1株鼠李糖乳杆菌,其在体外模拟的胃液和肠液中处理后的存活率可以达到86.89%,且其抗生素抗性较低,是1株具有较好体外特性的潜力菌株。
本研究拟探究鼠李糖乳杆菌JS-SZ-2-1(鼠李糖乳杆菌CCFM1119)抗H.pylori感染的效果,首先通过其抑制H.pylori生长和黏附作用进行体外评价,再通过临床实验进一步探究其缓解患者H.pylori感染的作用效果,以期开发一种用于干预治疗H.pylori感染的食疗性乳杆菌。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株和细胞株
LGG来源于美国模式培养物集存库(American Type Culture Collection,ATCC),其他乳杆菌是从中国健康人粪便分离并保藏于江南大学食品生物技术中心菌种保藏库;H.pyloriSS1受赠于南方医科大学陈烨教授团队;人胃腺癌细胞(human gastric adenocarcinoma cell line,AGS)购买自中国科学院上海细胞库。
1.1.2 主要试剂
哥伦比亚琼脂培养基,英国OXOID公司;脱纤维绵羊血,杭州新锐公司;F-12培养基、胎牛血清,美国Gibco公司;尿素,江苏博美达生命科学公司;苯酚红,国药集团化学试剂公司;人胃蛋白酶原(pepsinogen,PG)、IL-8、TNF-α ELISA试剂盒,南京福麦斯公司。
1.1.3 主要设备
PB300-N电子天平,上海Mettler Toledo公司;HWS-150恒温恒湿培养箱,上海一恒科技有限公司;i160三气培养箱,美国Thermo公司;MLS-3 750高压蒸汽灭菌锅,日本SANYO公司;BSC-1 000ⅡA2生物安全柜,苏州安泰空气技术有限公司。
1.2 实验方法
1.2.1 乳杆菌抑菌能力的测定
参考RYAN等[10]的方法。乳杆菌活化2代,菌悬液经0.22 μm无菌滤膜过滤,得到乳杆菌发酵上清液。活化2代的H.pylori菌悬液调整为108CFU/mL,取100 μL涂布于哥伦比亚血平板,牛津杯中加入150 μL乳杆菌发酵上清液。正置于三气培养箱中培养72 h,测定抑菌圈直径,每个样本做3个平行实验。
1.2.2 乳杆菌抑制H.pylori粘附能力的测定
实验参考PASTENE等[11]的方法。AGS细胞接种于96孔板(2×104个/孔)过夜培养,待细胞贴壁后以感染复数100加入F-12重悬的H.pylori和乳杆菌分别共培养2 h,再加入200 μL尿素酶试剂培养3 h,测定550 nm波长的吸光值,每个样本做6个平行实验。
1.2.3 临床受试者选择标准
招募受试者为通过13C/14C呼气试验(urea breath test,UBT)、快速尿素酶或组织学检查,于入组3个月内诊断为H.pylori感染,且既往未进行抗H.pylori治疗的患者。若患者在纳入研究前的1个月内服用了抗生素或乳杆菌产品、既往有胃肠道手术史、有历史性的严重疾病或者精神疾病将被排除在外。
1.2.4 临床实验设计
本研究于2019年在江苏省盐城市亭湖区人民医院开展,研究通过了伦理审核(编号:ET2019033),并注册于中国临床试验注册中心(注册号:ChiCTR1900024938)。实验招募了26名H.pylori阳性患者,通过随机序列将受试者随机分为2组,即安慰剂和鼠李糖乳杆菌JS-SZ-2-1组。患者每天早晚2次服用菌粉(5×109CFU/g,2 g/包)或安慰剂产品,为期1个月。
1.2.5 临床检测指标
1.2.5.114C呼气值的测定
受试者在实验开始前1 d和结束后1 d通过14C呼气检测仪测定呼气值。
1.2.5.2 胃肠症状评分的测定
参考SVEDLUND等[12]设计的胃肠症状评分量表(gastrointestinal symptom rating scale,GSRS),分别于实验开始前1天与结束后1天填写。
1.2.5.3 PG水平的测定
2次体检均收集受试者的血液样品,离心后取血清。具体的测定方法参照ELISA试剂盒进行。
1.2.5.4 免疫因子水平的测定
血清中IL-8和TNF-α水平的测定参照ELISA试剂盒进行。
1.2.5.5 肠道菌群的测定
实验结束后收集受试者粪便样品提取粪便DNA,参考MAO等[13]的方法PCR扩增细菌16S rDNA的V3~V4区,纯化后以等质量浓度混合构建基因文库,通过Illumina MiSeq 测序仪上机测序。
1.2.6 数据分析
2 结果与分析
2.1 鼠李糖乳杆菌JS-SZ-2-1抑制H. pylori生长及黏附的作用效果
乳杆菌抑制H.pylori生长和黏附是目前测定乳杆菌体外抑菌效果的主要指标。除鼠李糖乳杆菌492外,其他几株鼠李糖乳杆菌都可以抑制H.pylori生长,其中JS-SZ-2-1的抑菌圈达到了12.92 mm,与阳性菌株LGG抑菌效果类似。然而将乳杆菌上清液pH调至7.00后,所有乳杆菌均未出现抑菌圈,说明乳杆菌抑制H.pylori生长主要是酸或酸依赖性成分的作用[14]。与此同时,鼠李糖乳杆菌JS-SZ-2-1处理后H.pylori对AGS的黏附率显著下降。研究报道乳杆菌抑制黏附可能与乳杆菌的空间位阻作用[15]或其对黏附基因表达的抑制作用[16]相关。鼠李糖乳杆菌JS-SZ-2-1体外抗H.pylori感染的效果在这几株菌中最优。

表1 鼠李糖乳杆菌JS-SZ-2-1抑菌能力和降低H. pylori黏附AGS的能力Table 1 The antibacterial ability of L.rhamnosus JS-SZ-2-1 and ability to reduce adhesion of H. pylori to AGS
2.2 临床实验入组受试者基线信息
临床实验共招募了26名符合要求的H.pylori阳性患者,表2显示了2组入组人群年龄、男女比例等基本信息,2组受试者基线情况无显著性差异。
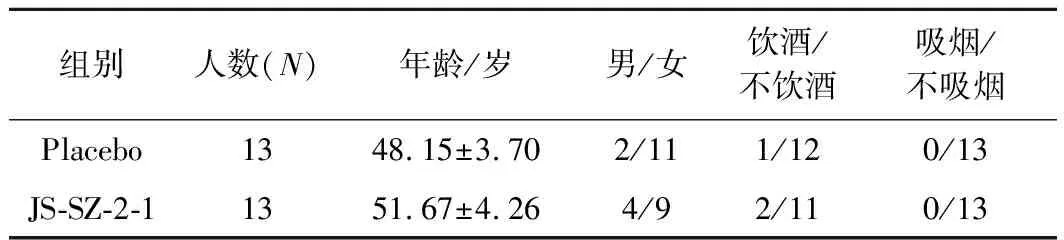
表2 入组受试者基线信息Table 2 Basic information of the enrolled population
2.3 鼠李糖乳杆菌JS-SZ-2-1对受试者体内H.pylori定殖量的影响
测定13C/14C量可以表征患者H.pylori的感染情况,13C/14C呼气是诊断H.pylori感染最准确的无创方法[17-18]。由图1可知,安慰剂组呼气值前后无变化,而鼠李糖乳杆菌JS-SZ-2-1组患者的呼气值显著降低(△UBT 1.82 vs 106.00)。临床定义14C表征H.pylori感染的临界值为100,呼气值<100即可认为不存在H.pylori感染。从表3可知,服用乳杆菌1个月后,鼠李糖乳杆菌JS-SZ-2-1组患者的根除率与安慰剂组相比显著提高(61.54% vs 15.38%,P<0.05)。CRUCHET等[19]证明服用4周约氏乳杆菌La1后H.pylori的清除率达到40%,与本研究结果相似,而LEE等[20]发现服用4周混合菌株后患者的H.pylori并未清除,这一结果可能是由菌株特异性所导致。人体胃部pH较低,胃酸会杀死大部分经口进入胃部的细菌,而鼠李糖乳杆菌JS-SZ-2-1具有较强的耐酸性,且其发酵液中含有抑制H.pylori的物质,还可以阻碍H.pylori黏附于胃黏膜,故可降低患者胃内H.pylori定殖,从而缓解H.pylori感染,提高患者根除率。
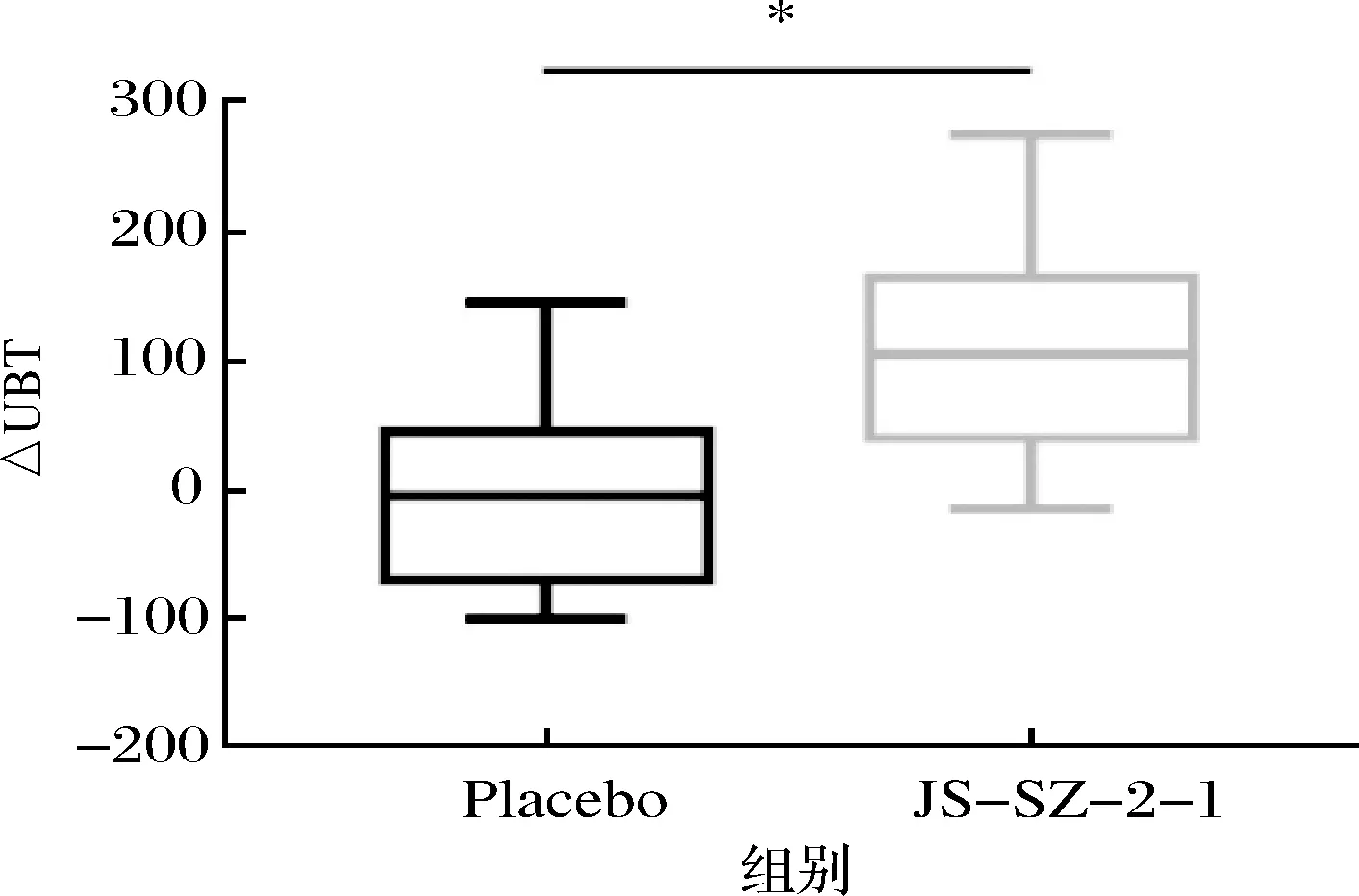
图1 鼠李糖乳杆菌JS-SZ-2-1对患者呼气降低值的影响Fig.1 Reduction in value of UBT with the supplementation of L.rhamnosus JS-SZ-2-1注:*表示2组间存在显著性差异,P<0.05
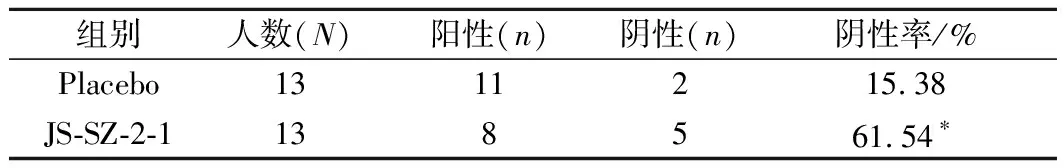
表3 鼠李糖乳杆菌JS-SZ-2-1对H.pylori的根除率的影响Table 3 Effect of L.rhamnosus JS-SZ-2-1 on the eradication rate of H.pylori
2.4 鼠李糖乳杆菌JS-SZ-2-1缓解GSRS的作用效果
GSRS是临床患者胃肠症状严重程度和频率的重要指标,评分越低则症状越轻。2组治疗前GSRS均在6.00以上,组间无显著性差异。服用乳杆菌1个月后,安慰剂组GSRS无变化(5.15±1.35),而JS-SZ-2-1组评分降至2.27,症状显著改善。实验结果表明,鼠李糖乳杆菌JS-SZ-2-1具有改善胃肠症状的作用,这可能与食用乳杆菌后H.pylori定殖量的减少有关。FRANCAVILLA等[21]发现罗伊氏乳杆菌ATCC 55730有类似的作用效果。
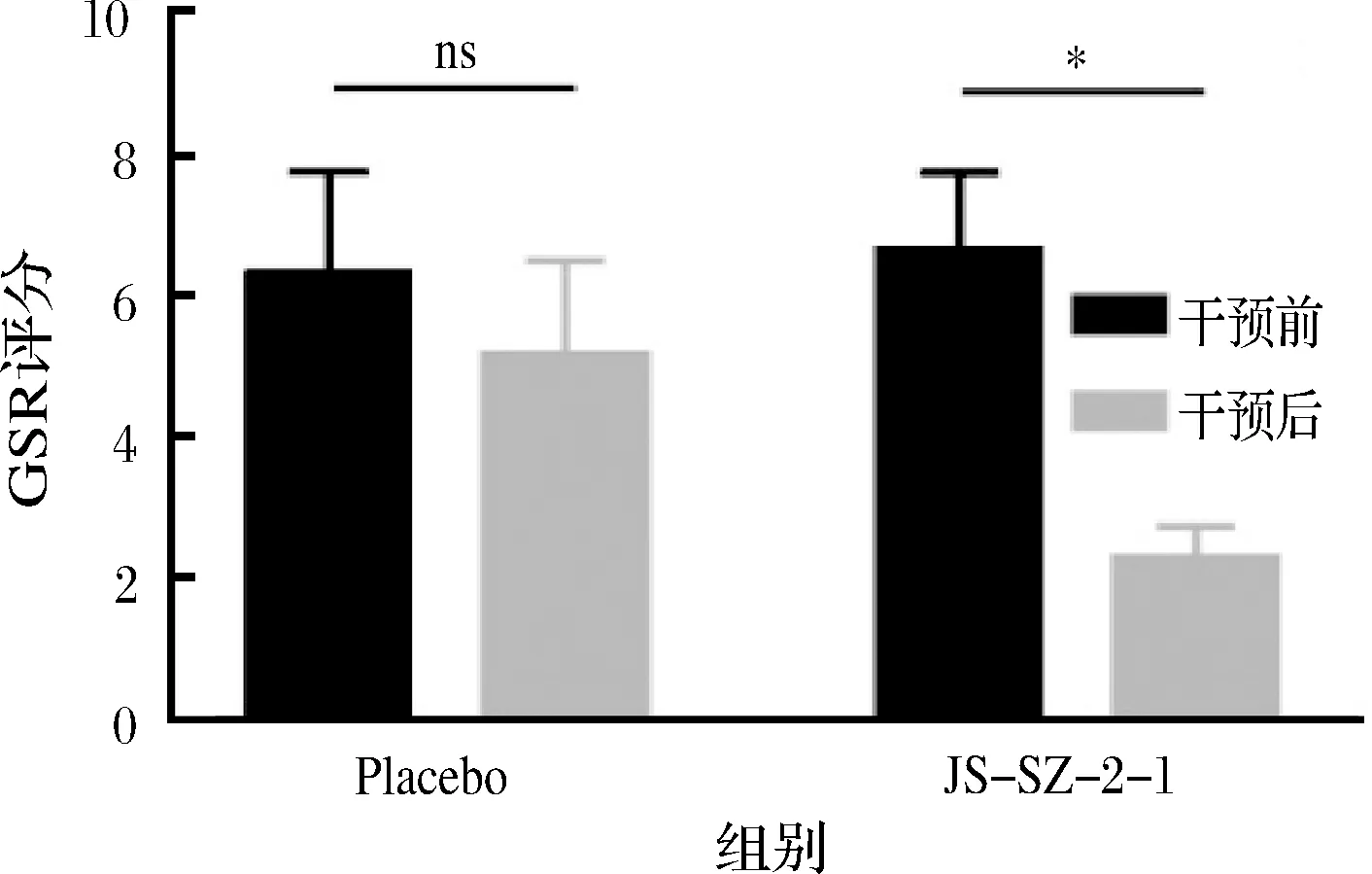
图2 各组干预后GSRS的变化情况Fig.2 The comparison of GSRS after intervention between groups注:ns表示2组间无显著性差异,*表示2组间存在显著性差异,P<0.05
2.5 鼠李糖乳杆菌JS-SZ-2-1对血清PG水平的影响
不同病变阶段,血清PG的含量不同,其反映胃黏膜分泌功能的强弱,进一步反映胃黏膜状态[22]。在本研究中,2组治疗前PGⅠ/PGⅡ的水平均在6.50左右。乳杆菌干预1个月后,PGⅠ/PGⅡ比值均增高到7.50以上,但2组治疗前后比值的变化并无显著差异性,即鼠李糖乳杆菌JS-SZ-2-1对患者血清PG水平无显著影响。FRANCAVILLA等[23]的研究结果与本研究相似,而IGARASHI等[24]的研究指出摄入格氏乳杆菌会增加PGⅠ水平。然而目前尚未有文献报道乳杆菌影响PG水平的具体机制,这一方面需要进一步的研究。
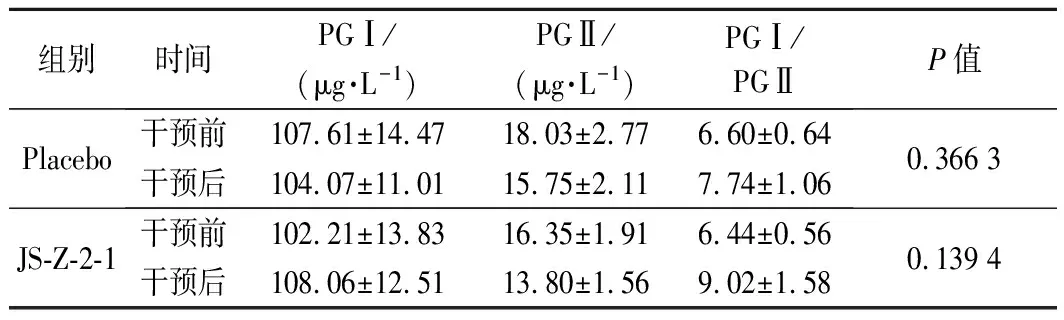
表4 各组治疗后患者血清PG水平的变化情况Table 4 Levels of PG in patients after treatment between groups
2.6 鼠李糖乳杆菌JS-SZ-2-1对血清炎症因子水平的影响
研究表明,H.pylori感染后70%以上的人都会出现无症状的慢性活动性胃炎[25],H.pylori会刺激机体产生多种细胞因子(如IL-8和TNF-α),并进一步引发炎症。本研究治疗前2组的IL-8和TNF-α水平均在11~13 ng/L,组间差异不显著。乳杆菌干预1个月后,2组IL-8和TNF-α的水平均无显著变化(P>0.05),即鼠李糖乳杆菌JS-SZ-2-1对调节H.pylori感染患者免疫反应的效果不明显。乳杆菌具有降低H.pylori毒力因子表达,调节机体免疫等作用,然而产生的免疫反应因菌株特异性而不尽相同[26]。
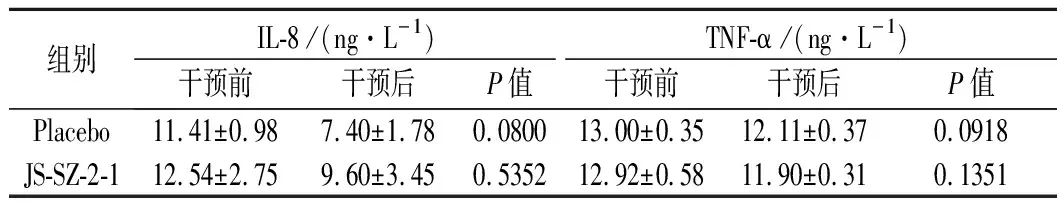
表5 各组治疗后免疫因子水平的变化情况Table 5 Levels of immune factors after treatment between groups
2.7 鼠李糖乳杆菌JS-SZ-2-1对受试者肠道菌群的影响
H.pylori感染会引起体内多处菌群的改变,综合考虑采样的可操作性和方便性,本研究以肠道菌群为代表探究乳杆菌干预后对胃下游微生态的调节作用。
乳杆菌干预后,乳杆菌组与安慰剂的Shannon指数(图3-a)无明显差异,这说明乳杆菌干预并不会影响肠道菌群的α多样性。图3-b显示的2组聚集区域相互重叠,说明乳杆菌干预对菌群的β多样性影响也不大。
乳杆菌干预1个月后,两组受试者肠道菌群门水平结构无明显变化。在属水平上,相较于安慰剂组,Lactobacillus丰度无变化,Parasutterella和Lachnospir-aceaeNK4A136 group丰度降低,ErysipelotrichaceaeUCG-003丰度升高。Parasutterella与慢性功能性胃肠疾病的发展有关[27],LachnospiraceaeNK4A136 group与代谢相关[28],其丰度的降低对胃肠症状的改善可能有积极作用,而ErysipelotrichaceaeUCG-003在健康老年人肠道数量较多,有助于降低非健康老化的风险[29]。以上结果说明,鼠李糖乳杆菌JS-SZ-2-1干预后对肠道菌群有一定的调节作用,这可能是其改善胃肠症状的一个重要因素。
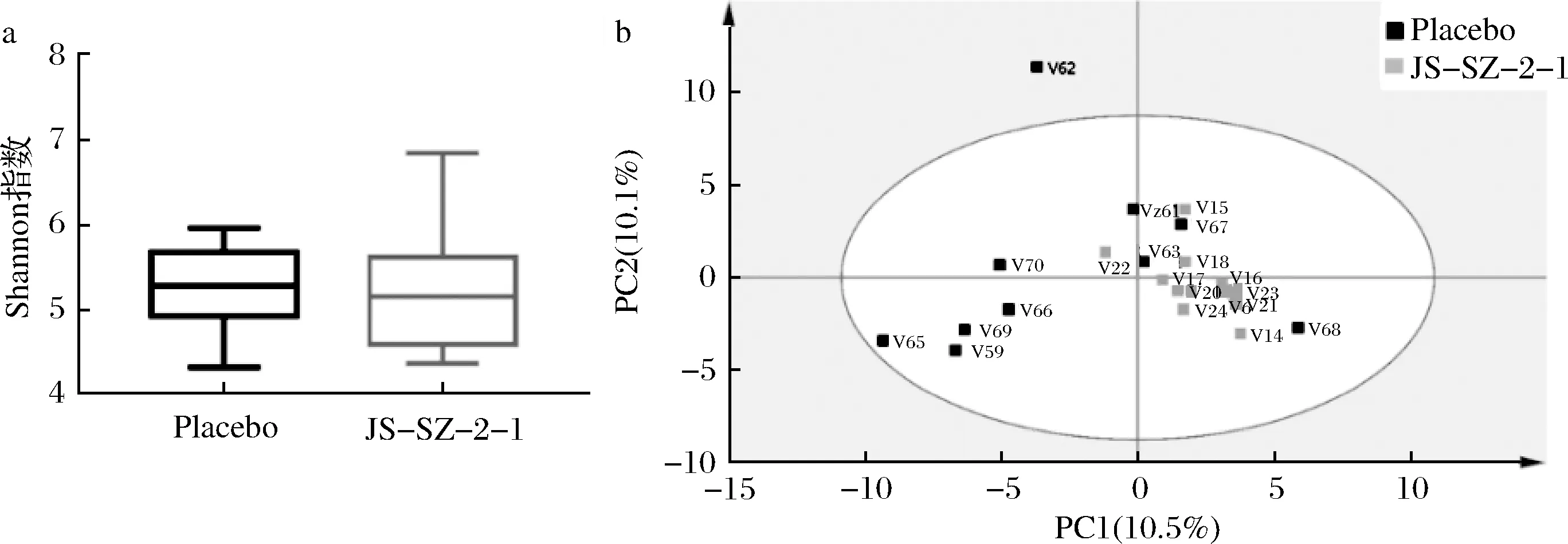
a-菌群α多样性;b-菌群β多样性图3 肠道菌群多样性Fig.3 Diversity of gut microbiota
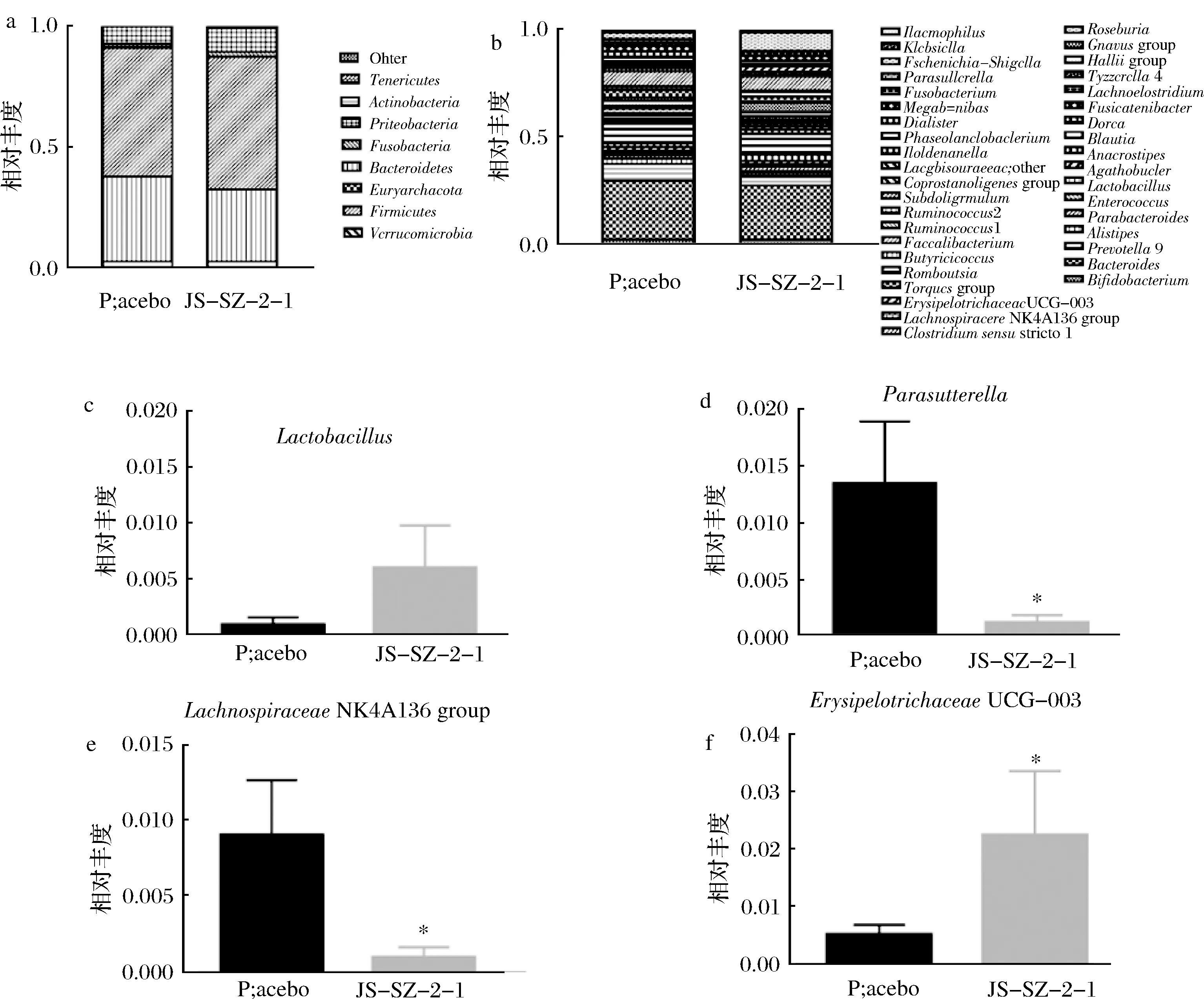
a-肠道菌群门水平组成;b-肠道菌群属水平组成;c-Lactobacillus相对丰度;d-Parasutterella相对丰度;e-Lachnospiraceae NK4A136 group相对丰度;f-Erysipelotrichaceae UCG-003相对丰度图4 肠道菌群组成分析Fig.4 Composition of gut microbiota注:*表示与安慰剂组相比存在显著性差异,P<0.05
3 结论
鼠李糖乳杆菌JS-SZ-2-1体外抑制H.pylori生长能力和降低其对AGS的黏附作用效果显著。在临床试验中,鼠李糖乳杆菌JS-SZ-2-显著降低了受试者14C呼气值(△UBT=106)和GSRS评分,调节了患者的肠道菌群,然患者血清PG水平和IL-8、TNF-α免疫因子水平无明显变化。综上所述,鼠李糖乳杆菌JS-SZ-2-1能够降低患者体内H.pylori的定殖量,有效缓解H.pylori感染和其导致的胃肠症状,但对免疫调节的作用效果并不显著。
