Treg和Th17在卵巢癌患者外周血中的意义及与预后的相关性分析①
2020-12-23李元昆崔金全廖予妹鲁笑钦顾晓荔
李元昆 崔金全 廖予妹 鲁笑钦 胡 滨 顾晓荔
(郑州大学第二附属医院妇科,郑州 450000)
卵巢癌是临床常见的女性生殖系统恶性肿瘤,发病率仅次于宫颈癌及宫体癌,病死率居于妇科恶性肿瘤首位[1]。卵巢癌起病隐匿,确诊时多数患者已进展至中、晚期,病情进展迅速、预后生存期短[2]。因此,了解卵巢癌发病机制,寻找有效预测疾病预后的肿瘤标志物对疾病诊疗具有重要意义。研究表明,免疫失衡可能参与卵巢癌的发生和发展,但具体调控机制尚未明确[3]。CD4+T淋巴细胞亚群中调节性T细胞(regulatory T cells,Treg)与辅助性T细胞17(helper T cells 17,Th17)处于平衡状态,疾病状态下两者在外周血中数量、功能均发生异常,近年来Th17与Treg平衡状态与肿瘤的关系报道较多,但关于其在卵巢癌发生发展中的可能作用报道较少,需要进一步研究探讨[4,5]。本研究通过流式细胞术检测各临床分期卵巢癌患者及健康体检者外周血中Th17、Treg、Th17/Treg细胞百分率,分析二者在卵巢癌发生发展中的可能作用,并采用Logistic回归分析法分析导致卵巢癌预后死亡的危险因素,明确Th17、Treg、Th17/Treg细胞百分率与疾病预后死亡的相关性,以期为临床诊疗提供参考。
1 资料与方法
1.1资料
1.1.1一般资料 选取2015年10月~2016年9月郑州大学第二附属医院收治的105例卵巢癌患者设为卵巢癌组,年龄32~71岁,平均年龄(50.82±6.15)岁;按照国际妇产联合会(International Federa-tion of Gynecology and Obstetrics,FIGO)卵巢癌临床分期分为Ⅰ期17例,Ⅱ期27例,Ⅲ期41例,Ⅳ期20例[6];组织分型为浆液性囊腺癌79例,黏液性囊腺癌20例,子宫内膜样癌6例;单侧肿瘤41例,双侧肿瘤64例。所有患者均经病理证实为卵巢癌,排除其他类型恶性肿瘤、自身免疫性疾病、感染性疾病、合并严重肝肾功能障碍者。所有患者治疗均以手术切除为主,术后辅助化疗时间≤6个疗程者63例,>6个疗程者42例;术后残存病灶≤1 cm者51例,>1 cm 者54例。另取同期体检中心45例健康体检者为健康组。本研究获得医院伦理委员会批准, 所有受试者均签署知情同意书。
1.1.2试剂与仪器 RPMI1640培养液(武汉普诺赛生命科技有限公司);氟波酯、离子霉素、布雷杆氏菌素A(美国Sigma公司);破膜剂(美国Invitrogen公司);CD4-FITC、Alexa Fluor647 IL-17、PE-Foxp3单克隆抗体(美国Abcam公司);BD LSRFortessa X-20型流式细胞仪(美国BD公司)
1.2方法
1.2.1标本收集、外周血单个核细胞分离及培养 所有患者采集静脉血前均未进行手术、化疗及免疫治疗。采集卵巢癌患者及健康受试者空腹静脉血5 ml,肝素抗凝,2 h内处理完毕。取100 μl肝素抗凝血,加入100 μl RPMI1640培养液混匀,加入10 μl浓度为25 μg/L的氟波酯工作液、10 μl浓度为1.0 g/L 的离子霉素工作液、20 μl浓度为1.7 g/L的布雷杆氏菌素A工作液,混匀后于37℃、5%CO2条件下刺激培养3 h备用。
1.2.2Th17、Treg细胞检测 取刺激培养3 h的全血细胞600 μl,2 000 r/min离心2 min,取沉淀细胞,加入10 μl CD4-FITC单抗,避光孵育15 min,PBS洗涤后加入100 μl固定液,避光孵育15 min,PBS再次洗涤、离心后,取沉淀细胞,加入100 μl破膜剂,轻柔混匀,避光孵育5 min,加入10 μl Alexa Fluor647 IL-17抗体(或10 μl PE-Foxp3抗体),混匀后避光孵育15 min,PBS再次洗涤细胞,离心取沉淀细胞后,流式细胞术检测Th17、Treg细胞百分率。
1.2.3临床资料统计 查阅病例及复诊记录,统计可能影响患者预后生存的相关因素,包括年龄、是否绝经、肿瘤位置、组织分型、组织分化程度、临床分期、残存病灶大小(手术切除后病灶大小)、化疗疗程、Th17、Treg、Th17/Treg细胞百分率。
1.2.4随访 以电话或复诊方式随访,随访统计患者3年期间生存情况,以有明确病理学诊断的确诊时间为起始时间,以死亡或随访截止时间(3年)为终止。所有患者均完成随访,无失访病例。将3年内死亡患者纳入死亡组,其余为生存组。
1.2.5Logistic回归分析法赋值 分别以是否绝经(是=0、否=1)、肿瘤位置(单侧=0、双侧=1)、组织分型(浆液性囊腺癌=0、黏液性囊腺癌=1、子宫内膜样癌=2)、组织分化程度(高分化=0、中分化=1、低分化=2)、临床分期(Ⅰ~Ⅱ期=0、Ⅲ~Ⅳ期=1)、残存病灶大小(≤1 cm=0、>1 cm=1)、化疗疗程(>6=0、≤6=1)及连续变量年龄、Th17、Treg、Th17/Treg细胞百分率等可能导致患者死亡的因素为自变量,以生存情况(生存=0、死亡=1)为因变量进行多因素Logistic回归分析。
1.2.6观察指标 ①健康组与卵巢癌组Th17、Treg、Th17/Treg细胞百分率比较;②不同临床分期卵巢癌患者Th17、Treg、Th17/Treg细胞百分率比较;③Th17、Treg、Th17/Treg细胞百分率及其他可能影响卵巢癌预后的因素比较;④影响卵巢癌预后因素的Logistic回归分析。

2 结果
2.1健康组与卵巢癌组Th17、Treg、Th17/Treg细胞百分率比较 卵巢癌组Th17百分率[(2.94±0.61)%]高于健康组[(1.05±0.24)%],差异有统计学意义(t=20.097,P<0.001);卵巢癌组Treg百分率[(13.65±1.44)%]高于健康组[(5.80±1.01)%],差异有统计学意义(t=33.206,P<0.001);卵巢癌组Th17/Treg细胞百分率[(21.54±2.47)%]高于健康组[(18.10±2.01)%],差异有统计学意义(t=8.241,P<0.001)。
2.2不同临床分期卵巢癌患者Th17、Treg、Th17/Treg细胞百分率及Th17/Treg比较 Ⅲ~Ⅳ期患者Th17百分率为[(3.05±0.70)%],高于Ⅰ~Ⅱ期患者的[(2.79±0.41)%],差异有统计学意义(t=2.204,P=0.030);Ⅲ~Ⅳ期患者Treg百分率为[(14.14±2.17)%]高于Ⅰ~Ⅱ期患的[(12.97±1.35)%],差异有统计学意义(t=3.160,P=0.002);Ⅲ~Ⅳ期患者Th17/Treg细胞百分率为[(21.57±2.32)%],Ⅰ~Ⅱ期患者为[(21.51±2.67)%],差异无统计学意义(t=0.123,P=0.903)。
2.3可能影响卵巢癌预后的因素比较 随访3年均无脱落患者,3年存活率为68.57%(72/105);死亡组和存活组患者年龄、是否绝经、肿瘤位置、组织分型及分化程度分布情况比较差异均无统计学意义(P>0.05);死亡组临床分期Ⅲ~Ⅳ期、残存病灶>1 cm、化疗≤6个疗程患者构成比及Th17、Treg、Th17/Treg细胞百分率均高于存活组,差异均有统计学意义(P<0.05,表1)。
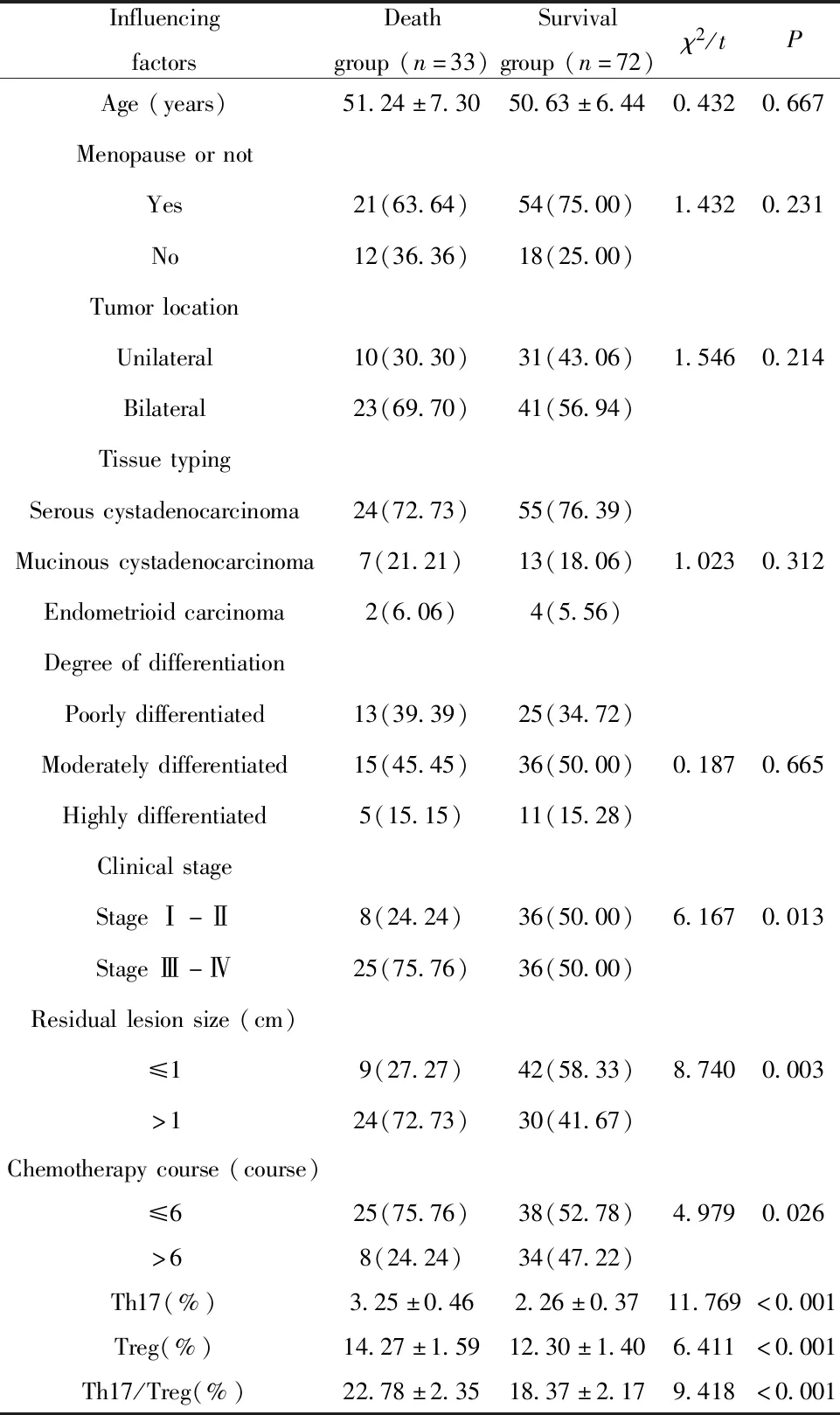
表1 可能影响卵巢癌预后的因素比较Tab.1 Comparison of factors that may affect the prognosis of ovarian cancer
2.4影响卵巢癌预后因素Logistic回归分析 经Logistic回归分析,临床分期、残存病灶大小、化疗疗程、Th17、Treg及Th17/Treg细胞百分率均是导致卵巢癌预后死亡的危险因素(OR=2.670、2.776、2.246、4.145、2.659、3.971,P<0.05,表2)。

表2 影响卵巢癌预后因素Logistic回归分析Tab.2 Logistic regression analysis of factors affecting the prognosis of ovarian cancer
3 讨论
目前,卵巢癌发病机制尚未完全阐明,研究者认为可能涉及女性外源性激素、遗传、环境及免疫功能等多种因素。研究表明,多种恶性肿瘤均存在外周血T淋巴细胞亚群失衡状态,新近发现的Treg、Th17失衡已逐渐成为研究热点[7,8]。Th17主要以高水平分泌IL-17为特征参与自身免疫及过敏反应过程[9]。Treg属于免疫负调控细胞,在肿瘤免疫耐受中发挥重要作用。研究证实,卵巢癌、乳腺癌等多种恶性肿瘤患者外周血均存在Treg和Th17数量增多现象[10,11]。因此,研究肿瘤微环境中Th17、Treg、Th17/Treg细胞百分率变化对了解疾病状态、预后预测有重要意义。
本研究中,卵巢癌组Th17、Treg、Th17/Treg细胞百分率均高于健康组,临床分期Ⅲ~Ⅳ期患者Th17、Treg百分率高于Ⅰ~Ⅱ期患者,Ⅲ~Ⅳ期与Ⅰ~Ⅱ期患者Th17/Treg细胞百分率无明显差异,提示外周血Th17、Treg、Th17/Treg细胞百分率变化可能参与卵巢癌发生发展。Zhu等[12]通过检测126例卵巢癌及26例卵巢良性肿瘤组织标本发现,上皮性卵巢癌较卵巢良性组织中Th17、Treg、Th17/Treg细胞百分率更高,且晚期上皮性卵巢癌中二者百分率较早期更高,提示Th17、Treg、Th17/Treg细胞百分率与上皮性卵巢癌疾病严重程度有关,与本研究结果相符。既往研究表明,Treg细胞在肿瘤微环境中表达增加,可能与癌细胞及肿瘤相关巨噬细胞分泌大量CC基序趋化因子配体-22,从而招募Treg细胞发挥免疫抑制作用,促进癌细胞增过程有关[13]。此外,Treg所分泌的TGF-β可促进Th17分化过程,使肿瘤微环境长期维持慢性炎症状态,而Th17大量分泌IL-17可促进癌细胞迁移[14-16]。因此,Th17、Treg、Th17/Treg细胞百分率增高可能促进卵巢癌发生发展,其原因可能为Th17、Treg细胞失衡导致肿瘤微环境免疫失衡,促进癌细胞增殖、迁移等过程,导致肿瘤进一步发展。
此外,本研究中死亡组临床分期Ⅲ~Ⅳ期、残存病灶>1 cm、化疗≤6个疗程患者构成比及Th17、Treg、Th17/Treg细胞百分率均高于存活组;经Logistic回归分析发现,临床分期、残存病灶大小、化疗疗程、Th17及Treg百分率均是导致卵巢癌预后死亡的危险因素,提示影响卵巢癌患者预后的危险因素较多,除临床分期、残存病灶大小及化疗疗程等常规危险因素外,外周血Th17、Treg、Th17/Treg细胞百分率与疾病预后也密切相关。Fu等[17]研究发现外周血T淋巴细胞亚群变化与乳腺癌术后免疫抑制有关,且与疾病预后生存期关系密切。Yang等[18]证实,Treg、Th17失衡与肺癌患者预后不良显著相关,与本研究结果相似。由此可知,Treg、Th17升高及比例失衡可能提示卵巢癌局部微环境免疫失衡,导致癌细胞增殖及迁移风险增加,进而导致疾病的预后不良。综上所述,外周血Th17、Treg、Th17/Treg细胞百分率变化可能参与卵巢癌发生发展,且与疾病预后关系密切,进一步提示临床中应注重调控Treg和Th17的平衡状态,对改善卵巢癌预后有重要意义。
