枸杞岛养殖贻贝中诺如病毒污染情况调查与分析
2020-12-23时沙沙贾添慧杨明树王永杰喻勇新
时沙沙, 贾添慧, 杨明树, 董 蕾, 李 聪, 王永杰, 喻勇新
(上海海洋大学 食品学院,上海 201306)
诺如病毒(Norovirus, NoVs)隶属于杯状病毒科、诺如病毒属,是主要的食源性病毒,能够在全世界范围内所有年龄段人群中引起非细菌性急性肠胃炎[1],常见症状包括腹泻、呕吐、恶心、腹部绞痛、发冷、头痛、脱水和高烧[2]。诺如病毒分为十个基因类群(GI~GX)[3],其中GI、GII、GIV型诺如病毒能够感染人类,但GIV型诺如病毒很少被检出,GI、GII型诺如病毒是引起人类非细菌性急性肠胃炎的主要病原体[4]。诺如病毒具有很强的传染性[5-6],主要通过粪-口途径进入人体,直接与被污染的环境表面或感染者接触而传播[7]。在美国,每年约有550万人被诺如病毒感染,感染案例在31种主要的食源性病毒引起的疫情中占比约58%[8]。双壳贝类通过滤食作用从养殖的水环境中获取食物,从而富集水环境中原有的或者人类排泄到水环境中的污染物,污染物包含许多造成人类疾病暴发的病原体[9],滤食特性使双壳贝类成为诺如病毒的主要载体,是引起诺如病毒疫情暴发的高风险食物[10]。我国沿海地区的居民,有生食贝类的习惯,引起诺如病毒疫情暴发与传播在我国尤为严重[11]。近年来我国关于双壳贝类中诺如病毒的检测工作主要围绕牡蛎、贻贝等进行[12-14],但样本大多来源于市场,仅少部分研究人员进行过养殖场内双壳贝类的污染状况调查[13-14],且相关研究中也鲜有将检测到的诺如病毒进行具体分型。因此中国沿海地区养殖场内贝类中诺如病毒的污染情况和基因型分布特点有待进一步研究。浙江省舟山市枸杞岛贻贝养殖场属于省级万亩贻贝养殖示范区。为了解该养殖场贻贝诺如病毒的污染程度和基因型分布特点,进一步探究主要常住居民活动是否对养殖场贻贝中诺如病毒的污染存在一定影响,为我国贝类诺如病毒污染的防控工作和贝类养殖方式的优化提供数据支持,本研究将浙江省舟山市枸杞岛后头湾(约11.81 km2)和龙泉村(约0.92 km2)两个主要的海上养殖场作为采样地,根据距离人类活动区域的远近,在每个养殖场设定近岸和远岸采样区域,于2019年4月和9月进行样本采集和诺如病毒检测,并对诺如病毒污染率与基因型多样性进行了分析。
1 材料与方法
1.1 材料
1.1.1 样本 厚壳贻贝(Mytiluscoruscus),采自浙江省舟山市枸杞岛贻贝养殖场。
1.1.2 试剂与仪器 RNA酶抑制剂(南京诺维赞生物有限公司);动物组织RNA提取试剂盒(上海捷瑞生物工程有限公司);一步法逆转录聚合酶链式反应(Reverse Transcription Polymerase Chain Reaction, RT-PCR)试剂盒、PCR Master Mix(大连宝生物工程有限公司);100 bp DNA Ladder(北京天根生化科技有限公司);FastPre-24 MP组织均质器(美国MP Biomedicals公司);超净工作台(ACB-4A1,新加坡ESCO公司);生物安全柜(AC2-4S1-CN,新加坡ESCO科技有限公司);5331 PCR仪、5382000074恒温混匀金属浴、5702R台式低温离心机(艾本德中国有限公司);PowerPac HC电泳仪、ChemiDoc XRS+凝胶成像系统和凝胶成像分析仪(上海伯乐生命医学产品有限公司)。
1.2 方法
1.2.1 采样点设计 根据2018年11月进行的实地考察情况,在浙江省舟山市枸杞岛贻贝养殖场设定两种采样区域:后头湾养殖场和龙泉村养殖场,将每个养殖场划分近岸和远岸采样线,根据GPS测量仪测定的具体位置(图1)(https://earth.google.com/web/),在较大的后头湾养殖场设定10个近岸采样点(A1~A10)及8个远岸采样点(B1~B8),同时在较小的龙泉村养殖场第一次采样设置6个近岸(C1~C6)和6个远岸采样点(D1~D6),第二次采样适当增加采样点,设置8个近岸(C1~C8)和8个远岸采样点(D1~D8)。
1.2.2 样本采集 于各采样点采集贻贝并标记采样信息,置于冰上暂时保存,用于后续检测。第一次采样,在各采样点采集11只贻贝样本,总数为330只。第二次采样,在各采样点采集10只贻贝样本,总数为340只。两次共采集670只贻贝样本。
1.2.3 样本预处理 于超净工作台中进行贻贝解剖,取约50 mg的消化腺组织放入已加入RNA酶抑制剂的离心管中,-80 ℃保存备用。
1.2.4 样本总RNA提取 采用MP组织破碎仪将冷冻保存的消化腺组织破碎均匀并依据动物组织RNA提取试剂盒操作说明进行总RNA的提取,将提取所得总RNA溶液置于冰上并立即进行巢式RT-PCR检测。
1.2.5 巢式RT-PCR检测 巢式RT-PCR使用诺如病毒GI型引物(COGIF/GISKR和 NGIOF/NGIOR)和GII型引物(COG2F/G2SKR和G2SKF/G2SKR)(见表1)[4,15-16]进行,采用琼脂糖凝胶电泳对PCR产物进行检测(GI: 168 bp, GII: 343 bp)。参照逆转录聚合酶链式反应试剂盒操作说明配制体系,具体反应体系如下:取 1 μL逆转录酶、12.5 μL 2×RT-PCR 缓冲液、1 μL上、下游GI和GII型引物于PCR 反应管中,加入1 μL RNA 模板,RNase-free ddH2O 补足至25 μL。第一轮RT-PCR程序为50 ℃保持 30 min,在逆转录酶的作用下,将单链 RNA 反转录成 cDNA(complementary-DNA),94 ℃预变性2 min,30个循环:94 ℃变性 0.5 min,55 ℃退火0.5 min,72 ℃延伸0.5 min。将第一轮 RT-PCR 的产物稀释10倍并取1 μL作为Nested-PCR的模板,Nested-PCR反应体系如下:取12.5 μL的2×PCR 缓冲液、1 μL上、下游GI和GII型引物(见表1)、1 μL的模板于PCR反应管中,ddH2O补足至25 μL。 Nested-PCR反应程序如下:94 ℃预变性5 min,40个循环:94 ℃变性0.5 min,55 ℃退火保持0.5 min,72 ℃延伸0.5 min。最后在72 ℃保温15 min加poly-A尾,以便进行后续的TA 连接和测序试验。
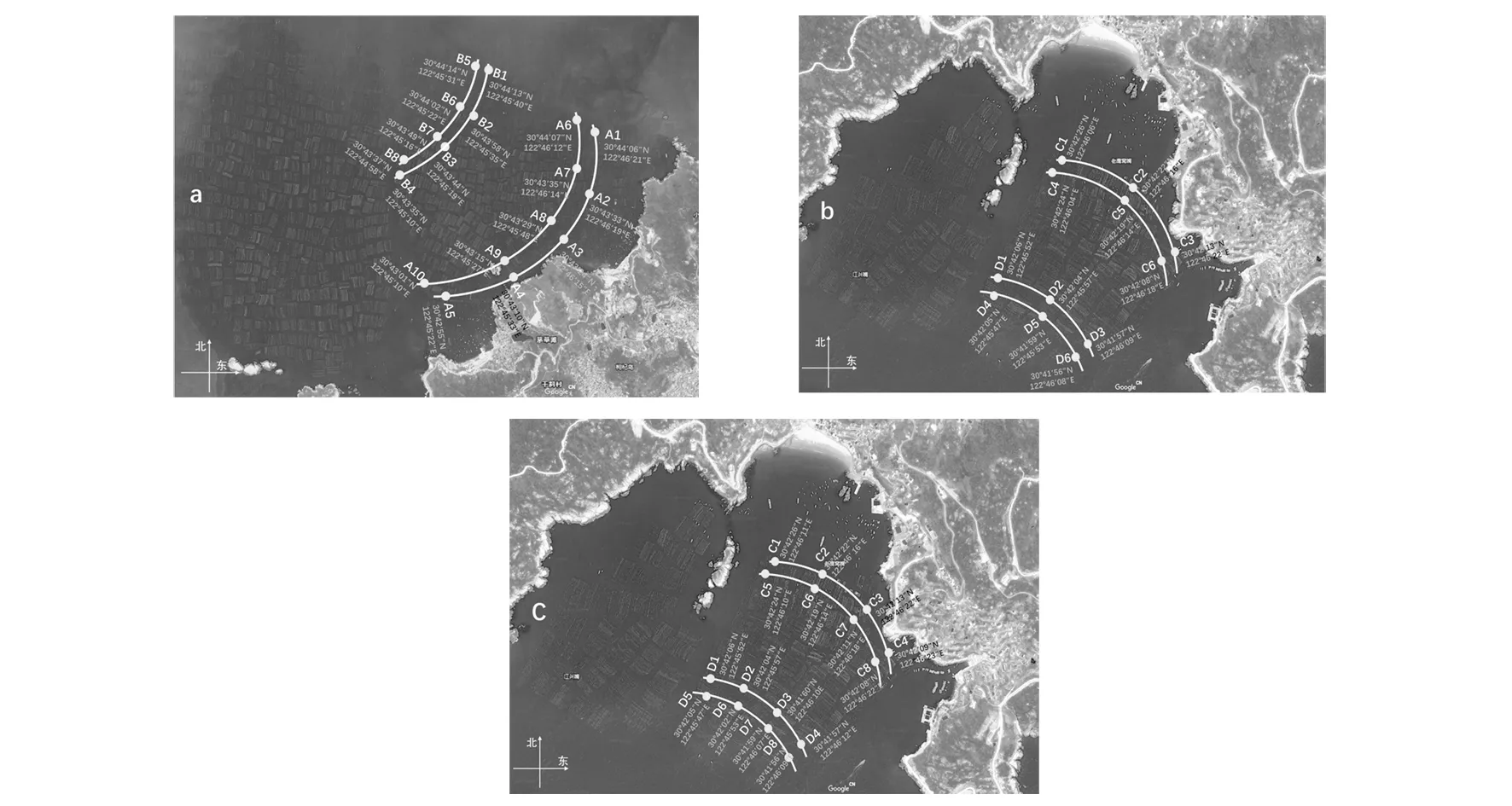
图1 各养殖场采样点分布示意图Fig.1 Sampling location of each farma:后头湾养殖场; b:龙泉村养殖场(第一次采样); c: 龙泉村养殖场(第二次采样)。A1~A10:后头湾近岸采样点; B1~B8:后头湾远岸采样点;C1~C6/C1~C8:龙泉村近岸采样点; D1~D6/D1~D8:龙泉村远岸采样点;采样点下方为GPS定位信息a: Houtou Bay farm; b: Longquan Village Farm(First time); c: Longquan Village Farm(Second time). A1-A10: near-shore sampling sites at Houtou Bay; B1-B8: off-shore sampling sites at Houtou Bay; C1-C6/C1-C8: near-shore sampling sites at Longquan Village; D1-D6/D1D8: off-shore sampling sites at Longquan Village location information by GPS of each sites was shown at the bottom of the sampling sites

表1 本研究所用引物
1.2.6 测序与基因型确定 经浓度测定和电泳检测后,将显示阳性条带的PCR产物送至生工(上海)生物工程有限公司进行测序,测序引物为Nested-PCR。测序成功的序列导入Norovirus Genotyping Tool(http://www.rivm.nl/mpf/norovirus/typingtool)在线软件中进行在线分析,初步确定该株诺如病毒的基因型。
2 结果与分析
分别在2019年4月和9月对枸杞岛后头湾养殖场和龙泉村养殖场进行两次样本采集,共检测贻贝670只,其中诺如病毒阳性率约为9.9%(66/670)。
2.1 第一次采样结果
2.1.1 后头湾养殖场 ①诺如病毒检出率:检测贻贝198只,每个采样点的样本检测情况如表2所示,其中近岸与远岸贻贝样本诺如病毒阳性率分别为11.6%(23/198)和3.5%(7/198); ②诺如病毒基因型分布:共检出诺如病毒阳性贻贝30只,覆盖的基因型包括GI.4(43.3%)、GI.3(30%)、GII.3(13.3%)、GII.17(10%)和GII.12(3.3%)(图2)。

图2 后头湾养殖场第一次采样贻贝诺如病毒基因型及所占比例Fig.2 Genotypes and proportion of norovirus in mussels for the first sample at Houtou Bay

表2 后头湾养殖场各采样点第一次采样贻贝诺如病毒检测结果
2.1.2 龙泉村养殖场 ①诺如病毒检出率:检测贻贝132只。每个采样点的样本检测结果见表3。其中近岸与远岸样本诺如病毒阳性率分别为9.8%(13/132)和6.1%(8/132)。②诺如病毒基因型分布:检出诺如病毒阳性贻贝21只,覆盖的基因型包括GII.12(52.4%)、GII.17(19%)、GII.3(14.3%)、GI.3(9.5%)和GII.2(4.8%)(图3)。
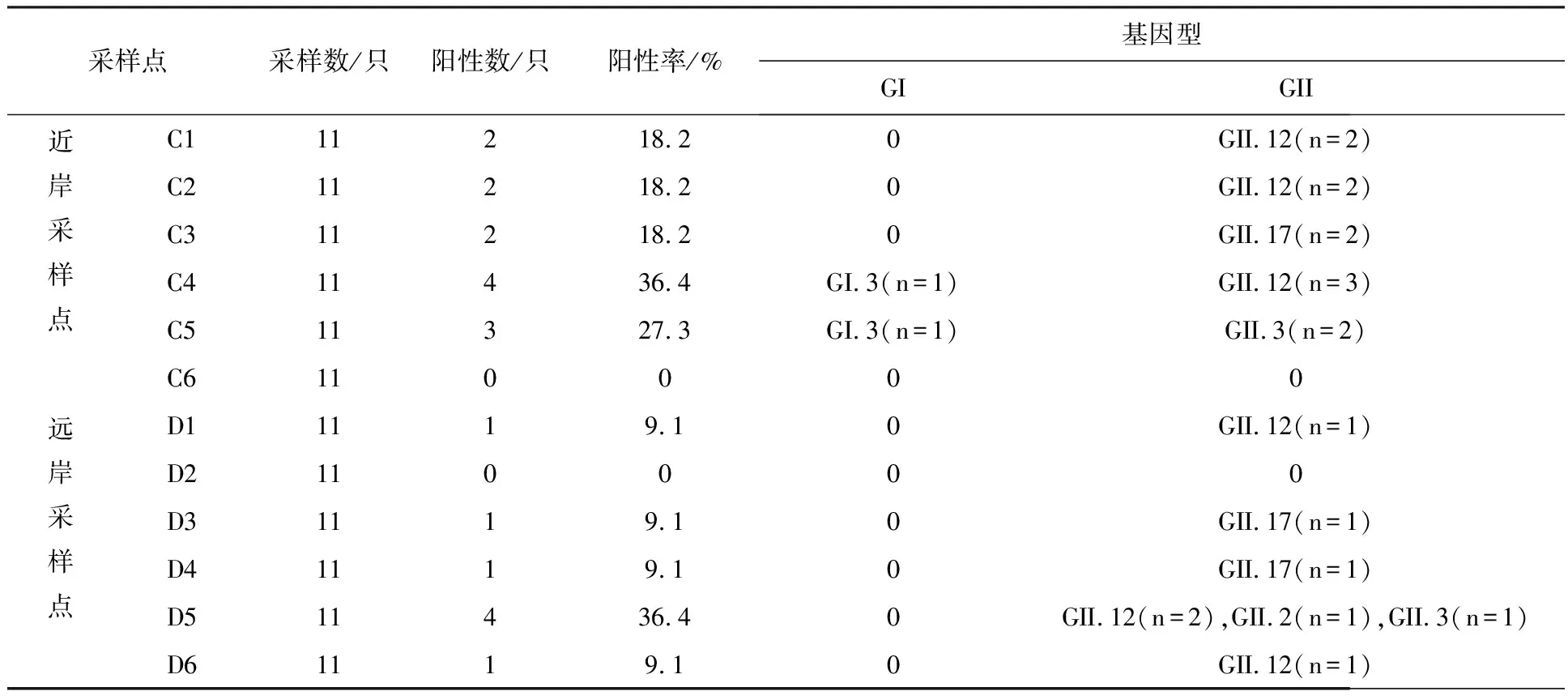
表3 第一次采样龙泉村养殖场各采样点贻贝感染诺如病毒检测结果
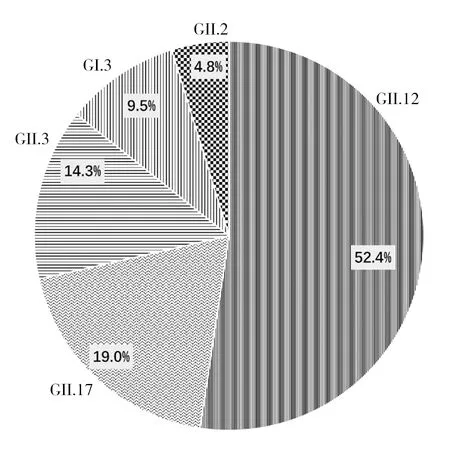
图3 龙泉村养殖场第一次采样贻贝感染诺如病毒基因型及所占比例Fig.3 Genotypes and proportion of norovirus in mussels for the first sample at Longquan Village
2.2 第二次采样结果
2.2.1 后头湾养殖场 ①诺如病毒检出率:检测贻贝180只。每个采样点的样本检测情况见表4。其中近岸样本诺如病毒阳性率为3.9%(7/180),远岸贻贝未检出诺如病毒。②诺如病毒基因型分布:共检出诺如病毒阳性贻贝7只,覆盖GI.3(71.4%)和GII.17(28.6%)两种基因型(图4)。
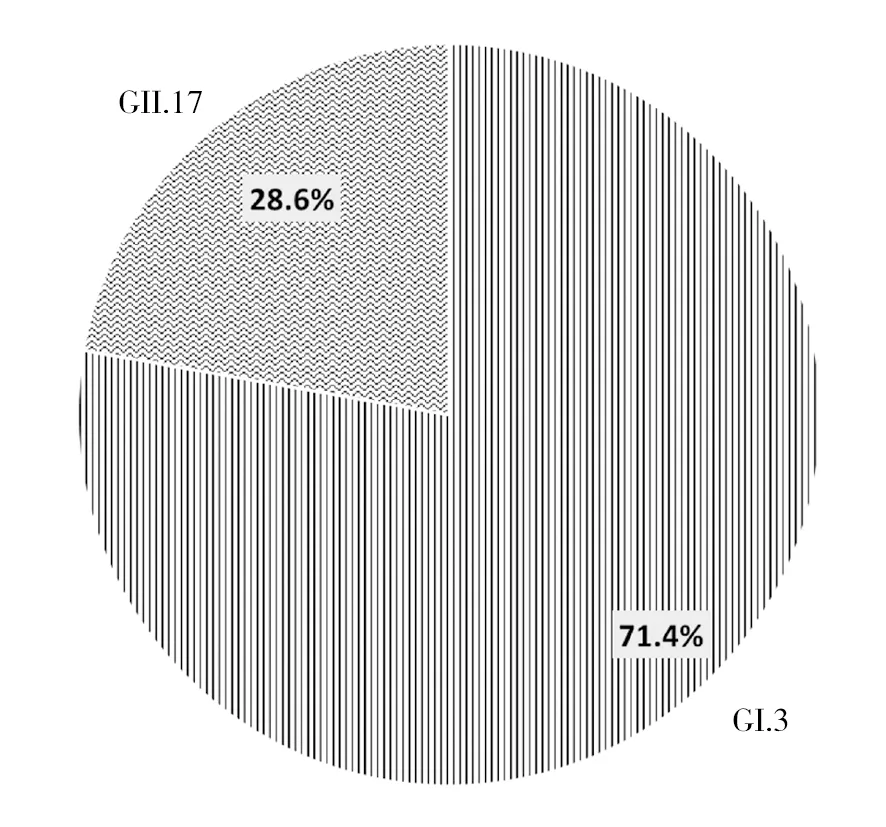
图4 后头湾养殖场第二次采样采样贻贝感染诺如病毒基因型及所占比例Fig.4 Genotypes and proportion of norovirus in mussels for the second sample at Houtou Bay

表4 后头湾养殖场第二次采样各采样点贻贝感染诺如病毒检测结果
2.2.2 龙泉村养殖场 ①诺如病毒检出率:检测贻贝160只。每个采样点的样本检测情况如表5所示。其中近岸与远岸样本诺如病毒阳性率分别为3.1%(5/160)和1.9%(3/160)。②诺如病毒基因型分布:共检出诺如病毒阳性贻贝8只,均为GI.3(100%)型诺如病毒。
枸杞岛的后头湾和龙泉村养殖场的两次检测结果表明,四月份共检测到51只诺如病毒阳性贻贝,九月份仅检测到15只诺如病毒阳性贻贝。枸杞岛两个贻贝养殖场中检测的诺如病毒均具有较高的基因多样性(图5),涉及6种诺如病毒基因型:GI.3(36.4%)、GI.4(19.7%)、GII.12(18.2%)、GII.17(13.6%)、GII.3(10.6%)和GII.2(1.5%)。
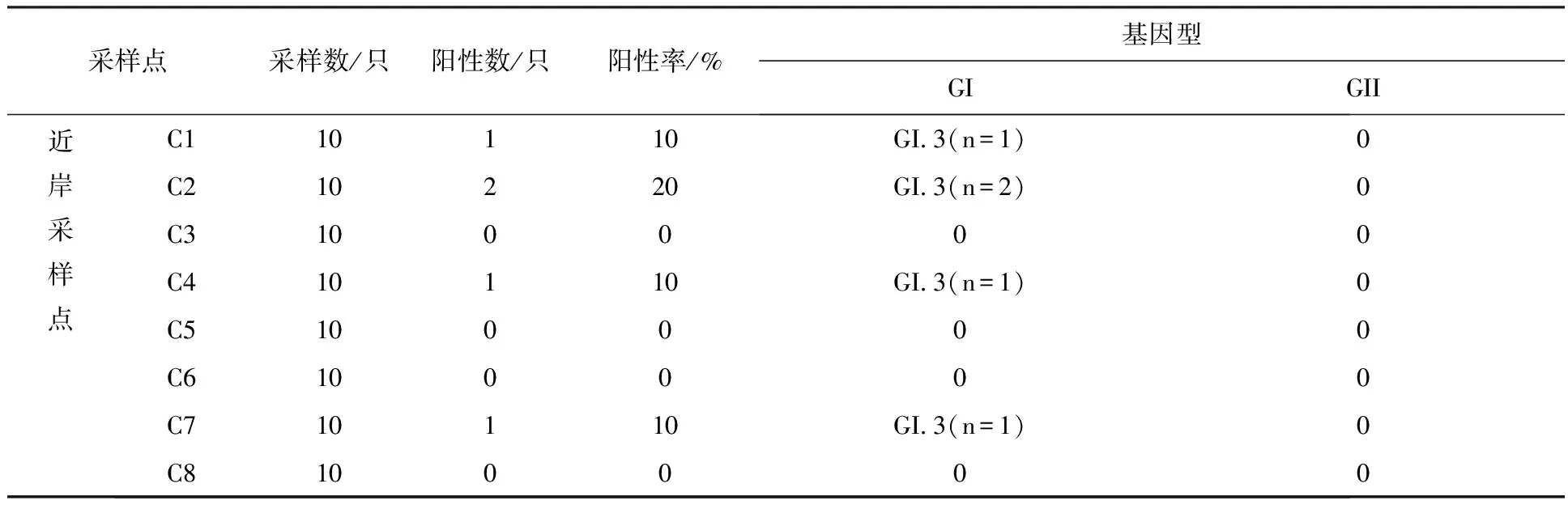
表5 第二次采样龙泉村养殖场各采样点贻贝感染诺如病毒检测结果

续表5

图5 两次采样检测的所有诺如病毒基因型及所占比例Fig.5 Genotypes and proportion of noroviruses detected at Gouqi Island
3 讨 论
目前,我国双壳贝类的养殖并未进行规范化管理,养殖区域水质监控的方法仍在建设中,这导致市场上的双壳贝类品质参差不齐,加之消费者在食用贝类时很少了解其养殖区域的实际污染状况,使得双壳贝类中因诺如病毒污染带来的疫情问题较为严重。因此,对贝类养殖区域病原体检测数据的补充尤为重要[17]。本研究在浙江省舟山市枸杞岛后头湾和龙泉村养殖场内,分别对近岸和远岸区域的贻贝进行样本采集和诺如病毒检测,分析各采样点诺如病毒的检出率与基因型,以此反映养殖场内贻贝的诺如病毒污染情况和基因型分布特点,同时分析养殖场内距离人类活动较近区域以及较远区域的贻贝感染诺如病毒的检测结果,以深入探究养殖场内贻贝的污染受当地居民活动的影响情况。
两次采样检测的诺如病毒阳性率差别较大,经进一步调查与分析发现,每年5至10月是枸杞岛当地旅游旺季,4月处于贻贝生长发育旺盛时期,此阶段的绝大部分贻贝已经在海里生长8~9个月,体内诺如病毒富集量达到较高水平,所以4月采集的贻贝感染诺如病毒检出率较高,且4月处于当地旅游淡季,枸杞岛养殖场的水环境处于没有外来游客“干扰”的时段,因此这些诺如病毒极有可能是当地居民排泄物所造成的污染。而7至9月是收割贻贝、养殖新苗阶段,枸杞岛养殖场内大部分区域的成熟贻贝均已被收割,贻贝新苗尚未成熟,新苗对水环境中的诺如病毒富集时间较短,有的甚至还未开始富集诺如病毒,这使得9月的检测结果与4月相差较大。因此,探究枸杞岛养殖场贻贝感染诺如病毒污染情况以及基因型分布的最佳时段应是每年的1至7月。
整体来看,养殖场内的贻贝受到人类活动不同程度的影响,并且该影响与养殖面积具有一定关系。较大的养殖场,由于地理因素,人类活动所能覆盖的养殖区域有限,对近岸贻贝影响较大,对远岸贻贝影响较小,使得近岸区域贻贝的诺如病毒检出率较高。较小的养殖场,人类活动区域覆盖的养殖面积相对较大,影响的贻贝面积也随之增大,使检测到的近岸和远岸贻贝的诺如病毒差距并不突出。另一方面,面积较大的后头湾养殖场是捕捞人员进出海、游客垂钓、渔民作业的主要区域,因此推测这些人为因素是后头湾养殖场贻贝感染诺如病毒检出率高于龙泉村养殖场的主要原因。
除了近岸、远岸贻贝感染诺如病毒检出率具有“近高远低”的趋势以外,枸杞岛贻贝养殖场中检测的诺如病毒也具有较高的基因多样性。在全部贻贝样本中,GI.3型诺如病毒所占比例最高,其次是GI.4型,这两类诺如病毒并不是引起人类疫情暴发的主要流行株,因此推测GI.3和GI.4型诺如病毒可能是人类的隐形携带株,在人类与环境之间传播,目前并不会像主要流行株那样具有较高的危害性。由于贻贝仅仅是诺如病毒在环境中传播的载体,并非其真正的宿主,因此推测这两类检出率最高的诺如病毒基因型主要来自于当地居民排放的污水或排泄物。由于其在养殖场贻贝中检出率较高,说明GI.3和GI.4型诺如病毒可能在当地居民体内携带量较高且长期稳定存在。
除GI型诺如病毒外,从贻贝中检测到的诺如病毒还有GII.12、GII.17、GII.3和GII.2型,检出率由高到低。针对中国GI和GII型诺如病毒流行情况的研究发现[18],GII.4、GII.17和GII.3型诺如病毒占我国所有诺如病毒基因型数据的70%[18]。2014至2015年和2016至2017年冬季,GII.17和GII.2在我国出现并导致疫情病例持续增加[19]。GII.17型诺如病毒株已成为亚洲几个国家暴发急性胃肠炎的主要基因型[20],我国诺如病毒检出率从4.0%上升至79.6%[21]。2016年秋季之前,GII.2是一种罕见的基因型,在中国感染率低于1%[22],在全球流型毒株中仅占1.5%[23],由于缺乏群体免疫性,GII.2型诺如病毒在年幼儿童群体中更易感染[24]。对不同诺如病毒流行病学和临床特征研究发现,GII.2型诺如病毒暴发主要发生在幼儿园、小学和高中,主要通过人与人接触传播[19]。基于1999至2011年间诺如病毒基因型分析发现[11],GII.12(15.1%)的检出率仅次于GII.4(70%)。本研究中发现的所有GII型诺如病毒大多为导致疫情暴发的主要病毒株,这一检测结果说明在非诺如病毒暴发季,许多诺如病毒基因型仍然在人与人或者人与环境中持续存在和传播,当人体中诺如病毒含量较多时,排泄到环境中的诺如病毒也在增加,贻贝体内的富集量也随之增加,因此对环境和养殖场的贝类定期进行诺如病毒检测,有助于对人类诺如病毒的监测、预警和防控。
本研究还存在不足之处,首先未充分考虑贻贝养殖周期的影响。不同于全年供应量充足的水产市场,养殖场的贝类养殖具有周期性,样本采集需要考虑贻贝生长周期。当养殖场处于旅游景点内时,外来游客会干扰原有的养殖环境,这一影响需作为采样的重点考虑因素。其次,虽然两次采样检测已获得初步结果,但若想更深入且更全面地探究枸杞岛养殖场内诺如病毒的污染规律,相关采样工作仍需重复进行,并进一步将枸杞岛养殖场贻贝的诺如病毒污染情况更详尽地反映出来。最后是尚未对当地居民唾液或粪便样本进行检测。因此在后续的监测工作中,需尽可能地与当地政府沟通,尝试对当地居民的样本进行检测,将检测结果与贻贝感染诺如病毒情况进行对比,进一步确认养殖场内诺如病毒的来源,以期为我国贝类养殖和贝类中诺如病毒的防控工作提供数据支持和监测思路。
