表达结核分枝杆菌CFP10基因的重组腺病毒对A549细胞炎性因子的影响
2020-12-23王健宏徐兆坤
王健宏, 徐兆坤, 李 武*
(1.宁夏大学 西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021;2.宁夏大学 生命科学学院,宁夏 银川 750021)
结核病(Tuberculosis, TB)是由结核分枝杆菌(Mycobacteriumtuberculosis, Mtb)引起的可致死的慢性传染病,是全球传染病引起死亡的主要原因之一[1]。据世界卫生组织的调查结果显示,2018年全球新发结核病640万例,死亡人数近150万[2]。我国是TB的高负担国家之一,TB发病人数约占全球发病总人数的14.3%,高居全球第2位。近年来,虽然我国在TB的防控领域取得了一定的成效,但由于多重耐药菌株的不断出现给TB的防控带来了严峻的挑战。肺脏是宿主进行气体交换的器官也是Mtb 感染的主要靶器官。由于其生理作用,肺脏表面的肺泡上皮细胞在进行气体交换的同时难免长时间暴露于环境,导致肺泡上皮细胞极易接触空气中的有害物质,包括空气中的毒素物质以及病原体。当Mtb 感染宿主时首先遇到上皮细胞。肺泡上皮细胞能合成和分泌细胞因子、炎症介质和肺表面活性物质等,其在抗Mtb感染中也发挥着重要的作用[3-4]。研究表明,Mtb被Toll样受体(Toll-like receptors, TLRs)识别后,能促进肿瘤坏死因子-α(Tumor necrosis factor-α, TNF-α)和白介素-12(Interleukin-12, IL-12)的释放,并诱导细胞产生NO,进而协助细胞清除胞内的Mtb[5-7]。因此,深入研究肺泡上皮细胞在Mtb 感染过程中与Mtb 的相互作用,对阐明宿主抗结核免疫的分子机制以及Mtb 逃逸宿主杀伤的免疫逃逸机制具有重要意义。抗结核病疫苗卡介苗(Bacillus Calmette-Guerin, BCG)在长期传代过程中丢失了很多基因阅读框和一些重要的毒力因子,如10 kDa培养滤液蛋白(Culture filtrate protein 10, CFP10)和6 kDa早期分泌性抗原靶蛋白(Early secretary antigenic target-6 kDa, ESAT6)[8]。
CFP10是由ESX-1分泌系统分泌,由RV3874基因编码的[9],它与ESAT6蛋白一样,免疫原性较强并且都为T细胞抗原,CFP10和ESAT6的缺失被认为是BCG减毒的主要原因之一。研究发现,从牛分枝杆菌中将编码CFP10和ESAT6的基因删除,会导致细菌毒力下降[10]。缺失了CFP10的海分枝杆菌突变体在细胞内的生长速度和在细胞间的传播速度大大降低,并且对巨噬细胞的细胞毒性也大大下降[8]。因此CFP10在Mtb 感染宿主的过程中发挥着重要作用。本研究拟通过构建CFP10重组腺病毒表达载体并转染人A549细胞系,检测CFP10是否对A549细胞炎性因子的表达产生影响。这将为揭示CFP10在结核病发病过程的作用,阐明结核分枝杆菌的致病机制及为新型抗结核疫苗的开发提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞系与质粒 HEK 293A细胞、腺病毒穿梭质粒pShuttle-AdV4和骨架质粒pGP-Ad-Pac Vector购自苏州吉玛基因股份有限公司;人肺泡Ⅱ型上皮细胞(A549)购自中科院上海细胞研究所。
1.1.2 主要试剂 SDS-PAGE相关试剂(30% Acr-Bis、10% SDS、Tris-甘氨酸-SDS电泳缓冲液)购自Solarbio公司;限制性内切酶BamH Ⅰ、PmeⅠ购自NEB公司;T4-DNA连接试剂盒购自Promega公司;病毒包装用转染试剂盒Lipofectamine LTX&PLUS购自Life Technologies公司;RNA提取试剂盒购自天根公司;荧光定量PCR试剂盒购自大连TaKaRa公司;TNF-α和IL-8 ELISA试剂盒购自欣博盛生物科技有限公司;DEME高糖培养基购自美国Gibco公司;胎牛血清购自中国北京全式金公司;ECL发光剂购自美国赛默飞公司;anti-CFP10抗体购自Abcam公司。
1.1.3 仪器与设备 CO2恒温培养箱(316108-5121,Thermo);PCR仪(T100,BIO-RAD);超速离心机(CP100WX/CR22N,HITACHI);电泳系统(PowerPac系列,BIO-RAD);实时荧光定量PCR仪(7500,ABI);自动化学发光成像系统(5200,Tanon);超低温冰箱(SANYO);多功能酶标仪(EnSpire,BIO-RAD);倒置荧光显微镜(IX83,OLYMPUS);核酸浓度测定仪(8000,NanoDrop)。
1.2 方法
1.2.1 引物的设计与合成CFP10基因PCR扩增引物参考文献[11],细胞因子IL-1α、IL-6、IL-8和TNF-α定量PCR扩增引物序列如表1所示,引物合成由上海生工生物技术有限公司完成。
1.2.2 重组穿梭质粒pShuttle-AdV4-CFP10的构建与鉴定CFP10基因PCR扩增产物与腺病毒穿梭质粒pShuttle-AdV4同时用BamHⅠ和PmeⅠ双酶切,酶切产物切胶回收后用T4-DNA连接酶进行连接,构建重组穿梭质粒pShuttle-AdV4-CFP10,并进行PCR、双酶切和测序鉴定。
1.2.3 HEK 293A细胞培养及腺病毒包装扩增 HEK 293A细胞培养至融合度达到60%~70%时,将线性化的重组穿梭质粒pShuttle-AdV4-CFP10和骨架质粒pGP-Ad-Pac Vector共转染至293A细胞中进行病毒包装。待细胞生长至100%融合度时进行转接,直至出现明显的细胞病变效应(cytopathic effect, CPE),此时收集细胞并反复冻融后收集病毒颗粒,将其命名为AdV4-CFP10。
1.2.4 重组腺病毒AdV4-CFP10的鉴定 采用Western blot法对重组病毒AdV4-CFP10进行鉴定。取少量病毒颗粒转染至HEK 293A细胞中,24 h后,使用凯基全蛋白提取试剂盒提取全蛋白,SDS-PAGE电泳后蛋白转至PVDF膜中,用含5%脱脂奶粉的PBS封闭液封闭2 h,加入anti-CFP10一抗(1∶5 000稀释),4 ℃孵育过夜。次日,室温平衡15 min,用含3% Tween-20的TBS漂洗液漂洗3次,加入二抗(1∶5 000稀释),室温孵育2 h后再次用漂洗液漂洗1次,ECL试剂显色,图像采集仪上成像。
1.2.5 重组腺病毒AdV4-CFP10的大量扩增及滴度测定 大量扩增重组腺病毒AdV4-CFP10后,采用CsCl密度梯度离心法对重组腺病毒进行纯化,采用微量全细胞病变法检测病毒滴度。
1.2.6 细胞培养及感染 A549细胞置于含有10%胎牛血清的DMEM培养基中,37 ℃、含5% CO2的培养箱中进行培养。细胞贴壁后,使用重组腺病毒AdV4-CFP10感染A549细胞,24 h后,取细胞培养上清用于细胞因子的ELISA检测,收集细胞并提取RNA用于细胞因子的荧光定量PCR分析。
1.2.7 实时荧光定量PCR 根据总RNA提取试剂盒说明书提取A549细胞的总RNA,再进行反转录后获得cDNA。实时荧光定量PCR反应体系为20 μL,反应条件:94 ℃ 30 s;94 ℃ 5 s;58 ℃ 30 s。共设置40 个循环,采用2-△△t法进行数据分析。
1.2.8 Western blot A549 细胞以1×106个/mL 接种于6 孔板中处理24 h,使用凯基全蛋白提取试剂盒提取蛋白,对蛋白定量后进行SDS-PAGE,转膜后进行Western blot检测,测定CFP10蛋白表达水平。
1.2.9 ELISA法检测细胞培养上清中炎性因子的含量 采用欣博盛生物科技有限公司ELISA试剂盒对细胞培养上清中的TNF-α和IL-8 含量进行测定,相关操作按照试剂盒说明书进行。

表1 实时荧光定量PCR引物序列
2 结果与分析
2.1 重组穿梭质粒pShuttle-AdV4-CFP10的鉴定
重组穿梭质粒pShuttle-AdV4-CFP10构建完成后,首先利用PCR技术对其进行鉴定,PCR产物经1.2%琼脂糖凝胶电泳检测,电泳结果显示在303 bp处出现特异性扩增条带, 且位置大小与预期结果相符(图1)。此外还对重组穿梭质粒pShuttle-AdV4-CFP10进行双酶切鉴定,重组质粒经BamHⅠ和PmeⅠ双酶切后,得到了4 500和303 bp的2个条带(图2),且与理论值大小一致。
2.2 腺病毒的包装、扩增及滴度测定
重组穿梭质粒pShuttle-AdV4-CFP10和腺病毒骨架质粒pGP-Ad-Pac Vector经PacⅠ酶切线性化后共转染至HEK 293A细胞中进行病毒包装,4 d后经荧光显微镜观察到少量的表达绿色荧光蛋白的细胞,9 d后在荧光显微镜下观察到明显的细胞病变效应(图3)。此时,收集细胞,经过反复冻融裂解后离心,并收集上清中的病毒颗粒,至此重组腺病毒AdV4-CFP10包装成功。病毒在HEK 293A中大量扩增后,CsCl密度梯度离心法进行病毒的纯化,病毒纯化后进行滴度测定。经测定,所获病毒滴度为9×108pfc/mL。
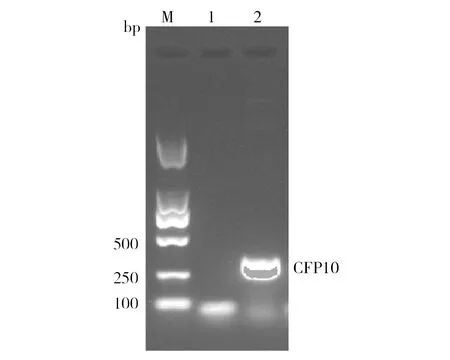
图1 重组穿梭质粒pShuttle-AdV4-CFP10的PCR鉴定Fig.1 PCR identification of the recombinant adenovirus shuttle plasmid pShuttle-AdV4-CFP10M:DNA Marker;1:阴性对照;2:CFP10 PCR扩增产物M:DNA Marker;1:Negative control;2:PCR products of CFP10

图2 重组穿梭质粒pShuttle-AdV4-CFP10双酶切鉴定结果Fig.2 Agarose gel electrophoresis of the recombinant adenovirus shuttle plasmid pShuttle-AdV4-CFP10 digested by restriction endonuclease BamHⅠand PmeⅠ1:阴性对照;2:pShuttle-AdV4-CFP10酶切产物;M:DNA Marker1:Negative control;2:Digestion products of;M:DNA Marker

图3 重组腺病毒AdV4-CFP10在HEK 293A细胞中的包装 Fig.3 Package of recombinant adenovirus AdV4-CFP10 in HEK 293A cells A、C:HEK 293T细胞;B、D:病毒包装中的细胞病变效应A,C:HEK293 cells 4 days;B,D:Cytopathic effects (CPE) of HEK 293A cells
2.3 重组腺病毒AdV4-CFP10感染A549细胞后CFP10基因的表达
为了验证重组腺病毒AdV4-CFP10中CFP10基因是否能在人肺泡II型上皮细胞A549中表达,在mRNA和蛋白水平上进行了检测。实时荧光定量PCR检测结果表明,重组腺病毒AdV4-CFP10在A549细胞中转录水平的表达量显著高于对照组(图4A)。Western blot结果表明,在约10 kDa 位置处出现CFP10特异性抗体识别条带,表明重组腺病毒AdV4-CFP10中CFP10基因可正常表达,且能被相应的特异性抗体所识别,具有反应原性。结果如图4B 所示。

图4 重组腺病毒AdV4-CFP10中CFP10在mRNA和蛋白水平上的表达 Fig.4 The expression levels of mRNA and protein of CFP10 in AdV4-CFP10 in A549 cells A:CFP10 mRNA水平检测结果;B:CFP10蛋白表达水平检测结果;M:蛋白Marker;1:AdV4-CFP10;2:AdV4-NC;***P<0.01 A:The expression level of CFP10 mRNA in A549 cells,B:The expression level of CFP10 protein in A549 cells,M:protein Marker,1:AdV4-CFP10,2:AdV4-NC,***P<0.01
2.4 重组腺病毒AdV4-CFP10感染A549细胞后对下游细胞炎性因子表达的影响
细胞炎性因子的表达是机体免疫系统启动的重要事件之一。为了探究重组腺病毒AdV4-CFP10是否对A549细胞炎性因子的分泌产生影响,分别使用RT-PCR和ELISA技术从转录水平和翻译水平上检测了相关炎性因子的表达水平。RT-PCR结果显示,与空病毒AdV4-NC组相比,AdV4-CFP10感染A549细胞24 h后,IL-1α、IL-6、IL-8和TNF-α在mRNA水平上表达量显著增加(图5)。又对其中的两种细胞因子IL-8和TNF-α用ELISA技术在蛋白水平上进行了检测,结果显示,其和转录水平趋势一致,细胞培养上清中的IL-8和TNF-α显著高于空病毒对照组(图6)。这些结果说明,重组腺病毒AdV4-CFP10感染A549细胞后,CFP10的表达对A549细胞炎性因子的表达具有重要的影响。

图5 重组腺病毒AdV4-CFP10对A549细胞IL-1α、IL-6、IL-8和TNF-α mRNA表达的影响 Fig.5 The effect of AdV4-CFP10 on the mRNA expression levels of IL-1α, IL-6, IL-8 and TNF-α in A549 cell**P<0.01,下图同**P<0.01,the same follow
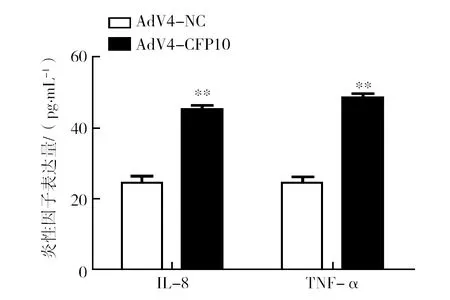
图6 重组腺病毒AdV4-CFP10对A549细胞IL-8和TNF-α分泌的影响 Fig.6 The effect of AdV4-CFP10 on the secretion of IL-8 and TNF-α in A549 cells
3 讨 论
近年来,尽管在结核病的防治领域取得了一定的成效,但到目前为止,能作为结核病防治的疫苗仅有卡介苗,其免疫效果并不是很理想,这主要与其在长期传代培养过程中丢失了一些优势抗原如CFP10和ESAT6等有关。CFP家族的成员,除了CFP10外,还有CFP25、CFP20.5和CFP3等[12]。其中,CFP10是一种重要的Mtb分泌蛋白,它能有效地刺激T细胞使其增殖分化,也可增强机体对Mtb的免疫保护效果[13]。因此,CFP10在抗结核疫苗研制领域备受关注。重组腺病毒因其基因结构与功能的研究较为清楚,且能够感染多数宿主细胞并能较好表达所需目的蛋白,因此被广泛应用于基因工程疫苗的开发、体外基因的转导以及体内基因治疗等领域[14]。肺泡上皮细胞和巨噬细胞同样也是Mtb侵袭的靶细胞,除了作为物理屏障外,它们还具有重要的免疫功能。肺泡上皮细胞可以通过模式识别受体(pattern recognition receptor,PRR)感知Mtb的存在,从而调节气道表面液体的组成,进而提高机体的抗感染能力[3]。此外,PRR的活化会导致炎性细胞因子的产生和T细胞的激活,促进IFN-γ和TNF-α等细胞因子的分泌[15]。
细胞免疫在抗Mtb感染免疫中发挥着重要的作用,Mtb的感染会产生大量的细胞因子,这些细胞因子的产生对宿主抗Mtb细胞免疫应答发挥着重要的作用[16]。本研究检测了重组腺病毒AdV4-CFP10感染A549细胞后是否对炎性因子表达水平有影响。发现CFP10的表达使得下游相关炎性因子IL-1α、IL-6、IL-8和TNF-α等分泌水平上调。有文献报道用重组蛋白CFP10免疫小鼠,结果显示与对照组相比,重组蛋白处理后小鼠炎性因子均显著升高[17],因此本研究结果与其相符。TNF-α能增加巨噬细胞的吞噬能力并增强巨噬细胞对Mtb的杀伤力,特别是在与IFN-γ协同作用时[18]。TNF-α还能够诱导巨噬细胞凋亡从而协助机体清除Mtb[19]。白介素对宿主清除Mtb也发挥着极其重要的作用[20-21]。
本研究成功构建了含有结核分枝杆菌CFP10基因重组腺病毒AdV4-CFP10,并检测了CFP10对A549细胞炎性因子的影响,结果表明CFP10能有效的对A549细胞下游相关炎性因子的转录和分泌产生影响。本研究将为揭示CFP10在结核病发病过程的作用、阐明Mtb的致病机制及为新型抗结核疫苗的开发提供参考。
