海藻糖酶产生菌的选育、鉴定及其酶学特性初探
2020-12-23董哲卿张新爽肖光焰郭鸿飞龚劲松史劲松许正宏
董哲卿, 张新爽, 肖光焰, 董 琦, 郭鸿飞,, 龚劲松, 史劲松, 许正宏
(1. 江南大学生物工程学院 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122; 2. 江南大学药学院 糖化学与生物技术教育部重点实验室,江苏 无锡 214122;3. 江苏博扬生物制品有限公司,江苏 南通 226000)
海藻糖(Trehalose)是由2分子吡喃葡萄糖环以α,α-1,1-糖苷键连接而成的一种十分稳定的非还原二糖。H.A.Wiggers于1832年在研究黑麦中的麦角菌时,第一个发现了海藻糖;Mitscherlich随后于1858年在蘑菇中分离到了这种糖,并称其为海藻糖。海藻糖在自然界中普遍存在,且分布范围比较广,包括细菌、真菌、昆虫、低等植物、脊椎动物,特别在真菌和昆虫中的含量非常高,是国际上最近开发的主要低聚糖之一[1]。虽然海藻糖的来源广泛,但能在体内大量积累海藻糖的生物并不是很多。海藻糖的分解途径在真菌中研究得比较透彻,国内外研究成果表明,除毕赤酵母利用海藻糖磷酸化酶分解海藻糖外,其余所有真菌对海藻糖的分解都是通过以海藻糖为专一底物的海藻糖酶的水解反应实现的。海藻糖酶是一种海藻糖水解酶,能够专一性并特异性的将1分子海藻糖分解为2分子的葡萄糖。自然界中,海藻糖酶广泛存在于昆虫、哺乳动物、微生物和植物中,并发挥着重要的作用;在食品、农业、农药以及昆虫处理中应用前景巨大,特别是在乙醇工业中,海藻糖酶可改善发酵糖质原料中二糖组分的利用效率,提高目标产物乙醇的收率,尤其是发酵结束时减小“DP2峰”(DP-聚合度-等同于二糖)海藻糖的总量,可大大提高残糖的利用率和总糖的转化率。海藻糖酶最早是Bourquelot于1893年在黑曲霉中发现的,1895年Fischer在酿酒酵母里也发现了海藻糖酶[2]。随后,科研人员在不同的生物里不断地发现和鉴定了不同的海藻糖酶,这些生物包括细菌、真菌、昆虫、线虫等。真菌中的海藻糖酶因反应的最适pH值差异性被分为两类:中性海藻糖酶和酸性海藻糖酶。其中酸性海藻糖酶位于液泡,是胞外酶,不能被磷酸化调控,最适pH值在4.5左右;而中性海藻糖酶位于细胞质,负责主要的胞内海藻糖分解,最适pH值在7.0左右。目前有关海藻糖酶产生菌种的报道较少,应用特性也无法满足生产需求,本研究以经海藻糖驯化的土壤进行产酶菌种的分离选育,并利用形态学和16S rDNA分子生物学鉴定筛选到的目标菌株。通过酶学性质探讨在不同条件下目标菌株产海藻糖酶的影响因素和应用性能,以期为海藻糖酶在乙醇生产中的工业化应用提供参考。
1 材料与方法
1.1 材料
1.1.1 土样采集 菌种筛选土样采自无锡长广溪湿地公园、江南大学附近经海藻糖驯化的土壤。用小铲子铲去表层土,采集深5~10 cm处的土壤约50 g,装入消毒的塑料袋密封并记录时间、地点、环境情况。
1.1.2 培养基(g/L) ①富集培养基:蛋白胨 5,酵母膏 1.5,葡萄糖 150,MgSO4·7H2O 0.5,K2HPO40.5。②初筛培养基:海藻糖 15,KCl 1,KH2PO41,MgSO4·7H2O 0.5,CaCO31,琼脂20,pH 7.0。③液体发酵培养基:海藻糖 15,KCl 1,KH2PO41,MgSO4·7H2O 0.5,CaCO31,pH 7.0。④LB培养基。
1.1.3 酶活测定试剂 ①DNS试剂:准确称取244.4 g酒石酸钾钠于500 mL去离子水中,45 ℃加热溶解,溶液中加入21 g NaOH,然后加入6.3 g DNS ,溶解后按顺序分别加入5 mL苯酚和5 g NaHSO3,待溶液冷却后定容至1 L。将配制好的DNS溶液于棕色瓶中避光贮存,放置1周后使用。②50 mmol/L H3PO4缓冲液:分别配制200 mmol/L的NaH2PO4和Na2HPO4缓冲液母液(两者比例分别为68.5%和31.5%),将母液稀释配制成50 mmol/L、pH 6.5的PBS缓冲液。③100 mg/mL海藻糖溶液:以50 mmol/L的PBS缓冲液为溶液,加入海藻糖,溶解后配制成10%海藻糖母液,作为酶活测定底物备用。
1.1.4 酶学性质研究试剂 ①BR(Britton-Robinson)缓冲溶液:在100 mL H3PO4、H3BO3和CH3COOH 三种酸(浓度均为 0.04 mol/L)的混合液中,向其中加入不同体积的NaOH(浓度为0.2 mol/L)调节缓冲溶液的pH值为1.8~11.9,10%海藻糖底物溶液由上述缓冲液配制而成,酶液由上述缓冲液进行适度稀释。②金属离子溶液:将Ca2+、Zn2+、Ni2+、Mn2+、Cu2+、K+、Na+、Fe2+、Sn2+、Ba2+、Mg2+、Co2+和Li+等各金属离子配制成浓度为200 mmol/L的母液。
1.2 方法
1.2.1 菌种的富集筛选 取5 g新鲜土样充分震荡悬浮于45 g无菌水中,取1 mL土壤悬液上清放入含富集培养基的三角瓶中,37 ℃,220 r/min摇瓶培养24 h。取1 mL经富集培养的菌液移入含有9 mL无菌生理盐水的试管中,在漩涡震荡器上震荡摇匀制成10-1浓度的样品悬浮液;再从上述悬浮液中吸取1 mL,加入含有9 mL无菌生理盐水的试管中,震荡摇匀制成10-2浓度的样品悬浮液,依次配制成10-3、10-4、10-5、10-6、10-7浓度的样品悬浮液。各取0.1 mL的样品悬浮液涂布于初筛培养基上,每个浓度2个重复,选取菌落分散,单菌落数目在100~200左右的平板作为目标平板。复筛时,将菌落接种于液体发酵培养基,37 ℃,220 r/min摇床培养36 h后即得粗酶液,用于酶活测定。根据酶活筛选出具有较高海藻糖酶活力的菌株,待测菌株编号C2。
1.2.2 酶活检测方法 采用3,5-二硝基水杨酸(DNS)比色法测定海藻糖酶分解海藻糖产生的葡萄糖含量:取2 mL EP管,依次加入150 μL稀释后的粗酶液和150 μL 10%的可溶性海藻糖底物做为实验组;依次加入150 μL稀释后的酶液和150 μL pH 6.5的磷酸缓冲液,37 ℃反应15 min作为对照组;实验组和对照组各加入300 μL的DNS试剂,沸水浴5 min终止反应,取出置于冰水混合物中冰浴2 min;取200 μL混合液在540 nm 测定其吸光度值。准确称取1.0 g干燥至恒重的无水葡萄糖,溶于去离子水中,并定容至100 mL,即为10.0 mg/mL的葡萄糖标准液,按照表1配制不同浓度的葡萄糖溶液,加入300 μL的DNS试剂进行反应,于540 nm测定其吸光度值,制成葡萄糖标准曲线。对照组以pH 6.5的PBS缓冲液代替葡萄糖标准液[4]。酶活计算方法:酶活(1 U)定义为在上述实验条件下,1 mL的酶液每分钟产生1 μmol还原糖所需的酶量,测定均重复3次。
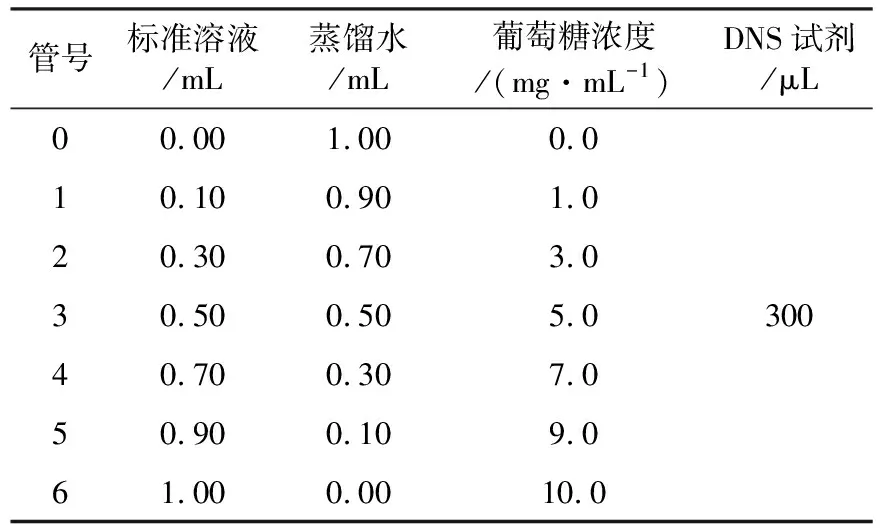
表1 葡萄糖标准曲线制作
1.2.3 菌种鉴定 收集液体发酵培养基中的菌体,选择16S rDNA 通用引物27F(AGAGTTTGATCCTGGCTCAG)、1492R(GGTTACCTTGTTAC-GACTT)对所提细菌基因组进行PCR扩增,于200 μL PCR管配制50 μL PCR 反应体系。PCR反应体系:ExTaqDNA聚合酶预混液(Takara)25 μL、基因组2 μL、上游引物27F 1 μL、下游引物1492R 1 μL、ddH2O 21 μL,混匀后,稍微离心使溶液完全处于PCR 管底部,将PCR管放入PCR仪,进行PCR扩增。PCR扩增条件:94 ℃ 预变性10 min,95 ℃变性60 s,58 ℃退火60 s,72 ℃延伸90 s,重复30次,72 ℃终止延伸10 min,扩增完成后,凝胶电泳检测PCR 扩增结果。以1×TBE 缓冲液为电泳液,10×Loading buffer染色,5 000 DL DNA Maker 为标准Maker,150 V运行30 min,凝胶成像仪观察1 500 bp 处有明亮条带。PCR扩增产物的纯化按上海生工生物技术公司的小量胶回收PCR产物纯化试剂盒说明进行,使用Thermo NanoDrop 2000 测定所提基因组的浓度,测序由上海睿迪生物科技有限公司完成。利用生化鉴定法(革兰染色法)对菌种做进一步的鉴定[5-6],根据微生物实验手册对菌株进行革兰染色,光学显微镜和电镜进行菌体形态观察[7-8]。
1.2.4 酶学性质研究 ①最适反应温度研究:用50 mmol/L磷酸缓冲液(pH 6.5)适度稀释酶液,分别在30、35、40、45、50、55 ℃条件下测定海藻糖酶酶活,以最高酶活的反应温度作为最适反应温度。②温度稳定性测定:将酶液在不同温度(30、35、40、45、50、55 ℃)条件下热处理30 min后置冰上冷却,按照标准酶活测定方法在37 ℃测定海藻糖酶剩余酶活,以未经处理酶液的酶活作为对照。③最适反应pH值和pH值稳定性研究:在不同缓冲液体系下按照标准酶活测定方法进行酶活检测,以最高酶活的反应pH值作为最适反应pH值。④pH值稳定性测定:将酶液置于不同pH值缓冲液中并于冰上放置1 h,在标准条件下进行酶活检测,以未经处理酶液的酶活作为对照。⑤金属离子对酶活的影响:分别配制200 mmol/L的Ca2+、Zn2+、Ni2+、Mn2+、Cu2+、K+、Na+、Fe2+、Sn2+、Ba2+、Mg2+、Co2+和Li+等金属离子母液,以1 mmol/L的终浓度分别置入海藻糖酶酶活检测反应体系,进行标准酶活检测反应,以不加任何金属离子的反应作为对照。⑥化学试剂对酶活的影响:分别配制10%吐温(Tween-20、Tween-80)、曲拉通(Tritonx-100、Tritonx-114)、十二烷基硫酸钠(SDS)和二甲基亚砜(DMSO)的溶液,以1%终浓度置入酶活检测反应体系进行标准酶活检测反应;将乙二胺四乙酸(EDTA)、苯甲基磺酰氟(PMSF)、二硫苏糖醇(DTT)等分别配制成200 mmol/L母液,分别按照1 mmol/L终浓度加入到反应体系后,进行标准酶活检测反应,以上反应均以不加任何化学试剂作为对照[9-11]。
2 结果与分析
2.1 形态及生理学特性鉴定
将筛选到的菌株C2在LB培养基上划线培养,菌落圆形、隆起、灰白色,易挑取(图1)。革兰染色为红色,光学显微镜观察,菌体多呈直杆状,大小在(0.5~1.0)μm×(1.0~3.0)μm左右,单生或成对,有时短链状(图2)。电镜观察进一步确认了该菌株的形态(图3)。该菌株为革兰阴性,氧化酶阴性,接触酶阳性,利用果糖、半乳糖、D-葡萄糖、β-甲基葡萄糖苷和蔗糖产酸。可利用丙二酸盐、延胡索酸盐、葡萄糖酸盐、苹果酸盐作为惟一的碳源和能源,不能利用苯甲酸盐、草酸盐或丙酸盐。以终浓2.5%的海藻糖度对该海藻糖酶的全细胞蛋白进行酶活测定,酶活可达17.99 U/mL。
2.2 分子生物学鉴定
菌株C2的16S rDNA序列长度为1 409 bp,在NCBI数据库中进行核苷酸序列BLAST比对确定其种属。最终结果显示,该菌株的16S rDNA序列与Erwinia属(HM748066.1、MG198678.1等)的相关序列存在99%以上的同源性,与Pantoea属(KM019845.1)的相关菌株序列同源性为98%左右,最终将其归为Erwinia属。结合形态特征和生理生化特性,将其鉴定为大黄欧文氏菌(Erwiniarhapontici),编号为C2,该菌株已保藏在中国普通微生物保藏管理中心(保藏编号CGMCC No.16760)(图4)。

图1 菌株C2培养形态Fig.1 Strain morphology of C2 on plates

图2 菌株C2光学显微镜形态(100×)Fig.2 Strain morphology of C2 under light microscope (100×)

图3 菌株C2电镜形态Fig.3 Strain morphology of C2 under electron microscope
2.3 海藻糖酶酶学性质研究
2.3.1 最适反应温度和温度稳定性 研究发现菌株C2的海藻糖酶的最适反应温度为40 ℃,在35~45 ℃相对酶活达到90%以上;在30~35 ℃热稳定性较高,残余酶活可保持在90%以上,超过40 ℃,热稳定性明显下降(图5)。
2.3.2 最适反应pH值和pH值稳定性研究 在不同缓冲液体系下按照标准酶活测定方法进行酶活检测,以最高酶活反应的pH值作为最适pH值。研究发现该海藻糖酶的最适pH值为5.0,海藻糖酶在酸性环境下具有较高酶活,尤其在pH值4.5~5.5时,相对酶活仍可达90%以上;pH值稳定性考察结果表明,该酶在pH值为4.0~9.0时均能保持80%以上的残余酶活,具有良好的稳定性,这一特性应用于乙醇工业生产,可提高残糖的利用率和总糖的转化率(图6)。
2.3.3 金属离子和化学试剂对海藻糖酶活性影响 金属离子对酶活影响的研究结果表明,与对照相比,Ca2+、Zn2+、Ni2+、Mn2+、Cu2+、K+、Na+和Fe2+对酶活有促进作用,而Sn2+和Ba2+对酶活有抑制作用,Mg2+、Co2+和Li+对酶活力几乎没有影响(表2)。
不同化学试剂,包括表面活性剂、酶抑制剂、金属螯合剂等对酶活影响的结果显示,与对照相比,DMSO和DTT对酶活有促进作用,而Triton X-114、SDS和PMSF对酶活有抑制作用,Tween-20、Tween-80、Triton X-100和EDTA对酶活几乎没有影响(表3)。

表2 金属离子对海藻糖酶酶活性的影响

表3 化学试剂对海藻糖酶酶活性的影响
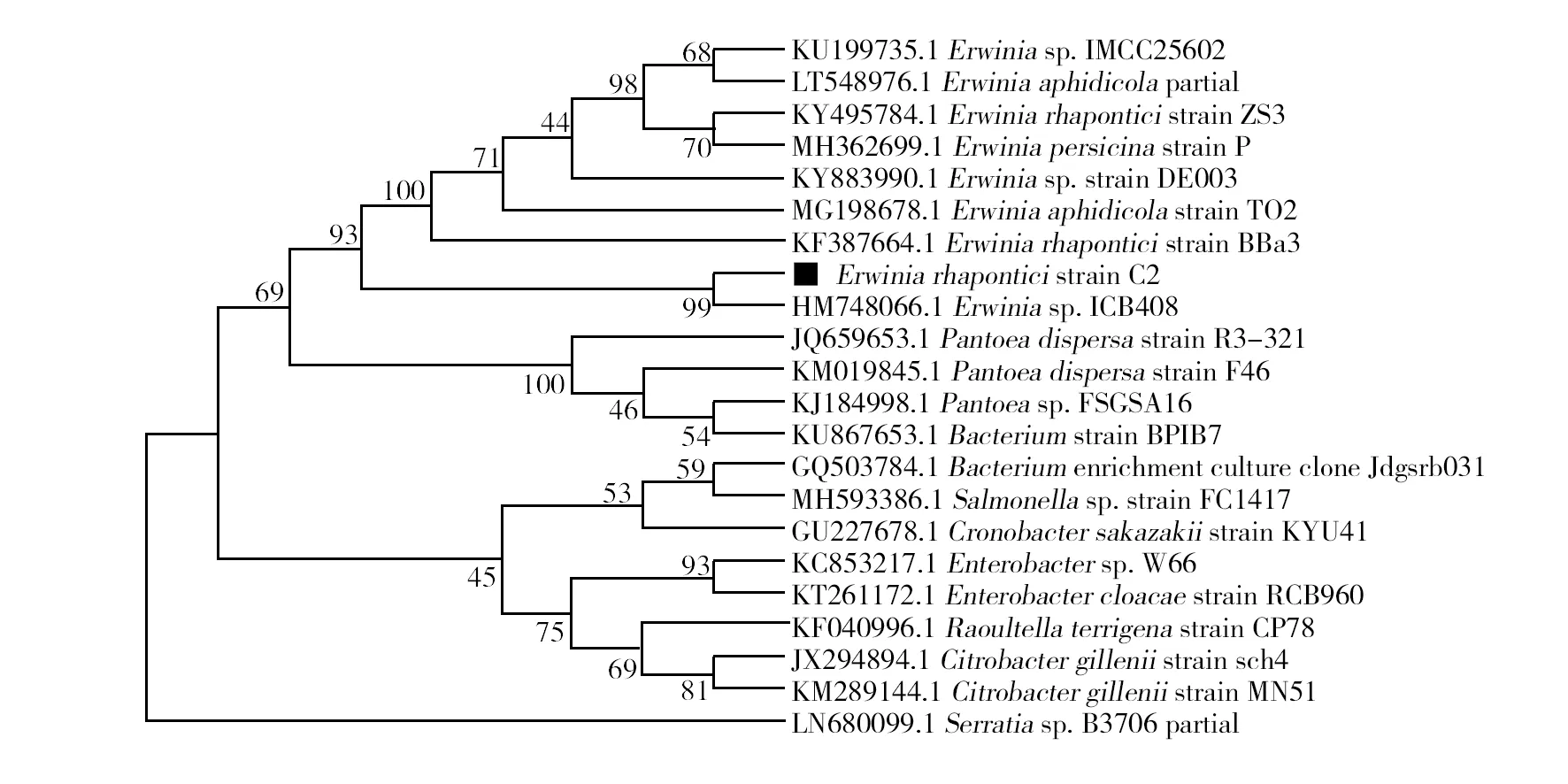
图4 基于neighbor-joining方法构建大黄欧文氏菌(E. rhapontici)16S rDNA序列系统进化树Fig.4 Phylogenetic analysis results based on the 16S rDNA sequence of E. rhapontici based on neighbor-joining method 种属名称前的编号为相应基因序列在GenBank中的登录号,步长值根据1 000次重复计算获得Numbers before the strain name are accession numbers of published sequences in GenBank, bootstrap values were based on 1 000 replicates
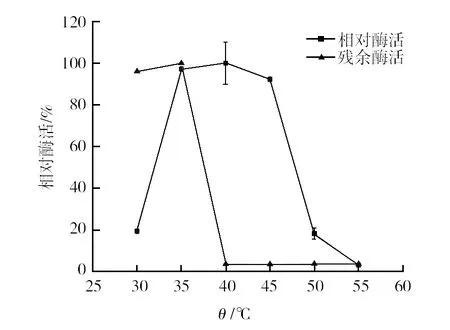
图5 大黄欧文氏菌(E. rhapontici)海藻糖酶的最适温度及温度稳定性Fig.5 Optimum temperature and thermo-stability oftrehalase produced by E. rhapontici
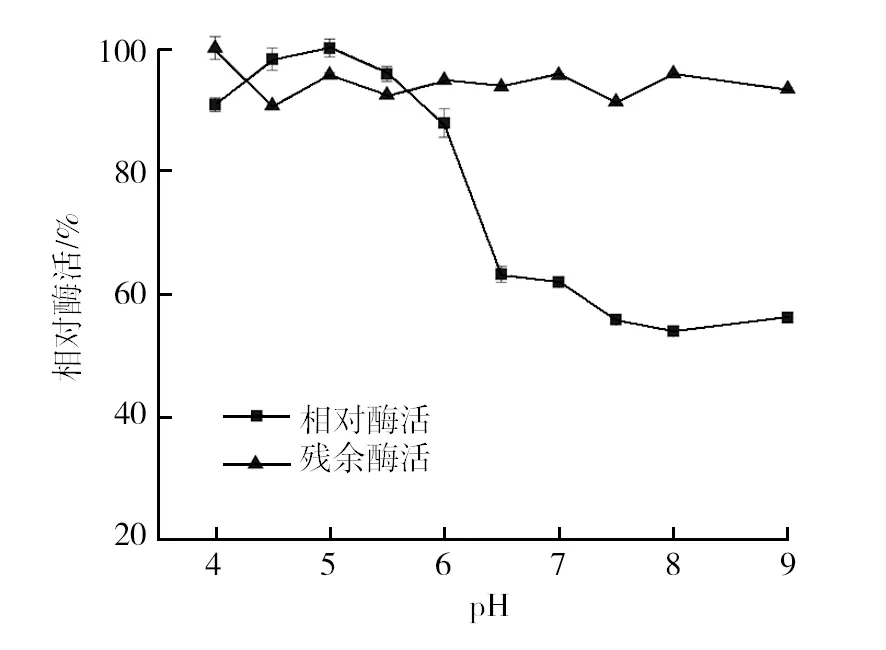
图6 大黄欧文氏菌(E. rhapontici)海藻糖酶的最适pH及pH稳定性Fig.6 Optimum pH and pH stability of trehalase produced by E. rhapontici
3 讨 论
海藻糖酶在食品、工业及农业领域应用广泛[12-13],但目前产酶菌以及海藻糖酶酶学特性研究报道较少。特别在工业生产中,海藻糖酶可以改善发酵原料利用效率以提高产物乙醇的收率,能够大大提高残糖的利用率和总糖的转化率。因此,海藻糖酶的菌种选育及酶学性质研究有着潜在的理论意义和实践价值。本研究在对大黄欧文氏菌海藻糖酶酶学性质进行研究过程中发现,其最适反应条件为40 ℃、pH值5.0,该海藻糖酶在酸性条件下较稳定,35 ℃以下热稳定性较高;添加金属离子如Ca2+、Zn2+、Ni2+、Mn2+、Cu2+、K+、Na+和Fe2+以及化学试剂DMSO和DTT对酶活力均有促进作用,Triton X-114、SDS和PMSF对酶活力有抑制作用。
目前,有关海藻糖的相关代谢酶类研究主要是针对海藻糖合成酶并已有大量报道[14-17],而有关水解海藻糖的海藻糖酶则报道较少,已有的海藻糖酶主要来源于昆虫,如棉铃虫 (Helicoverpaarmigera)[18-19]、小菜蛾(Plutellaxylostella(Linnaeus))[5]、烟粉虱 (Bemisiatabaci)[20]、绿盲蝽 (Apolyguslucorum)[21]等,而微生物来源的海藻糖酶则鲜有报道。
于林港等[22]以大肠埃希菌E.colistr.K-12 substr. MG1655基因组为模板,扩增获得1种海藻糖酶基因tref,经大肠表达宿主E.coliBL21 (DE3)中重组表达,对重组菌进行发酵优化和IPTG诱导后,重组海藻糖酶的酶活最高达到107 U/mL,该酶的最适反应温度为50 ℃,最适pH值为7.0。马俊等[23]以4龄小菜蛾Plutellaxylostella(L.)体内海藻糖酶为研究对象,在离体条件下的研究结果表明,小菜蛾体内海藻糖酶的最适反应pH值为6.0,温度50 ℃。谭永安等[21]以绿盲蝽膜结合型海藻糖酶 (ALTre-2)基因为研究目标,构建了ALTre-2原核表达载体 (pET28a-ALTre-2),经IPTG诱导表达,SDS-PAGE分析显示该蛋白以包涵体形式存在,经变性、复性后发现重组ALTre-2蛋白在pH值7.0时活性最高,最适反应温度为50 ℃。Ai等[5]对棉铃虫 (H.armigera)海藻糖酶的酶学性质研究结果表明,该酶在最适反应温度为55 ℃,最适pH值为6.0的条件下,酶活性为1.62 U/mg。于彩虹等[18]对昆虫组织中海藻糖酶活性测定结果显示,亚洲玉米螟、棉铃虫肠中海藻糖酶的活性最高,分别为316.17和39.35 mU/mg,而甜菜夜蛾体壁中海藻糖酶活性最高达139.99 mU/mg。
本研究从自然界选育获得1株产海藻糖酶的细菌——大黄欧文氏菌(E.rhapontici),该酶具有良好的催化活性和操作稳定性。除SDS和PMSF对酶活力有抑制作用以外,其他外界环境因素对酶活性影响较小。截至目前大黄欧文氏菌(E.rhapontici)产海藻糖酶尚未见文献报道,本研究针对该野生菌产海藻糖酶的特性进行初步探究,可为后续采用基因工程进行海藻糖酶重组表达、分子改造和规模化制备等研究提供参考。
