复合菌剂M5对红螯螯虾(Cherax quadricarinatus)高密度养殖系统水质及其肠道微生物群落影响的初步研究
2020-12-23徐文倩叶姜瑜
徐文倩, 叶姜瑜,2*
(1.重庆大学 环境与生态学院,重庆 400045;2.重庆大学 三峡库区生态环境教育部重点实验室,重庆 400045)
微生物与水产养殖对象密不可分,其相互作用贯穿水产养殖的全过程。近年来对养殖对象肠道菌群的研究,揭示了养殖环境微生物对宿主的健康具有不同程度的影响,探索了微生物制剂改善养殖水质及宿主的健康的方法。Zhu等[1]研究表明,在无交换水的凡纳对虾(Penaeusvannamei)养殖系统中添加MarichromatiumgracileYL28,20 d后,YL28减少了铵的积累,显著降低了99.3%的亚硝酸盐。Wang等[2]研究发现,含4种复合益生菌的微生物制剂对凡纳滨对虾(Litopenaeusvannamei)的生长以及对其健康状况的改善作用优于单一益生菌。因此,通过微生物调控可减少水产药物的使用、提高饲料利用效率,对水资源匮乏、水环境污染严重的地域意义尤为重大。如何利用好有益微生物调控水质、抑制水产养殖对象体内外病原微生物已成为绿色生态养殖研究和发展的重点内容。红螯螯虾(Cheraxquadricarinatus)又称四脊光壳螯虾、澳洲淡水龙虾,具有个体大、生长快、食性杂、适应性强、可纯淡水繁殖等特点,有望在中国进行大规模养殖[3]。目前国内对红螯螯虾的研究主要集中在生殖生物学[4]、营养需求[5-6]、免疫力[7-9]等基础研究,针对红螯螯虾高密度养殖系统中的微生物学研究还处于空白。现阶段红螯螯虾养殖仍以池塘养殖为主,疫病预防和水体水质调控是养殖过程中的重点任务。本研究采用周期性施加微生物制剂的方法,考察微生物制剂在短期内调控和稳定高密度养殖系统条件下,红螯螯虾的养殖水质及其肠道菌群的变化情况,从而探究提高红螯螯虾存活率的方法,提出红螯螯虾高密度养殖、减少药物使用的科学依据,达到绿色生态养殖的目的。
1 材料与方法
1.1 材料
1.1.1 虾种及饲料 挑选372只质量为50 g左右,大小相近且健康的亚成虾(购自广东省佛山市某水产市场)。普通2号虾料,成分见表1。
1.1.2 菌种 乳酸菌(Lactobacilluschiayiensis)、玉米乳酸菌(Lactobacilluszeae)、枯草芽胞杆菌(Bacillussubtilis)、不动杆菌(Acinetobacter)等4株功能菌均从河道底泥中筛选获得。
1.1.3 培养基(g/L) ①MRS培养基:酪蛋白胨 10.0,牛肉浸取物 10.0,酵母提取物 5.0,葡萄糖 5.0,乙酸钠 5.0,柠檬酸二胺 2.0,吐温-80 1.0 mL,K2HPO42.0,MgSO4·7H2O 0.2,MnSO4·7H2O 0.05, pH 6.8;②LB培养基:胰蛋白胨 10.0,NaCl 10.0,酵母浸出粉 5.0,pH 7.0。以上培养基121 ℃、1×105Pa灭菌20 min。

表1 2号虾料主要成分
1.1.4 主要试剂 纳式试剂(环保标准,成都科龙化学品有限公司),过硫酸钾、抗坏血酸、酒石酸钾钠、钼酸铵、酒石酸锑钾、盐酸、4-氨基苯磺酰氨、N-(1-萘基)-乙二胺二盐酸盐、氨基磺酸、氢氧化钠及培养基中使用的试剂为分析纯,均购自重庆川东化工集团有限公司,DNA提取试剂盒FastDNA®SPIN Kit for Soil 购自美国MP Biomedicals公司。
1.1.5 主要仪器与设备 标准元素型超纯水机(ATSelem 1810A,安特生),千分之一天平(AL104-IC,梅特勒-托利多),高压蒸汽灭菌锅(BXM-30R,博迅),超净工作台台(SW-CJ-1FD,苏净),恒温摇床(QYC-200,福玛),电热恒温培养箱(HPX-9082MBE,博迅),pH计(PHSJ-3F,上海雷磁),台式高速离心机(TG16-WS,湘仪),紫外分光光度计(UV2600,日本岛津),分光光度计(Nano Drop 2000 UV-vis,赛默科技,美国),PCR扩增仪(GeneAmp 9700,ABI,美国)。
1.2 方法
1.2.1 红螯螯虾的养殖 将虾种随机分成两组:对照组IC和实验组IT,每组3个重复,每个重复62只虾。每个养虾池为内循环养殖系统,循环水体积为 150~160 L,温度22~26 ℃,每个养虾池尺寸为0.8 m×1.2 m,水位8~10 cm。虾料日投食量为每组红螯螯虾总重量的4%,每日投喂2次,早9点喂日投食量的25%,晚7点喂日投食量的75%。
1.2.2 菌剂的制备与使用 自制复合菌剂M5包含4株功能菌,其中2株乳酸菌作为益生成分, 1株异养硝化菌主要用于水质保障,1株枯草芽胞杆菌兼具益生与净化水质的作用。将4株菌株分别培养到稳定期,其中乳酸菌L.chiayiensis(GenBank登记号MN508945)与玉米乳酸菌L.zeae(GenBank登记号MN508946)分别接种MRS培养基培养20 h,OD600控制在3.5左右,活菌量控制在(1~2)×1010cfu/mL;而不动杆菌AcinetobacterQETG_s(GenBank登记号MN508947)与枯草芽胞杆菌B.subtilis(GenBank登记号MN508948)分别接种在LB培养基培养30 h,OD600控制在1.2左右,活菌量控制在(1~2)×1011cfu/mL。将4种菌液等体积混合配制成M5备用。IT组使用普通2号虾料与M5混合均匀后,喂养红螯螯虾,虾料中M5的添加量为当日投食饲料总重量的0.1%,每7 d向虾池喷洒复合菌剂M5,喷洒量为养殖水量的0.1%。IC组使用普通2号虾料与IT组等量的MRS和LB培养基混合,并每7 d向虾池喷洒与IT组等量的MRS和LB培养基。
1.2.3 采样与测定 实验前先用自来水洗净红螯螯虾表面并擦干,测量每只红螯螯虾湿质量,记为W0,实验结束后,测定每只红螯螯虾的湿质量,记为Wt。采用湿重特定生长率(Specific growth rate,SGR) 作为生长参数,计算实验前后的养殖密度(Cultural density, CD)。每天定时检查养殖系统,及时捞出死虾和残肢,称重并记录,计算存活率(Survival rate, SR)。公式如下:
CD(kg·m-2)=W/S
(1)
式中:W为某一时刻全部个体湿质量和(g);S为养虾池面积(m2);
SGRW(%·d-1)=100%×(lnWt-lnW0)/T(2)
式中:Wt、W0分别为实验始、末个体湿质量(g);T为实验时间(d);
SR(%)=(存活只数/总只数)×100%
(3)

1.2.4 DNA提取与PCR扩增 用DNA提取试剂盒FastDNASPIN Kit for Soil提取样品的DNA,通过分光光度计测定最终的DNA浓度并观察纯化效果,1%琼脂糖凝胶电泳检查DNA质量。通过PCR扩增仪,用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增样品细菌16S rRNA基因的V3~V4高变区。PCR反应程序:95 ℃变性3 min,95 ℃;30 s,30个循环,55 ℃退火30 s,72 ℃延伸45 s,72 ℃最终延伸10 min。PCR反应在20 μL混合物(5×FastPfu Buffer 4.0 μL,2.5 mmol/L dNTPs 2.0 μL,338F 0.8 μL,806R 0.8 μL,FastPfu聚合酶 0.4 μL,BSA 0.2 μL,模板 DNA 10 ng,灭菌超纯水11.8 μL)中进行,3个重复。
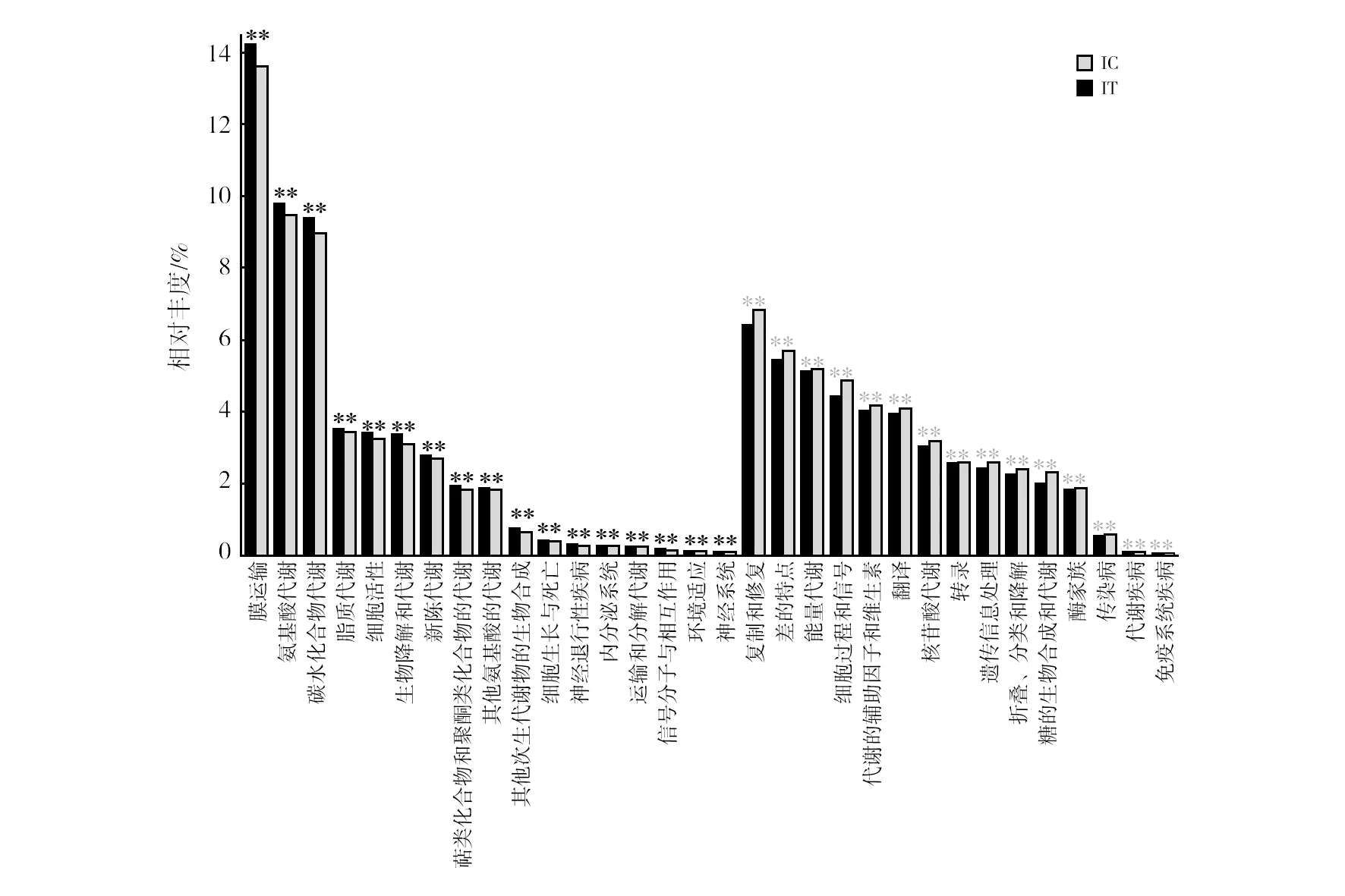
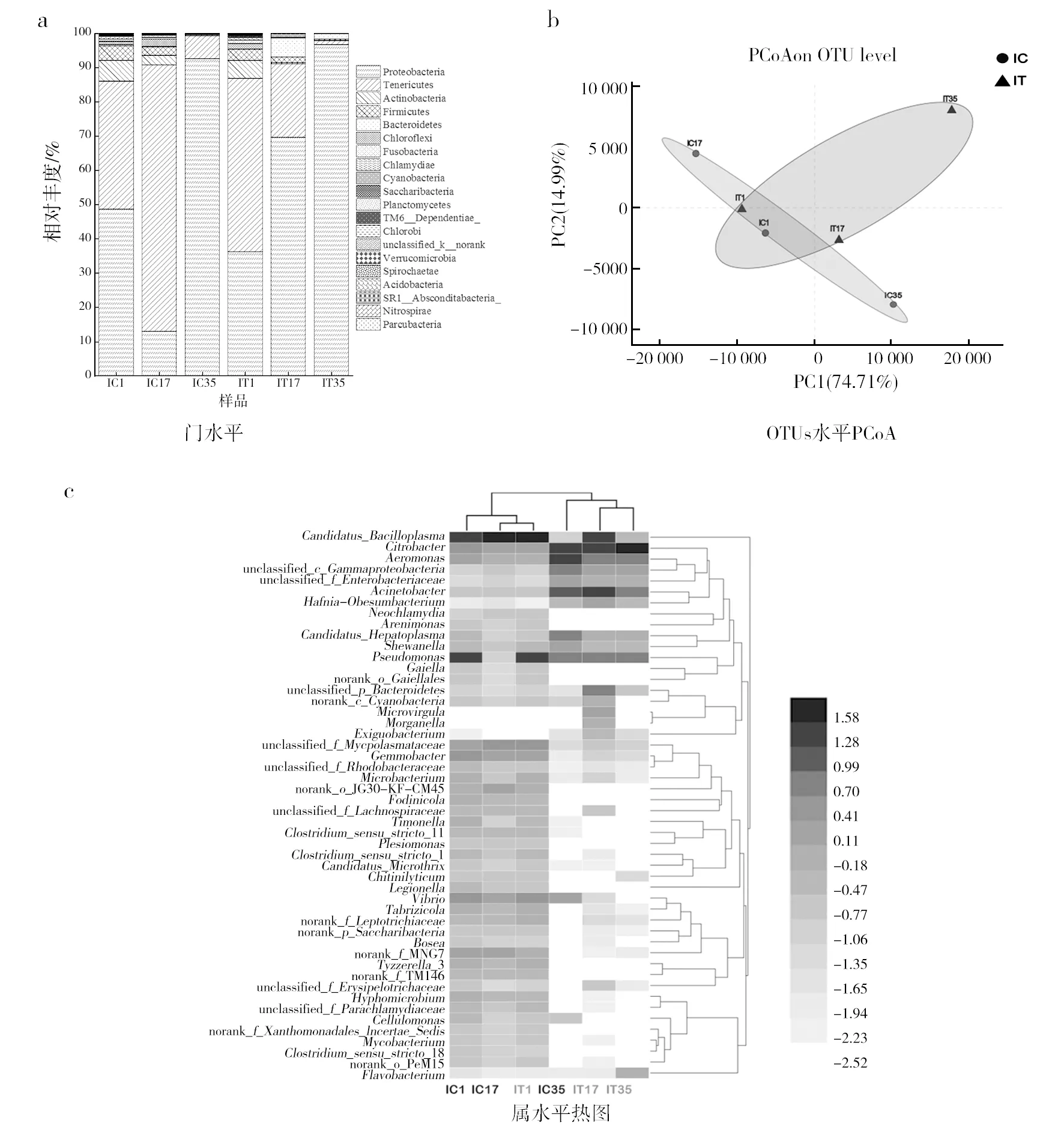
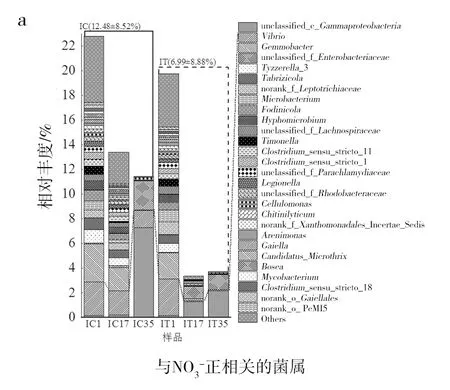
1.2.5 数据分析 将高通量测序结果存储在NCBI SRA数据库中(Bioproject登记编号PRJNA573062),并在上海美吉生物医药科技有限公司的I-Sanger平台中进行分析。为排除测序深度不同带来的误差,所有样本将按最小的序列数量33 434进行抽平,再采用最小序列数33 434对其他样品进行随机取样,形成新的子样品进行后续分析。通过Usearch(vsesion 7.0 http://drive5.com/uparse/)对测序结果进行相似水平97%上的OTU划分。采用RDP贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析。在I-Sanger平台通过OTU数据进行多样性分析包括α多样性分析、样本比较分析、物种组成分析、物种差异分析以及功能预测分析等。采用IBM SPSS Statistics 25和Origin 2018、相关性分析和线性回归分析等对其他数据进行处理。显著性分析包括单因素方差分析、KEGG代谢通路上的G test与Fisher′s分析,其结果含义为显著:0.01 实验期间,红螯螯虾特定生长速率、实验初始和末期的养殖密度见表2。实验数据表明IC组与IT组的红螯螯虾特定生长率均较低,两组间没有显著性差异(P>0.05)。亚成虾较低的特定生长率可避免实验周期内红螯螯虾生长参数变化过大的影响,符合该研究的重点,利于探究复合菌剂作用的效果及可能的机制。实验末期(第35天),IC组与IT组的养殖密度存在显著性差异(P<0.05)。 表2 养殖情况 图1 虾池水质与虾存活情况Fig.1 Water quality and survival of Cherax quadricarinatu 在门水平上(图2a)两组没有显著性的群落组成差异,随实验时间的增加,样品的群落变化主要集中在变形菌门(Proteobacteria)、软壁菌门(Tenericutes)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)这4个门中,其总和分别占IT组的(95.53±2.12)%、IC组的(97.36±1.70)%。在OTU水平上,对IT组与IC组的样本采用Euclidean的距离算法进行PCoA主坐标轴分析(图2b) ,两个主坐标轴累积贡献率达89.7%,说明降维结果具有统计学意义。实验初期IC组与IT组样本群落组成相近,但在实验中期IC组与IT组样品群落差异较大。实验末期IC组与IT组群落结构差异又有所减小。在属水平上,对样品物种总丰度前50的物种进行Average聚类与热图分析,颜色的深浅表示对应的lg(相对丰度)的值(图2c),颜色越深,相对丰度越大,白色表示空值。复合菌剂的使用减少了样品属水平上的物种丰度,同时减少了弧菌属(Vibrio)的相对丰度。 图2 红螯螯虾肠道菌群群落组成Fig.2 The composition of intestinal flora of Cherax quadricarinatusc图中白色表示空值Blank in plot (c) means null value 表3 斯皮尔曼相关性分析 图3 环境因子与样品线性回归图Fig.3 Linear regression diagram of environmental factors and samples 使用PICRUSt进行功能预测,得到每个样品对应的KEGG信息,利用STAMP对IT组与IC组的KEGG代谢通路进行Level 2的分析。选择两个样本进行G test与Fisher′s相结合的检测方法,进行双边检验。结果显示,IC与IT在75.6%的代谢上均有显著性差异。过滤掉每组相对丰度在0.05%以下的代谢通路,将有显著性差异(P<0.05)的代谢标出(图5)。 如图5所示,IC组和IT组显著增强的代谢各有不同。其中IT组比IC组显著减弱的代谢包括:①应对环境压迫的代谢类型:膜运输、细胞运动、细胞生长与死亡、运输与分解代谢、信号分析和相互作用、环境适应、异生素的生物降解与代谢、萜类和聚酮类化合物的代谢;②基于碳、氮、磷基本营养元素的代谢类型:脂肪代谢、氨基酸代谢、碳水化合物代谢、代谢大类、其他氨基酸代谢、其他次生代谢产物的生物合成。 IT组比IC组显著增强的代谢包括:①有助于宿主的营养方面的代谢,比如能量代谢、辅酶因子和维他命代谢、核苷酸代谢、糖的合成与代谢以及酶家族;②免疫力方面的代谢:传染性疾病、代谢疾病、免疫系统疾病;③遗传信息处理与细胞过程的代谢:复制和修复、翻译、转录、遗传信息处理、折叠,分类和降解、细胞过程和信号。 已知水产养殖动物肠道菌群与养殖水环境密切相关,一方面水环境中微生物与水产养殖动物肠道菌群能相互影响[11-12],另一方面,水质指标比如pH、亚硝态氮等的改变也会使水产养殖动物肠道菌群发生变化[13]。因此,养殖水质的调控是水产养殖动物健康的重要环节,养殖水体环境的污染会增加水产养殖动物的致病率,从而引起一系列肠道菌群的动态变化,而肠道菌群的失衡容易造成水产养殖动物发病或死亡[13-14]。有研究表明,在健康的凡纳滨对虾肠道中,致病菌的丰度处于较低水平,或与其他微生物的数量保持一定的平衡[15-17]。本研究中红螯螯虾肠道内弧菌属的相对丰度在IT组中大幅减少,这可能在一定程度上解释了IT组红螯螯虾存活率显著提高的原因。弧菌是水产生物肠道的常见菌群,其中一些属于条件致病菌,当其大量定殖于水产养殖动物肠道时,会造成水产养殖动物健康恶化甚至引起死亡[18-19]。而复合菌剂M5中的乳酸菌和枯草芽胞杆菌作为益生成分,可有效抑制致病弧菌的生长,相较于IC组,IT组保持了肠道菌群的平衡。此外,乳酸菌分泌的抗菌物质——细菌素,降低了肠道pH值,可能通过竞争排除作用改变了肠道群落结构[20],减少了病原菌的生存机会。多项研究表明,饲料中添加乳酸菌和枯草芽胞杆菌可有效防止致病菌爆发[21-24]。然而,仅凭存活率无法完全判断宿主的健康情况,后续的研究应增加对红螯螯虾免疫学指标的测试。 图5 显著性差异的KEGG 代谢通路Level 2柱形图Fig.5 Significant difference of groups on KEGG level 2“**”表示显著性差异(P<0.01),黑色“**”表示IC组在该代谢通路上相对丰度更高,浅灰色“**”表示IT在该代谢通路上相对丰度更高"**" means significant difference (P<0.01),black "**" means the IC group has a higher relative abundance on this metabolic pathway, and the light gray "**" indicates the IT has a higher relative abundance on this metabolic pathway 由于微生物含有丰富的菌体蛋白,菌体及其分泌物可作为水产养殖的饵料补充,促进水产养殖动物健康。而水产养殖动物的肠道作为食物储存、消化和营养吸收的重要器官,在机体免疫中起着重要作用[25-26]。本研究中,IT组中M5的使用为高密度养殖下的红螯螯虾提供了额外的营养,缓解了肠道菌群群落间的竞争。具体表现为IT组应对环境压迫及基本营养元素的代谢强度显著低于IC组。M5中的益生成分可能促进了虾的消化,提高了虾的免疫能力,使IT组有着更高的存活率,这也与IT组肠道菌群增强的功能代谢结果相符。Du等[27]的研究也得到了相似的结果:使用戊糖乳杆菌(LactobacilluspentosusHC-22)喂养凡纳滨对虾4周后,对虾的免疫基因表达、免疫酶活性、消化酶活性均显著高于对照组,改善了虾的营养,增强了免疫调节作用。不过,该研究的功能代谢结果是基于功能预测实现的,因此需要其他研究方法,比如转录组学方法和代谢组学方法加以证明。 本研究利用复合菌剂M5,改善无交换水的高密度养殖系统下红螯螯虾的养殖水体环境,提高了虾的存活率,并从肠道菌群以及水质变化两方面揭示了复合菌剂可能的作用原理与效果。具体结论如下:①通过间歇施加微生物复合菌剂,在有效控制成本的同时,改善了红螯螯虾养殖水质,显著提高了虾的存活率,减少了水产药物的使用、提高了饲料利用效率,为水产养殖动物病害防治、免疫预防和绿色生态养殖提供可靠的保障;②复合菌剂可有效抑制致病弧菌的增殖,平衡了肠道菌群,并作为额外的营养补充,缓解了营养竞争;③基于PICRUSt的功能预测显示:复合菌剂可提高虾的免疫力、消化能力,增强虾的遗传信息处理与细胞过程的代谢,显著提高了虾的存活率。2 结果与分析
2.1 虾池水质与养殖情况

2.2 肠道菌群的群落结构
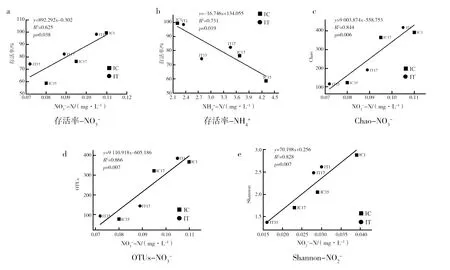
2.3 菌群与环境因子的关系
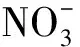


2.4 肠道菌群的功能分析
3 讨 论