3D支架载尿液细胞来源IPSCs-NSCs移植对急性脊髓损伤大鼠的修复作用观察
2020-12-23李长明邵荣学邓小梅赵士杰王拓全仁夫杭州市萧山区中医院杭州300杭州市中医院
李长明,邵荣学,邓小梅,赵士杰,王拓,全仁夫 杭州市萧山区中医院,杭州300;杭州市中医院
脊髓损伤(SCI)是一种严重的中枢神经系统损伤,具有较高的致残率,目前尚无效果很好的治疗方法。随着医疗技术水平的不断提高,生物支架以其良好的生物相容性被越来越多地应用于外科手术中。SCI的主要病理机制是轴突失连、神经细胞凋亡坏死等,导致机体不能进行有效的信号传导。诱导性多能干细胞(IPSCs)能将某些转录因子通过基因转染技术导入动物或人的体细胞内,使体细胞直接重构成为胚胎干细胞样的多潜能细胞;重构后的细胞具有与胚胎干细胞相似的自我更新能力和发育多潜能性,并可有效避免伦理问题,为SCI患者的康复带来了希望。2017年5月~2018年5月,本研究通过对尿液细胞进行重编程建立IPSCs,并对其进行神经干细胞(NSCs)方向的定向诱导分化,再将3D打印支架载IPSCs来源的NSCs移植至急性SCI大鼠的受损脊髓,观察其对受损脊髓的修复作用。现报告如下。
1 材料与方法
1.1 材料 实验动物:成年雄性SD大鼠56只,SPF级,体质量(220±10)g,购于湖南斯莱克景达实验动物有限公司。主要试剂:胶质纤维酸性蛋白(GFAP,ab53554)、聚乳酸-羟基乙酸共聚物(PLGA,aladdin P133293)、生长相关蛋白43(GAP-43,ab75810)、微管蛋白(β-tubulin Ⅲ,ab52623)均购于美国Abcam公司,硫酸肝素购于美国Sigma公司,巢蛋白抗体(Nestin,OM264981)购于美国OmnimAbs公司,神经元特异性烯醇化酶(NSE,bs-10445R)购于中国Bioss公司。主要仪器:荧光显微镜(CKX53)购于日本Olympus公司,3D打印机购于杭州捷诺飞生物科技有限公司,冷场发射高分辨扫描电镜(S-4300)购于日本Hitachi公司。
1.2 尿液细胞来源IPSCs向NSCs的定向分化及鉴定
1.2.1 尿液细胞来源IPSCs的分离 经杭州市萧山区中医院伦理委员会同意,采集1例23岁健康男性志愿者的尿液200 mL作为实验标本。参照Zhou等[1]的方法分离尿液细胞并重编程为IPSCs,方法如下:收集尿液进行细胞培养,按1∶2~1∶3传代。取第3代尿液细胞(呈现纤维样或上皮样,状态良好),使用Amaxa Basic Nucleofector试剂盒进行电转染。待IPSCs克隆出现后,以碱性磷酸酶检测试剂盒进行碱性磷酸酶活性检测(AP染色)。AP染色结果显示,尿液细胞来源的IPSCs克隆呈阳性。
1.2.2 IPSCs的鉴定 用玻璃针收集IPSCs克隆,并按1∶3~1∶5传代。使用4%多聚甲醛室温下固定15 min,0.25%(V/V)Triton X-100/PBS透膜10 min,室温下4%(W/V)BSA封闭1 h。4 ℃条件下加入抗OCT4(1∶350,兔多克隆)、抗NANOG(1∶1 000,兔单克隆)、抗TRA-1-81(1∶100,小鼠单克隆)、抗TRA-1-60(1∶100,小鼠单克隆)一抗孵育过夜,室温条件下加入山羊抗兔Alexa Fluor 488或568、山羊抗鼠Alexa Fluor 647二抗孵育30 min,以DAPI进行细胞核染色,荧光显微镜下观察并采集图像。结果显示,细胞核经DAPI染色呈现蓝色荧光,IPSCs特异性免疫标记物OCT4、NANOG、TRA-1-81、TRA-1-60均呈阳性表达。
1.2.3 IPSCs向NSCs的诱导分化 将消化下来的IPSCs集落移至培养皿中,差速贴壁 30 min,去除分化细胞及饲养层细胞,收集悬浮细胞集落。用EB培养基重悬,转移至细菌培养皿中悬浮培养,隔天换液。悬浮培养4 d即形成成熟的拟胚体(EBs),应用维甲酸(RA)+无血清培养基诱导,在EBs培养基中诱导培养4 d,换成无血清培养基贴壁培养。将筛选培养得到的神经球样克隆命名为IPSCs-NSCs。
1.2.4 IPSCs-NSCs的鉴定 ①免疫荧光鉴定:取1.2.3诱导分化后的细胞,将已爬好细胞的培养皿用4%多聚甲醛固定15 min,在培养皿内滴加5% BSA,37 ℃封闭30 min,移液枪吸掉封闭液;培养皿内滴加一抗Nestin(1∶200),4 ℃孵育过夜;PBS冲洗,移液枪吸干培养皿内多余液体后滴加FITC(1∶100)荧光二抗,37 ℃孵育45 min;PBS冲洗,滴加DAPI避光孵育5 min进行细胞核染色。PBS冲洗多余的DAPI,50%甘油封闭培养皿。荧光显微镜下显示IPSCs-NSCs特异性标志物Nestin表达阳性,呈现绿色荧光,细胞核经DAPI染色呈现蓝色荧光,证实该细胞为IPSCs-NSCs。②分化能力检测:取1.2.3诱导分化后的细胞,置于含10%胎牛血清的培养基中培养,培养瓶先用0.1%明胶包被,观察细胞形态变化,采用免疫荧光检测β-tubulinⅢ和GFAP表达。结果显示,GFAP目的蛋白呈现红色荧光,细胞核经DAPI染色呈现蓝色荧光,细胞向周围延伸,提示细胞分化能力良好;β-tubulinⅢ目的蛋白呈现红色荧光,细胞核经DAPI染色呈现蓝色荧光,β-tubulinⅢ星形胶质细胞大量表达,提示细胞分化能力良好。证实成功进行IPSCs向NSCs的定向分化,并制备IPSCs-NSCs。
1.3 海马来源NSCs(Hd-NSCs)的分离、培养及鉴定
1.3.1 Hd-NSCs的分离、培养 将新生(出生24 h内)的SD大鼠乙醇浸泡5 min,取出置于超净平台中;沿后中线开颅,Hanks液冲洗脑膜,取整个脑组织置于预先放有解剖液的无菌培养皿中;分离、取出海马齿状回,并剪碎、吹打;150目滤网过滤细胞匀浆,Hanks液清洗后加入0.25%胰蛋白酶,37 ℃条件下消化30 min,弃胰酶、加入DMEM/F12培养液终止消化,铜网过滤并离心,制成单细胞悬液。0.4%台盼蓝染色观察细胞存活率,细胞计数后接种,调整细胞密度为4×105~5×105/mL。培养液为添加B27(2%)、bFGF(20 ng/mL)、EGF(20 ng/mL)的DMEM/F12无血清培养基。细胞置于37 ℃、5% CO2培养箱中悬浮培养,隔日换液。
1.3.2 Hd-NSCs的鉴定 ①SABC免疫细胞化学染色:培养第6天,显微镜下可见神经球,离心后制备单细胞悬液;吹打并取出少量滴加于经多聚赖氨酸处理的盖玻片上,表面加少量DMEM无血清培养基,PBS液洗涤,冷风吹干。4%多聚甲醛固定,6 h后行常规SABC免疫细胞化学染色,一抗为Nestin (1∶400)。荧光显微镜下观察Hd-NSCs特异性蛋白Nestin呈现红色荧光,细胞核经DAPI染色呈现蓝色荧光。②Hd-NSCs向神经元方向分化能力观察:将培养3代的悬浮生长的细胞克隆离心(500 r/min),吹打为单细胞悬液,种植在经多聚赖氨酸处理过的盖玻片上,放于6孔培养皿中。每天观察细胞生长状态,常规换液。在分化1、3、5、7 d时,取出盖玻片,常规进行NSE免疫细胞化学染色(一抗工作液浓度1∶200),同时观察神经元的形态变化。结果显示,随着分化时间的延长,NSE表达增加,提示细胞分化能力良好。③神经元鉴定:参照1.2.3的培养条件,将神经球种植于经多聚赖氨酸处理的载玻片上,添加含有10%胎牛血清、NGF(1 ng/mL)、IGF-1(2 ng/mL)、胰岛素(25 μg/mL)的DMEM/F12培养基分化细胞。分别于分化1、3、5、7 d取出载玻片,进行漂洗、固定、常规SABC免疫细胞化学染色,DAB显色,荧光显微镜观察GAP-43的表达。结果显示,随着分化时间的延长,Hd-NSCs特异性蛋白GAP-43表达增加,提示神经元发育与再生能力良好。
1.4 3D打印脊髓支架(简称3D支架)的制备 采用3D打印技术联合真空冷冻干燥法。取Ⅰ型胶原蛋白100 mg、Ⅱ型胶原蛋白10 mg以及硫酸肝素1 mg,加入 PLGA 200 mg,充分混匀。打开氮气,将配制好的浆料置于物料桶内,设置好分压。选择打印针头并进行物料出料校准,设置与调节打印参数,包括出料温度、平台温度等。三维支架成型,室温下放置4 h以上,45、60 ℃分别恒温干燥箱中持续干燥12 h。100倍电镜下观察显示,制备的3D支架具有完美的内部三维立体多孔结构,支架横截面扫描电镜显示内部呈三维立体疏松多孔结构,孔径大小为50 μm左右。
1.5 支架细胞预处理 将3D支架截成2~3 mm的小段,置于干细胞培养基中浸泡48 h,在无菌操作台中风干,灭菌备用。将IPSCs-NSCs和Hd-NSCs培养至第7天时,消化计数;将1×106个细胞浓缩为0.2 mL,分别滴于预处理过的3D支架上,置于培养箱中2 h,用于后续实验。
1.6 建模与分组处理 将56只SD大鼠按照随机数字表法分为4组,每组14只。各组均按照以往的方法[2]用可控性皮质脊髓撞击仪构建急性SCI模型,以开放领域运动测试(BBB)评分为0分定义为建模成功。常规护理1周,采用10%水合氯醛(0.3 mL/100 mg)进行腹腔注射麻醉,去除椎板,将损伤处的脊髓切除2~3 mm。IPSCs-NSCs组植入1.5中载IPSCs-NSCs的3D支架,Hd-NSCs组植入1.5中载Hd-NSCs的3D支架,模型组植入DMEM培养液0.2 mL,支架模型组植入载DMEM培养液0.2 mL的3D支架。
1.7 修复效果评价 ①BBB评分:术后2~8周,对各组大鼠后肢的运动情况进行BBB评分,BBB总分为21分,分数越高表示运动情况越好;②Tarlov、Rivlin评分:术后8周采用Tarlov和 Rivlin评分对各组大鼠后肢的运动功能进行评价,Tarlov、Rivlin评分越高表示运动功能越好;③运动、感觉诱发电位:术后8周采用诱发电位仪检测各组大鼠的运动、感觉诱发电位;④病理观察:术后8周处死各组大鼠,取受损节段脊髓组织,制备石蜡切片,HE染色观察病理改变。

2 结果
2.1 各组大鼠术后不同时间点BBB评分比较 见表1。
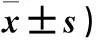
表1 各组大鼠术后BBB评分比较(分,
2.2 各组大鼠Tarlov、Rivlin评分比较 见表2。
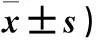
表2 各组大鼠Tarlov、Rivlin评分比较(分,
2.3 各组运动、感觉诱发电位比较 IPSCs-NSCs组、Hd-NSCs组运动和感觉诱发电位潜伏期均短于模型组、支架模型组,运动和感觉诱发电位振幅均高于模型组、支架模型组(P均<0.05)。IPSCs-NSCs组、Hd-NSCs组运动和感觉诱发电位潜伏期、振幅比较差异均无统计学意义,支架模型组、模型组上述指标比较差异均无统计学意义(P均>0.05)。见表3。

表3 各组大鼠运动、感觉诱发电位比较
2.4 各组病理改变比较 模型组脊神经受到损伤,组织水肿,细胞稀疏,细胞间隙明显增大;支架模型组细胞生长较模型组稍紧密,空泡减少;IPSCs-NSCs组、Hd-NSCs组脊神经生长良好,组织生长间隙缩小,空泡减少,无组织水肿。
3 讨论
急性SCI常见于暴力性外伤,具有较高的致残率及病死率[3]。SCI的治疗以外科手术为主,药物及康复为辅,但这些常规治疗方法缺乏特异性且疗效不佳。近年来,组织工程学的兴起给SCI的治疗提供了新方向,生物支架+种子细胞+神经因子的联合移植修复被认为是治疗神经损伤的最佳疗法[4, 5]。NSCs具有永久的增殖能力及多向分化功能,可分化成星形和少突胶质细胞、神经元,具有营养神经、调节免疫和修复神经损伤的作用,在治疗神经系统疾病中的前景较好[6]。但是,来源于人类胎儿组织或者胚胎干细胞的NSCs通常存在伦理问题。IPSCs可将目的基因克隆到病毒载体中,然后导入机体成纤维细胞中,诱导其分化,并且不会发生免疫排斥[7]。IPSCs可以作为NSCs的来源,但IPSCs本身提取效率较低,导致该技术应用受限。目前,IPSCs可以从人成纤维细胞、人角质细胞[8]、小鼠肝脏细胞[9]、人脐带血细胞[10]以及脂肪来源细胞[11]中通过重编程获得,但是大部分方法是有创取样,导致样本收集十分困难。
Zhou等[1]首次将人尿液细胞诱导为IPSCs,该方法具有无创且费用低的优点。人体肾小管网络庞大,每天有2 000~7 000个细胞从尿道、输尿管上皮、膀胱、肾小管上皮脱落,并随尿液排出体外[12]。这些细胞大部分保留有正常的功能且容易获得,是进行体外研究的理想细胞来源。本研究成功收集了尿液细胞为细胞来源并诱导出IPSCs,且该IPSCs特异性免疫标记物OCT4、NANOG、TRA-1-81、TRA-1-60均呈阳性表达。宋旆文等[13]利用体外实验制备骨髓间充质干细胞条件培养基,将其与NSCs共同培养,发现条件培养基可以促进神经干细胞向神经元的分化,而向星形胶质细胞的分化减少。本研究结果显示,IPSCs-NSCs在培养基中稳定增殖,体积不断增大,培养液中神经球数量亦不断增多;GFAP目的蛋白呈现红色荧光,细胞核经DAPI染色呈现蓝色荧光,细胞向周围延伸,提示细胞分化能力良好;β-tubulinⅢ目的蛋白呈现红色荧光,细胞核经DAPI染色呈现蓝色荧光,提示细胞分化能力良好。这证实成功将尿液细胞重编程为IPSCs,并诱导其分化为NSCs。
生物支架与种子细胞具有良好的相容性是组织工程学治疗SCI的基础,生物支架在治疗中应确保种子细胞保留在脊髓损伤部位,从而发挥调节微环境、填充病变腔并诱导其定向生长的作用[14]。3D支架是中空多孔的结构,为上下行传导束的重建和轴突生长提供通道,并除去物理隔离,对改善其物理微环境具有重要作用。本研究打印的3D支架孔径约为50 μm,为细胞依附和增殖提供有利空间。曹宗锐等[15]研究显示,采用胶原硫酸肝素制备的3D支架与NSCs具有较好的相容性。本研究Hd-NSCs和IPSCs-NSCs均能在3D支架孔中黏附、存活以及生长,表明该3D支架为Hd-NSCs和IPSCs-NSCs提供了较好的微环境,该3D支架与细胞之间具有较好的相容性。
脊髓损伤后局部胶质瘢痕形成,上下行神经传导束中断,微环境受损。因此,完整的脊髓是保证完整的纤维束、神经元间互相正常联络的关键[16]。张仁坤等[17]采用生物支架联合神经细胞治疗SCI,结果显示患者的BBB评分、神经电生理评分均明显改善。Ren等[18]对SCI犬进行组织工程学治疗,结果发现其治疗后的运动及纤维再生能力明显改善。本研究结果显示,IPSCs-NSCs组、Hd-NSCs组术后2~8周BBB评分、神经电生理检测结果以及术后8周的Tarlov、Rivlin评分均高于模型组和支架模型组,而IPSCs-NSCs组、Hd-NSCs组比较并无统计学差异。本研究病理观察结果显示,IPSCs-NSCs组、Hd-NSCs组脊神经纤维生长良好,组织生长间隙缩小,空泡减少,无组织水肿;这表明尿液细胞来源IPSCs-NSCs移植能促进脊神经纤维生长,为神经细胞生长提供较好的微环境,其效果与Hd-NSCs相当。
